血管内皮生长因子165和肝细胞生长因子促心肌梗死后心肌细胞增生机制的研究*
钱雪松,安丰慧,刘普,陈波,李春坚,王连生,杨志健,陶正贤
血管内皮生长因子165和肝细胞生长因子促心肌梗死后心肌细胞增生机制的研究*
钱雪松**,安丰慧,刘普,陈波,李春坚,王连生,杨志健,陶正贤
目的: 探讨血管内皮生长因子165(VEGF165) 和肝细胞生长因子(HGF)促进心肌梗死后心肌细胞增生机制的异同。
心肌梗死;血管内皮生长因子;肝细胞生长因子;增生
(Chinese Circulation Journal, 2014,29:634.)
心肌梗死是一类严重威胁人类健康的急重症。现有的治疗手段,包括药物治疗、血管介入成形术和外科血管搭桥术,主要强调血运重建,而对心肌梗死后心肌细胞丢失和梗死后的心肌细胞丢失的补充并无“良方”。多种生长因子与心绞痛严重程度相关[1],而血管内皮生长因子(VEGF)[2]、成纤维细胞生长因子[3]和肝细胞生长因子(HGF)[4]等能诱导梗死后心肌血管新生、抗心肌细胞凋亡而改善心脏功能,为心肌梗死提供了新的治疗策略。
1 材料与方法
材料:心电监护仪:V24E,飞利浦;呼吸机:Newport E100m Ventilator, 美国纽邦医疗器械公司;气管插管:塑料气管插管(5.5,6.0,6.5,7.0,7.5),美国Sheridan公司;喉镜:Kawe牌特制难度插管喉镜,德国Kawe公司;无创伤缝针及无创伤滑线:带双头针7-0聚丙烯(prolene)滑线;蛋白电泳仪、垂直电泳槽、转移电泳槽(Mini Trans-Blot Cell型)均为美国Bio-RAD公司产品;BIO-RAD680型全自动酶标仪,美国Bio-RAD公司;BX51型正置荧光显微镜,日本Olympus公司;DP70型图像采集系统,日本Olympus公司;门控单光子发射计算机成像仪(G-SPECT,ECAM+; Siemens, 德国);99Tcm-甲氧基异丁基异腈(99Tcm-MIBI):南京森科医药有限公司;EnSite NavX系统:St. Jude Medicine, Inc.,USA;注射导管:上海微创公司。抗体:单克隆大鼠抗Akt抗体(美国Santa Cruz公司);单克隆兔抗磷酸化Akt抗体(美国Santa Cruz公司);单克隆大鼠抗p21抗体(美国Santa Cruz公司);单克隆大鼠抗p27抗体(美国Santa Cruz公司);单克隆小鼠细胞周期蛋白A(Cyclin A)、Cyclin D1、 Cyclin D2、 Cyclin E(美国Sigma公司);单克隆周期蛋白依赖性激酶(cdk)2、cdk4(美国Cell Signaling Technology公司);单克隆小鼠抗β-actin抗体(美国Santa Cruz公司);Protease inhibitor cocktail tablets(瑞士Roche公司);Chemiluminescent Substrate kit(美国Pierce公司)。
方法:①载体构建:在本研究中,使用的 VEGF165、HGF均 为 人 VEGF165(human VEGF165, hVEGF)和HGF(human HGF, hHGF)。从人胎肝中抽提总RNA,并以该肝细胞总RNA为模版,利用合成的一对引物,采用RT-PCR技术获得HGF基因的cDNA,并引入酶切位点。利用AD-EASYTM系统,构建HGF基因重组腺病毒载体(Ad- HGF)系统。将已引入酶切位点的HGF基因的cDNA,先转入感受态质粒,再转化大肠杆菌进行扩增,筛选阳性菌落,经酶切及测序,证实HGF基因已经正确转入,再将该基因转入pUC18质粒,pUC18质粒与AD-EASY质粒进行同源重组,用PacI酶切成线性化DNA,利用脂质胺转染293细胞,经三轮扩增,制备高效表达Ad- HGF。同样方法构建VEGF基因重组腺病毒载体(Ad-VEGF)。具体构建方法同前[5]。②动物模型构建和心肌注射:我们于2012-01至2013-01选择雄性中华小型猪15头,平均体重(36±2.6) kg,年龄3~4个月。所有实验动物的管理均遵循中华人民共和国卫生部动物实验管理条例和南京医科大学实验动物管理条例。术前禁食、禁水4小时。在诱导麻醉、气管插管、开通静脉通道和复合麻醉后,自下而上沿前正中线剪开胸骨,氩气电刀电灼骨膜出血点,胸骨牵开器自正中撑开胸骨。暴露心包和肺脏。纵形切开心包,钝性剥离心包,暴露心脏,并用7号手术线固定心包。显露左前降支,于左前降支中远端第二对角支处用无创针线7.0 prolene预结扎(不全部阻断血流)10 min,然后结扎,构建心肌梗死模型。实验动物分成3组:对照组(n=5)、Ad-VEGF组(n=5)、Ad-HGF组(n=5)。将溶解在1ml HEPES(pH=7.4)总量1×1010pfu的Ad-VEGF和Ad-HGF分别心肌局部注射到心肌梗死周围区,注射分5点,相同剂量的生理盐水注射到对照组。具体构建和心肌注射方法同前[5]。③心肌灌注和心脏功能检测:治疗前和治疗后4周用G-SPECT检测心肌灌注和心脏功能。静注99Tcm-MIBI后60~90 min,行G-SPECT心肌灌注核素显像。将左心室分为17个节段,左前降支分为7个节段[6]。采用5分评分法对各节段心肌的核素放射性分布进行评分[7]:0分:无分布;1分:分布严重降低;2分:分布减低;3分:分布轻度减低;4分:分布正常。正常左前降支为28分。采用GS Quant自动勾边技术勾画出垂直长轴和水平长轴的左心室舒张末期及收缩末期心腔轮廓,计算机三维拟合数学模型计算出左心室舒张末期容积(LVEDV)和左心室收缩末期容积( LVESV),由公式算出左心室射血分数( LVEF),LVEF=(LVEDV-LVESV)/LVEDV×100%。④蛋白免疫印迹(Western blotting)和免疫共沉淀( IP):在治疗后4周,心肌灌注和心脏功能检测后,取三组动物左心室正常心肌、梗死心肌、梗死移行区心肌,提取蛋白、电泳、转膜、抗体孵育等,进行Western blotting和IP,具体检测方法同前[5]。⑤免疫荧光检测:在治疗后4周,心肌灌注和心脏功能检测后,取三组动物左心室正常心肌、梗死心肌、梗死移行区心肌,进行石蜡包埋、切片、抗体孵育等,进行免疫荧光检测,检测方法同前[5]。
统计学分析:每组经4次独立实验,数据用均数±标准差表示,用SPSS 16.0软件进行单因素方差分析和t检验,P<0.05为差异有统计学意义。
2结果
VEGF165和HGF在缺血心肌的表达:心肌治疗4周后,通过免疫印迹法检测VEGF和HGF的表达。结果显示:在Ad-VEGF组(图1A),心肌梗死区(I)和梗死周围区(P)的VEGF表达分别为正常心肌(N)的2.21倍和2.18倍(P<0.01),差异有统计学意义。而对照组心肌梗死区(I)和梗死周围区(P)与正常心肌(N)VEGF表达差异无统计学意义(P>0.05);在Ad-HGF组(图1B),心肌梗死区(I)和梗死周围区(P)的HGF表达分别为正常心肌(N)的1.73倍和1.69倍(P<0.01),差异有统计学意义。而对照组心肌梗死区(I)和梗死周围区(P)与正常心肌(N)HGF表达差异无统计学意义(P>0.05)。
VEGF165和HGF改善梗死后心脏功能和心肌灌注:治疗前和治疗后4周用G-SPECT检测心肌灌注和心脏功能,结果显示:Ad-VEGF组和Ad-HGF组心肌灌注(图2A、2B)和左心室射血分数(图2A、2C)治疗后4周和治疗前比较,差异均有统计学意义(P<0.01)。
VEGF165和HGF促进梗死后心肌细胞增生:通过增值细胞核抗原(Ki67)和肌钙蛋白T(Troponin T)荧光共染检测VEGF165和HGF促进梗死后心肌细胞增生。如图3所示,Ki67阳性细胞数、总细胞数、阳性细胞百分比在Ad-VEGF组分别为9.80±2.31/mm2、45.85±5.72/mm2、(21.78±6.3)%,在Ad-HGF组分别为9.20±3.43/mm2、46.70±7.99/ mm2、(19.72±6.31)%,在对照组分别为1.90±0.97/ mm2、22.30±6.86/mm2、(8.82±5.59)%。Ad-VEGF和Ad-HGF组的Ki67阳性细胞数、总细胞数、阳性细胞百分比分别与对照组比较差异均具有统计学意义(P均<0.01)。
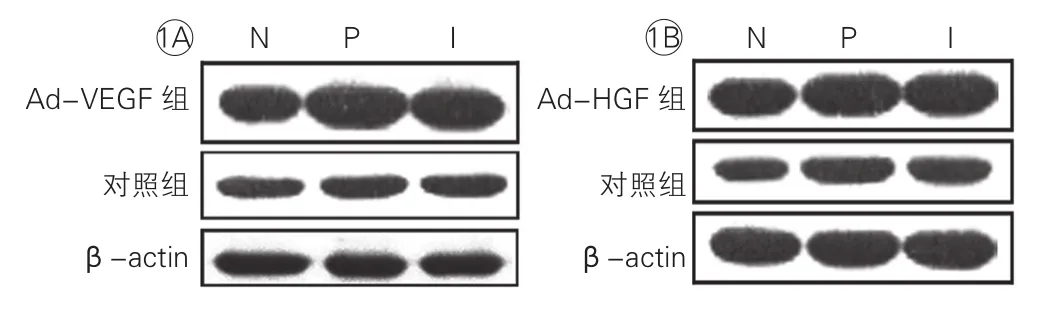
图1 血管内皮生长因子165和肝细胞生长因子表达
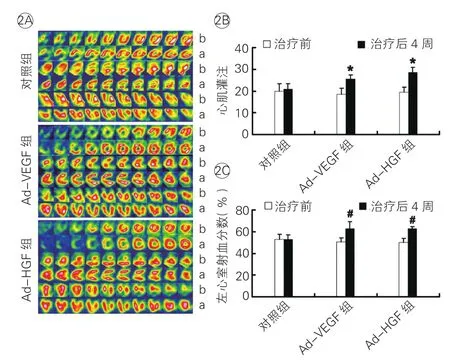
图2 三组在治疗前后的心肌灌注和左心室射血分数比较
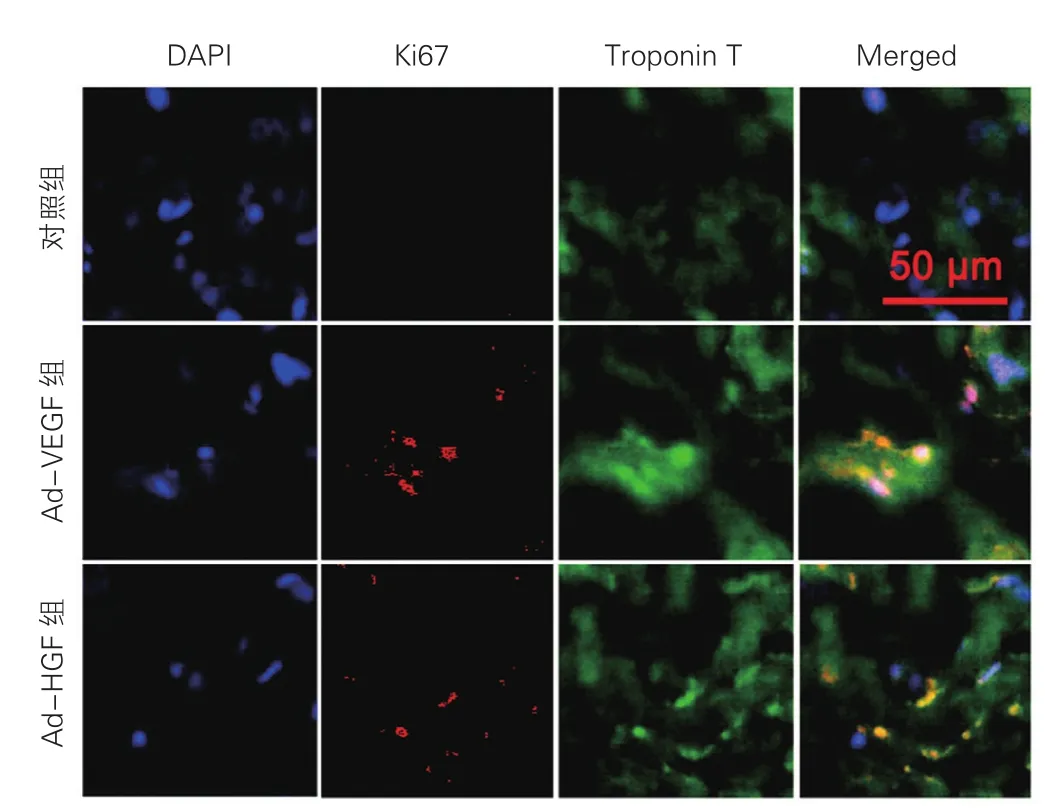
图3 三组梗死后心肌细胞增生
VEGF165促进梗死后心肌细胞增生机制:为阐明VEGF165促进梗死后心肌细胞增生机制,通过免疫共沉淀分析梗死后心肌细胞增生途径,如图4所示,在Ad-VEGF组,细胞周期蛋白p21在梗死周围区和梗死区表达分别与正常心肌比较差异均无统计学意义(P>0.05);正常心肌细胞周期蛋白p27表达分别是梗死区和梗死周围区2.23倍和2.90倍,差异均有统计学意义(P<0.01),而梗死区心肌Cyclin D2、cdk4、Cyclin A、cdk2表达分别是正常心肌的1.61倍、3.02倍、3.06倍、2.16倍,梗死周围区心肌Cyclin D2、cdk4、Cyclin A、cdk2表达分别是正常心肌的1.73倍、2.98倍、3.29倍和2.31倍,差异均具有统计学意义(P均<0.01)。
HGF促进梗死后心肌细胞增生机制:为阐明HGF促进梗死后心肌细胞增生机制,通过免疫共沉淀分析梗死后心肌细胞增生途径,如图5所示,在Ad-HGF组,正常心肌p21表达分别是梗死区和梗死周围区1.93和2.05倍、p27表达分别是梗死区和梗死周围区的2.23和2.90倍,而梗死区心肌Cyclin A 、Cyclin E、cdk2表达分别是正常心肌1.94倍、1.93倍和2.11倍,而梗死周围区心肌Cyclin A、Cyclin E、cdk2表达分别是正常心肌的2.14倍、2.01倍和2.09倍;梗死区和梗死周围区心肌Cyclin D1表达分别是正常心肌 1.94和2.06倍,cdk4表达分别是正常心肌的2.08和1.99倍,差异均具有统计学意义(P均<0.01)。
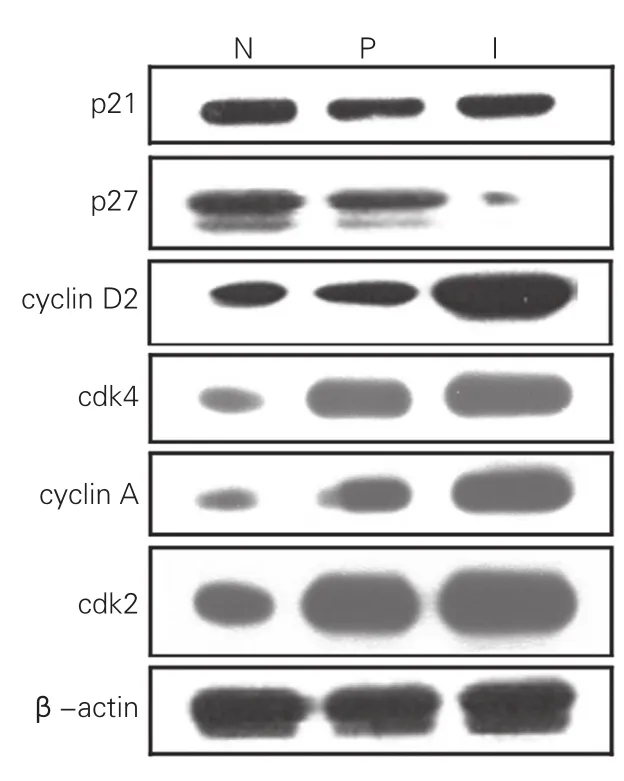
图4 血管内皮生长因子165促进梗死后心肌细胞增生途径情况
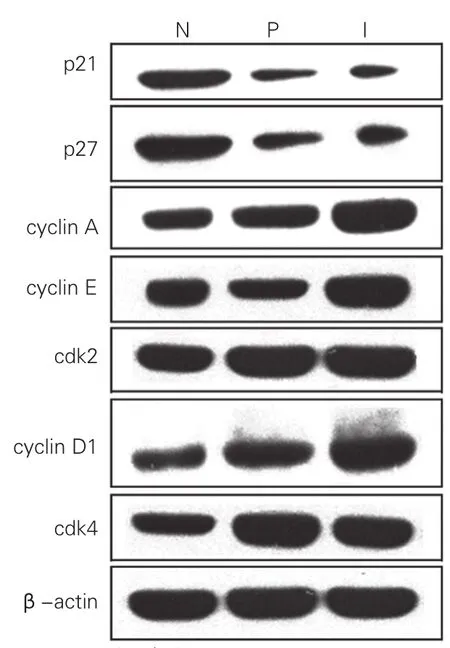
图5 肝细胞生长因子促进梗死后心肌细胞增生途径 。
3 讨论
传统观点认为心肌细胞在出生后即向终末分化,不能够复制,并且成年心肌组织中没有储存的心肌祖细胞,心肌损伤后心肌细胞不具有内源性再生能力,因此心肌受损后心肌细胞不能再生,被疤痕组织代替,最终导致心脏的收缩功能受损[8]。随着干细胞和再生生物学的发展,这一传统观念引起越来越多的争论和质疑。目前的研究表明,哺乳动物出生后心脏具有增生能力[9,10]。随着心肌损伤后心肌组织具有再生能力资料的积累,如何促进心肌梗死后心肌细胞再生以补充丢失的心肌细胞,从而修复损伤心肌、恢复或改善心脏功能成为新的研究热点。
目前,促心肌细胞新生研究主要集中在两个方面:第一,通过干细胞定向分化修复心肌组织;第二,通过各种因子促进血管新生和心肌细胞新生修复心肌组织。然而外源性细胞治疗心肌梗死面临着来源、扩增、定向分化、移植后免疫反应、伦理学等诸多问题,因此内源性心肌细胞新生成为新的研究热点。
多种因子促进心肌细胞增生已有报道。Engel等[11]用bFGF和p38抑制剂治疗梗死心肌时发现,联合应用bFGF和p38可促进心肌细胞增生。Nakajima 等[12]发现突变的p193和p53可使梗死后心肌重新进入细胞周期,促进心肌细胞增殖。Smart等[13]证实,胸腺素β4可促进血管新生和心肌细胞新生,并改善梗死后心脏功能。随着研究的深入,越来越多的证据表明,通过多种细胞因子可促进心肌细胞增生。
本研究进一步证实,VEGF165和HGF可改善心肌梗死后心肌灌注和心脏功能,比较两组实验动物可知,VEGF165和HGF可对心肌梗死后心肌灌注和心脏功能改善程度上并无差异。同时也证实VEGF165和HGF可促心肌梗死后心肌细胞增生,但无论是Ki67阳性细胞数、总细胞数、Ki67阳性细胞数和总细胞百分比两组间并无统计学差异,这可能是两组实验动物心脏功能改善无差异原因之一。
进一步研究发现VEGF165促心肌梗死后心肌细胞增生与Cyclin A和Cyclin D2/cdk4有关,而HGF促心肌梗死后心肌细胞增生与Cyclin A、Cyclin E和CyclinD1有关。Woo等[14]使用Cyclin A2处理缺血后心功能衰竭心脏,提示Cyclin A2促进心肌细胞再生,并改善心脏功能。Tamamor等[15]也发现Cycling D1和Skp2泛素链激酶可促进梗死后心功能衰竭心脏的心肌细胞增生。表明心肌细胞周期蛋白与心肌细胞增生有关。
为比较VEGF165和HGF可促心肌梗死后心肌细胞增生机制,本研究发现VEGF165通过p27途径,而HGF通过p21和p27两条途径。无论是p21还是p27只有与Cyclin/cdk结合,才能通过细胞核,引起心包有丝分裂,促进心肌细胞增生。进一步研究发现,虽然VEGF165和HGF促心肌梗死后心肌细胞增生都与p27有关,但其下游途径并不相同,VEGF165与Cyclin A/cdk2和Cyclin D2/cdk4有关,而 HGF与 Cyclin A/cdk2、Cyclin E/cdk2和 Cyclin D1/cdk4有关。
总之,本研究证实VEGF165和HGF可改善心肌梗死后心肌灌注和心脏功能,促进梗死心脏心肌细胞增生,但VEGF165和HGF促心肌细胞增生途径不同。至于合用VEGF165和HGF是否可进一步增加梗死后心脏心肌细胞数量,减少心肌梗死面积,提高梗死后心肌灌注和心脏功能,有待于以后的实验深入研究。
[1] 冯青俐, 党瑜华.肝细胞生长因子与冠状动脉狭窄程度的相关性研究. 中国循环杂志, 2005, 20: 102-104.
[2] Testa U, Pannitteri G, Condorelli GL. Vascular endothelial growth factors in cardiovascular medicine. J Cardiovasc Med, 2008, 9: 1190-1221.
[3] Beenken A, Mohammadi M. The FGF family: biology, pathophysiology and therapy. Nat Rev Drug Discov, 2009, 8: 235-253.
[4] Xu Z, Tao Z, Yang Y, et al. Cardiac-Specific Expression of the Hepatocyte Growth Factor (HGF) Under the Control of a TnIc Promoter Confers a Heart Protective Effect After Myocardial Infarction (MI). Curr Gene Ther, 2014, 14: 63-73.
[5] Chen B, Tao Z, Zhao Y, et al. Catheter-based intramyocardial delivery (NavX) of adenovirus achieves safe and accurate gene transfer in pigs. PLoS One, 2013, 8: e53007.
[6] Cerqueira MD, Weissman NJ, Dilsizian V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: a statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation, 2002, 105: 539-542.
[7] Poornima IG, Miller TD, Christian TF, et al. Utility of myocardial perfusion imaging in patients with low-risk treadmill scores. J Am Coll Cardiol, 2004, 43: 194-199.
[8] Anversa P, Nadal-Ginard B. Myocyte renewal and ventricular remodelling. Nature, 2002, 415: 240-243.
[9] Kajstura J, Gurusamy N, Ogórek B, et al. Myocyte turnover in the aging human heart. Circ Res, 2010, 107: 1374-1386.
[10] 王振华, 聂宇, 郑哲. 心肌再生的研究进展. 中国循环杂志, 2011, 26: 480-482.
[11] Engel FB, Hsieh PC, Lee RT, et al. FGF1/p38 MAP kinase inhibitor therapy induces cardiomyocyte mitosis, reduces scarring, and rescues function after myocardial infarction. Proc Natl Acad Sci USA, 2006, 103: 15546-15551.
[12] Nakajima H, Nakajima HO, Tsai SC, et al. Expression of mutant p193 and p53 permits cardiomyocyte cell cycle reentry after myocardial infarction in transgenic mice. Circ Res, 2004, 94: 1606-1614.
[13] Smart N, Risebro CA, Melville AA, et al. Thymosin b4 induces adult epicardial progenitor mobilization and neovascularization. Nature, 2007, 445: 177-182.
[14] Woo YJ, Panlilio CM, Cheng RK, et al. Therapeutic delivery of cyclin A2 induces myocardial regeneration and enhances cardiac function in ischemic heart failure. Circulation, 2006, 114(1 Suppl): I206-213.
[15] Tamamori-Adachi M, Takagi H, Hashimoto K, et al. Cardiomyocyte proliferation and protection against post-myocardial infarction heart failure by cyclin D1 and Skp2 ubiquitin ligase. Cardiovasc Res, 2008, 80: 181-190.
VEGF 165 and HGF Improving Cardiomyocyte Proliferation in Experimental Porcine After Myocardial Infarction
QIAN Xue-song***, AN Feng-hui, LIU Pu, CHEN Bo, LI Chun-jian, WANG Lian-sheng, YANG Zhi-jian, TAO Zheng-xian.
Department of Cardiology, The People’s Hospital of Jiangsu Province, Nanjing (210029), Jiangsu, China
TAO Zheng-xian, Email: zxtao@njmu.edu.cn
Objective: To investigate the mechanism of vascular endothelial growth factor ( VEGF)165 and hepatocyte growth factor (HGF) improving cardiomyocyte proliferation in experimental porcine after myocardial infarction (MI).Methods: The MI model was established by left anterior descending artery ligation in 15 male pigs and the animals were divided into 3 groups, n=5 in each group. Control group, the pigs received normal saline injection at the infarct and peri-infarct zones. VEGF group, the pigs received (1×1010) pfu of viral titers of Ad-VEGF injection. HGF group, the pigs received (1×1010) pfu of viral titers of Ad-HGF injection. The myocardial perfusion and cardiac function were examined by SPECT, the protein expressions of VEGF165 and HGF were measured by Western blot analysis, cardiomyocyte proliferation was analyzed by immunof l uorescence and immunoprecipitation method.Results:① Compared with Control group, the expressions of VEGF165 and HGF were higher at the infarct and peri-infarct zones in both treatment groups;② Both treatment groups had better cardiac function and myocardial perfusion;③ Both treatment groups had improved cardiomyocyte proliferation at the infarct and peri-infarct zones.④VEGF165 promoted cardiomyocyte proliferation via p27 pathway; ⑤HGF promoted cardiomyocyte proliferation via p21 and p27 pathways.Conclusion: VEGF165 and HGF could improve myocardial perfusion and function in experimental porcine afterMI, VEGF165 and HGF promote cardiomyocyte proliferation via different pathways.
Myocardial infarction; Vascular endothelial growth factor; Hepatocyte growth factor; Proliferation
2013- 03-28)
(编辑: 汪碧蓉)
江苏省自然科学基金(BK2010021);国家自然科学基金(81170102);江苏省高校“青蓝工程”科技创新团队带头人科研项目(JX2161015030)
210029 江苏省南京市,江苏省人民医院 心脏科(钱雪松、陈波、李春坚、王连生、杨志健、陶 正贤);伊犁州友谊医院 心脏科(安丰慧、刘普)
钱雪松 副主任医师 学士**现在张家港市第一人民医院 心脏科***Now working in The First People's Hospital of Zhangjiagang
陶正贤 Email: zxtao@njmu.edu.cn
R445.1
A
1000-3614( 2014 ) 08-0634-05
10.3969/j. issn. 1000-3614. 2014.08.019
方法:将15头雄性中华小型猪结扎冠状动脉左前降支构建心肌梗死模型。实验动物分成三组:对照组、VEGF基因重组腺病毒载体组(Ad-VEGF组)、HGF基因重组腺病毒载体组(Ad- HGF组) ,每组5只。将1×1010pfu的Ad-VEGF和Ad-HGF分别局部注射到Ad-VEGF组和Ad- HGF组猪的心肌梗死周围区,相同剂量的生理盐水注射到对照组。通过门控单光子发射计算机成像仪检测心肌灌注和心脏功能,通过免疫印迹法检测VEGF165和HGF在心肌的表达,采用免疫荧光双染和免疫共沉淀分析心肌细胞增生。
结果: ①在Ad-VEGF组,心肌梗死区和梗死周围区的VEGF165表达明显高于正常心肌(P<0.01);在Ad-HGF组,心肌梗死区和梗死周围区的HGF表达明显高于正常心肌(P<0.01)。②高表达的VEGF165和HGF改善梗死后心肌灌注和心脏功能。③VEGF165和HGF可促进梗死区和梗死周围区心肌细胞增生。④VEGF165通过 p27促心肌细胞增生。⑤HGF通过 p21和p27促心肌细胞增生。
结论: VEGF165和HGF改善梗死后心肌灌注和心脏功能,促心肌细胞增生,但VEGF165和HGF促心肌细胞增生途径不同。

