HMGB1基因沉默对氧糖剥夺/复氧所致星形胶质细胞损伤的保护作用
汶海琪,罗勇,陈瑞芳,李满,庞月珊,谢宸宸
脑缺血为临床常见病和多发病,缺血再灌注损伤是其重要的病理损伤环节,研究其机制对该病的临床治疗具有重要意义。高迁移率族蛋白1(high mobility group box 1,HMGB1)作为一种重要的炎症介质,在脑缺血后表达量明显升高并可持续数周[1-2],释放后主要和细胞表面的晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)、Toll样受体2(Toll like receptors,TLR-2)、Toll样受体4(TLR-4)结合,促进炎症级联反应,引起下游炎症介质的释放,进而引起组织细胞损伤[3]。星形胶质细胞作为大脑中数量最多的细胞,具有支持、营养、信号传递等重要作用,越来越多的证据表明其在脑缺血再灌注损伤中扮演着重要角色[4-6]。本研究通过RNA干扰技术沉默HMGB1的表达,在体外对大鼠原代星形胶质细胞进行氧糖剥夺/复氧以模拟在体脑缺血再灌注损伤,观察HMGB1表达的变化情况,探讨RNA干扰抑制HMGB1表达是否对氧糖剥夺/复氧的星形胶质细胞具有保护作用。
1 材料与方法
1.1 实验动物 新生24h内Sprague-Dawley大鼠40只,雌雄兼有,由重庆医科大学实验动物中心提供,许可证号:SCXK(渝)2012-0001。
1.2 主要试剂 DMEM高糖、胎牛血清(美国Gibco),无糖DMEM培养基(中国钮因华信),慢病毒载体HMGB1siRNA试剂盒(上海吉凯公司),HMGB1抗体(美国Abcam),GFAP抗体(美国CST公司),β-actin抗体、兔抗羊IgG抗体、羊抗小鼠FITC、辣根过氧化物酶标记的山羊抗兔二抗、辣根过氧化物酶标记的山羊抗小鼠二抗、MTT试剂盒、蛋白测定试剂盒、蛋白裂解试剂盒(碧云天),HMGB1ELISA检测试剂盒(武汉华美),LDH检测试剂盒(南京建成),RT-PCR试剂盒(日本TaKaRa)。
1.3 方法
1.3.1 原代星形胶质细胞培养与鉴定 取出生24h以内的新生SD乳鼠,在无菌条件下剪取出大脑皮质,以2.5g/L胰蛋白酶37℃消化30min后加入完全培养基终止消化,吹打后200目筛网过滤,1000r/min离心5min,取离心后沉淀,加入培养液吹打形成次细胞悬液,利用差速黏附法将细胞悬液加入培养瓶中,放入培养箱30min后,倒转培养瓶,吸出液体,800r/min离心5min,弃去上清液,再加入完全培养基形成细胞悬液,台盼蓝染色计数后按5.0×104个/cm2密度置于已包被多聚赖氨酸的培养瓶中,置CO2孵箱中37℃培养,3d换液1次,培养至第3代得到成熟的原代星形胶质细胞[7],用针对星形胶质细胞的胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)免疫细胞化学法对所培养的星形胶质细胞进行鉴定及纯度计算。
1.3.2 RNA干扰原代星形胶质细胞的HMGB1表达慢病毒包装HMGB1-RNA干扰序列参考Hayakawaa等[8]的报道,由上海吉凯公司合成,序列为5'-GAT CCCGAAGCACCCGGATGCTTCTTTCAAGAGAAG AAGCATCCGGGTGCTTCTTTTTTGGAAA-3'。将星形胶质细胞分为3组:①未转染HMGB1siRNA的正常星形胶质细胞对照组;②HMGB1siRNA组:转染慢病毒载体的HMGB1siRNA,转染操作步骤按说明书进行;③非特异性siRNA组:转染非特异性慢病毒载体的siRNA,方法同HMGB1siRNA转染步骤。Western blotting检测以上各组细胞质中HMGB1蛋白表达水平:用2×SDS加样缓冲液裂解细胞,收集蛋白质,采用考马斯亮蓝法进行蛋白定量。经SDS-PAGE电泳分离、转膜、5%脱脂奶粉室温封闭后,加入兔抗大鼠HMGB1抗体、小鼠抗大鼠β-actin后4℃过夜,用TBST洗3次,再加入辣根过氧化物酶标记的山羊抗兔或山羊抗小鼠二抗,室温孵育2h,TBST洗3次,DAB显色,拍照,用Quantity One系统进行电泳条带光密度值分析。
1.3.3 氧糖剥夺/复氧模型的建立及实验分组 建立氧糖剥夺/复氧模型[9]:取第3代原代星形胶质细胞,PBS冲洗3次,换为不含血清的无糖DMEM培养基,置于三气孵箱(1%O2、5%CO2)中,在不同时长的氧糖剥夺后,再换回含血清的DMEM高糖培养基,置于20%O2、5%CO2的正常细胞培养条件下复氧培养至24h。将原代成熟纯化的星形胶质细胞分为对照组、模型组、HMGB1siRNA组、非特异性siRNA组。对照组:细胞未行氧糖剥夺/复氧及RNA干扰处理。模型组:细胞分别行2、4、6h的氧糖剥夺后复氧至24h。HMGB1siRNA组:氧糖剥夺前对星形胶质细胞行HMGB1siRNA转染,然后氧糖剥夺6h并复氧至24h。非特异性siRNA组:氧糖剥夺前对星形胶质细胞进行非特异性siRNA转染,然后氧糖剥夺6h后复氧至24h。
1.3.4 MTT检测细胞存活率 各组星形胶质细胞使用MTT试剂盒检测细胞存活率,具体操作步骤按说明书进行,最后在酶标仪上检测吸光度(A)值。
1.3.5 乳酸脱氢酶(LDH)漏出率检测 各组星形胶质细胞按LDH检测试剂盒说明书进行LDH活性测定,用乳酸脱氢酶-L试剂测试待测样品中的LDH漏出率。LDH漏出率=培养基LDH总活性/(细胞质LDH总活性+培养基LDH总活性)×100%。
1.3.6 RT-PCR检测HMGB1mRNA表达 按照Trizol试剂说明提取各组细胞的总RNA,反转录为cDNA后行PCR。HMGB1引物:上游5'-AATCTTTTGTCCACACACCCT-3',下游5'-TATCCGCTTTCCTTGTATCTG-3';β-actin引物:上游5'-CCCATCTATGAGGGTTACGC-3',下游5'-TTTAATGTCACGCACGATTTC-3'。产物长度分别为552、150bp。反应体系25μl,PCR扩增条件:94℃预变性5min;94℃变性30s、62℃退火45s、72℃延伸1min,循环35次;72℃延伸10min。PCR产物行2%琼脂糖凝胶电泳成像,采用Quantity One系统进行电泳条带光密度值分析,以HMGB1/β-actin积分光密度比值代表HMGB1mRNA表达水平。
1.3.7 ELISA检测细胞上清液中HMGB1蛋白的浓度按照ELISA试剂盒操作说明书步骤,每个样本取细胞培养上清液100μl,检测各组星形胶质细胞氧糖剥夺/复氧后培养上清中HMGB1蛋白的浓度。
1.4 统计学处理 采用SPSS 17.0软件进行统计分析,计量资料以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用Turkey多重比较法,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠原代星形胶质细胞的鉴定 取培养3代的大鼠原代星形胶质细胞,采用GFAP荧光染色鉴定,结果显示,星形胶质细胞纯度>95%(图1)。

图1 GFAP鉴定原代培养星形胶质细胞(×200)Fig. 1GFAP immunofluorescence staining of primarily cultured astrocytes (×200)
2.2 Western blotting检测RNA干扰效果 与对照组(6.51±0.46)相比,HMGB1siRNA组HMGB1蛋白表达量(2.17±0.51)明显降低(P<0.01),而非特异性siRNA组HMGB1蛋白表达量(6.00±0.79)g与对照组比较差异无统计学意义(P>0.05),提示HMGB1siRNA对星形胶质细胞的HMGB1蛋白表达具有明显抑制作用(图2)。
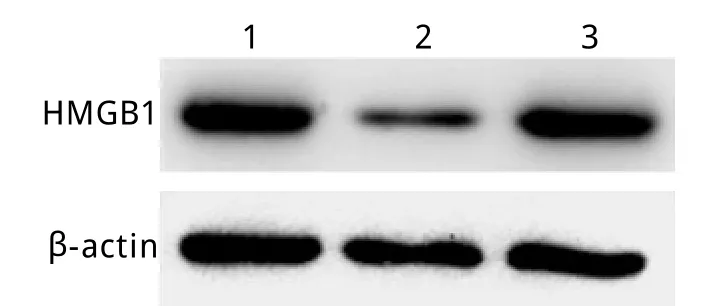
图2 Western blotting检测HMGB1蛋白表达Fig. 2Expression of HMGB1protein detected by Westernblotting
2.3 星形胶质细胞氧糖剥夺/复氧后HMGB1的表达变化
2.3.1 HMGB1mRNA的表达 RT-PCR法检测显示,对照组有少量HMGB1mRNA表达(0.07±0.01)。与对照组相比,模型组HMGB1mRNA在2h氧糖剥夺/复氧24h时表达明显增加(0.16±0.01,P<0.01),在4h氧糖剥夺/复氧24h时进一步增高(0.26±0.02,P<0.01),6h氧糖剥夺/复氧24h时达最高值(0.41±0.02,P<0.01)。与6h氧糖剥夺组比较,HMGB1siRNA组的HMGB1mRNA表达明显下降(0.20±0.01,P<0.01),而非特异性siRNA组HMGB1mRNA表达量差异无统计学意义(0.42±0.01,P>0.05,图3)。
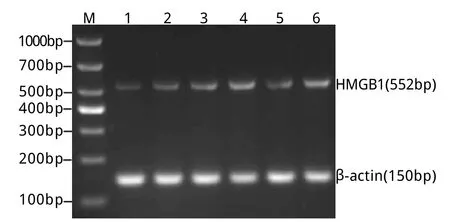
图3 氧糖剥夺/复氧后星形胶质细胞HMGB1mRNA的表达变化Fig.3Expression of HMGB1mRNA detected by RT-PCR
2.3.2 细胞上清液中HMGB1蛋白浓度 ELISA检测结果显示,正常组细胞上清液中有一定量HMGB1表达(472±53pg/ml)。与对照组相比,模型组细胞上清液中HMGB1蛋白浓度在2h氧糖剥夺/复氧24h时表达明显增加(538±85pg/ml,P<0.01),在4h氧糖剥夺/复氧24h时进一步增高(659±47pg/ml,P<0.01),在6h氧糖剥夺/复氧24h时达最高值(784±63pg/ml,P<0.01)。与氧糖剥夺6h组相比较,HMGB1siRNA组HMGB1浓度明显下降(588±65pg/ml,P<0.01),而非特异性siRNA组HMGB1浓度无明显差异(743±46pg/ml,P>0.05)。
2.4 星形胶质细胞氧糖剥夺/复氧后细胞损伤情况
2.4.1 星形胶质细胞氧糖剥夺/复氧后LDH漏出率的变化 与对照组(1.14±0.20)相比,不同时间点氧糖剥夺/复氧组LDH漏出率均明显增加(P<0.01),且随着缺氧时间延长逐渐升高。与氧糖剥夺6h组(63.63±4.30)相比,HMGB1siRNA组的LDH漏出率明显下降(43.80±3.43,P<0.01),而非特异性siRNA组LDH漏出率无明显差异(63.93±2.40,P>0.05,表1)。

表1 氧糖剥夺/复氧星形胶质细胞的细胞存活率和LDH漏出率比较(x±s,n=6)Tab. 1Effects of HMGB1siRNA on the survival rate and LDH activity of OGD/R astrocytes (x±s, n=6)
2.4.2 星形胶质细胞氧糖剥夺/复氧后细胞存活率的变化 MTT检测显示,与对照组(100.00±1.43)相比,不同时间点氧糖剥夺/复氧组细胞存活率均明显降低(P<0.01),且随缺氧时间延长逐渐下降。与氧糖剥夺6h组(35.00±1.92)相比,HMGB1siRNA组细胞存活率明显提高(75.00±2.13,P<0.01),而非特异性s i R N A组细胞存活率无明显变化(36.00±1.55,P>0.05)。
3 讨 论
缺血再灌注损伤激活炎症反应在脑缺血的发生发展中具有重要作用[10-12]。目前脑缺血再灌注损伤的临床治疗效果仍不十分理想,对其分子机制的研究尚待继续深入。HMGB1是一种核蛋白,其组成结构可分成两个同种异体的HMG 盒,即A 盒和B盒,其活性存在于B盒的前20个氨基酸序列中[13]。HMGB1主要有两种来源:①坏死细胞被动释放;②免疫细胞主动释放。目前研究表明,HMGB1作为重要的炎症介质,在脑缺血再灌注损伤中具有十分重要的作用。HMGB1主要与细胞表面的TLR-2、TLR-4以及RAGE结合,引起NF-κB的激活与释放,最终导致炎症反应及细胞死亡[14-15]。星形胶质细胞作为脑内数量最多的细胞,具有支持、营养、信号传导等重要作用。以往认为小胶质细胞是脑缺血后主要的炎症反应细胞[16],近年来发现激活的星形胶质细胞可以释放许多炎症介质导致炎症反应的发生,在脑缺血的病程中扮演着非常重要的角色[4-5]。
本研究观察到星形胶质细胞氧糖剥夺/复氧24h后细胞上清中的HMGB1蛋白浓度明显升高,随着氧糖剥夺时间的延长,MTT检测提示细胞存活率降低,LDH检测提示细胞LDH漏出率增加,均提示星形胶质细胞损伤逐渐加重,而HMGB1siRNA组的星形胶质细胞损伤明显减轻。细胞损伤情况与HMGB1表达量密切相关,RT-PCR和ELISA检测HMGB1表达结果一致,均提示RNA干扰HMGB1表达后细胞损伤程度明显减轻。Kim等[17]报道通过RNA干扰技术对SD大鼠进行HMGB1基因沉默,可以明显减少SD大鼠大脑中动脉闭塞(MCAO)后脑梗死体积;Liu等[18]报道MCAO大鼠脑室内注入HMGB1单克隆抗体后,血-脑脊液屏障通透性增高,MMP-9活性降低,梗死区体积减小,脑缺血后功能恢复情况改善;Kikuchi等[19]报道体外给予依达拉奉可以通过减少HMGB1的释放而减轻氧糖剥夺所致的神经细胞死亡;Kikuchi等[20]报道体外应用米诺环素可抑制HMGB1释放,进而减轻氧糖剥夺所致的PC12细胞凋亡。本研究应用星形胶质细胞的离体脑缺血再灌注损伤模型证实抑制HMGB1基因表达可显著减轻缺血再灌注导致的细胞损伤,与上述实验结果基本一致,进一步从离体实验证实了HMGB1表达在脑缺血再灌注损伤中的作用。
HMGB1作为重要的炎症产物,对下游的IL-1α/β、TNF-α表达具有一定调控激活作用[21],IL-1α/β、TNF-α等的表达上调与细胞损伤密切相关,即HMGB1可能扮演对下游炎症产物调节的开关作用。当然,炎症在脑缺血再灌注损伤中的作用取决于缺血的严重程度以及时期(早期或晚期),早期炎症可能以损害机体为主,但是晚期炎症可能对机体的修复有积极作用[22]。Hayakawaa等[8]报道脑缺血后期星形胶质细胞产生的HMGB1可趋化内皮祖细胞向缺血区域组织聚集,进而促进神经血管单元的重塑,从而对机体缺血后的功能恢复产生有益作用。因此,应将研究重点放在如何选择炎症干预的时间窗以及进一步阐明机体炎症反应的具体机制上,从而最大程度的将炎症的损害作用转化为保护作用。本实验对HMGB1在原代星形胶质细胞缺血再灌注损伤模型中的作用进行了探讨,而HMGB1以及星形胶质细胞在体内所扮演的角色将在后续的实验中进一步研究和探讨。
本研究结果表明,星形胶质细胞氧糖剥夺/复氧后可导致细胞损伤,HMGB1表达量明显升高且与细胞损伤程度密切相关;通过RNA干扰技术抑制星形胶质细胞HMGB1的表达可显著减轻氧糖剥夺/复氧导致的细胞损伤。星形胶质细胞可以释放HMGB1参与脑缺血再灌注损伤的过程,HMGB1的过度激活是导致脑缺血再灌注损伤的重要分子机制。本研究为脑缺血再灌注的临床治疗提供了一个重要的治疗靶点和一种新思路。
[1]Schulze J, Zierath D, Tanzi P, et al. Severe stroke induces longlasting alterations of high-mobility group box 1[J]. Stroke, 2013,44(1): 246-248.
[2]Huang LF, Yao FH, Dong N, et al. Effects of high mobility group box-1(HMGB1) protein on phenotype of regulatory T cells and functional polarization of T cells in burned rats[J]. Med J Chin PLA, 2011, 36(1): 17-20. [黄立锋, 姚凤华, 董宁, 等. 高迁移率族蛋白B1对烫伤大鼠调节性T细胞表型及T细胞功能极化的影响[J]. 解放军医学杂志, 2011, 36(1): 17-20.]
[3]Asavarut P, Zhao H, Gu J, et al. The role of HMGB1in inflammation-mediated organ injury[J]. Acta Anaesthesiol Taiwan, 2013, 51(1): 28-33.
[4]Wu X, Liu Y, Chen X, et al. Involvement of TREK-1activity in astrocyte function and neuroprotection under simulated ischemia conditions[J]. J Mol Neurosci, 2013, 49(3): 499-506.
[5]Yamagata K. Pathological alterations of astrocytes in stroke-prone spontaneously hypertensive rats under ischemicconditions[J].Neurochem Int, 2012, 60(1): 91-98.
[6]Wang JP, Qu WS, Zhang Q, et al. Effects of ischemia and anoxia on astrocytic BDNF production in vitro[J]. J Zhengzhou Univ(Med Sci), 2008, 43(3): 480-482.[王建平, 渠文生, 张强, 等.王伟缺血缺氧对星形胶质细胞合成和分泌BDNF的影响[J].郑州大学学报(医学版), 2008, 43(3): 480-482.]
[7]Skaper SD, Argentini C, Barbierato M. Culture of neonatal rodent microglia, astrocytes, and oligodendrocytes from cortex and spinal cord[J]. Methods Mol Biol, 2012, 846: 67-77.
[8]Hayakawaa K, Phama LD, Katusicb ZS, et al. Astrocytic highmobility group box 1promotes endothelial progenitor cellmediated neurovascular remodeling during stroke recovery[J].Proc Natl Acad Sci USA, 2012, 109(19): 7505-7510.
[9]Panickar KS, Polansky MM, Anderson RA. Cinnamon polyphenols attenuate cell swelling and mitochondrial dysfunction following oxygenglucose deprivation in glial cells[J]. Exp Neurol, 2009, 216(2): 420-427.
[10]Raza SS, Khan MM, Ahmad A, et al. Neuroprotective effect of naringenin is mediated through suppression of NF-κB signaling pathway in experimental stroke[J]. Neuroscience, 2013, 230:157-171.
[11]Ito M, Kondo T, Shichita T, et al. Post-ischemic innate immunity and its application for novel therapeutic strategy targeting brain inflammation[J]. Nihon Rinsho, 2013, 71(7): 1291-1301.
[12]Cheng HY, Teng JF, Guo LL. Effect of rhG-CSF on Egr-1and Survivin expressions and vascular regeneration of rats with acute cerebral ischemia reperfusion injury[J]. J Zhengzhou Univ (Med Sci), 2013, 48(2): 200-204. [程鹤云, 滕军放, 郭利利. 重组人粒细胞集落刺激因子对急性缺血再灌注脑损伤大鼠脑组织Egr-1、Survivin蛋白表达及血管再生的影响[J]. 郑州大学学报(医学版), 2013, 48(2): 200-204.]
[13]Stros M, Ozaki T, Bacikova A, et al. HMGB1and HMGB2cellspecifically down-regulate the p53-and p73-dependent sequencespecific tran-sactivation from the human bax gene promoter[J].J Biol Chem, 2002, 277(9): 7157-7164.
[14]Wang L, Zhang X, Liu L, et al. Atorvastatin protects rat brains against permanent focal ischemia and downregulates HMGB1, HMGB1recep-tors(RAGE and TLR4), NF-kappaB expression[J]. Neurosci Lett, 2010, 471(3): 152-156.
[15]Xu CL, Yao YM, Yu Y, et al. Effects of NF-κB inhibitor pyrrolidine dithiocarbamate (PDTC) on mRNA expression of high mobility group box-1protein in organs of rats with endotoxic shock[J]. Med J Chin PLA, 2004, 29(1): 45-47.[胥彩林, 姚咏明, 于燕, 等. NF-κB抑制剂对内毒素休克大鼠高迁移率族蛋白B1表达的影响[J]. 解放军医学杂志, 2004,29(1): 45-47.]
[16]Lai AY, Todd KG. Microgliain cerebral ischemia: molecular actions and interactions[J]. J Can J Physiol Pharmacol, 2006,84(1): 49-59.
[17]Kim ID, Shin JH, Kim SW, et al. Intranasal delivery of HMGB1siRNA confers target gene knockdown and robust neuroprotection in the postischemic Brain[J]. Mol Ther, 2012,20(4): 4829-4839.
[18]Liu K, Mori S, Takahashi HK, et al. Anti-high mobility group box 1monoclonal antibody ameliorates brain infarction induced by transient ischemia in rats[J]. FASEB J, 2007, 21(14): 3904-3916.
[19]Kikuchi K, Kawahara K, Tancharoen S, et al. The free radical scavenger edaravone rescues rats from cerebral infarction by attenuating the release of high-mobility group box-1in neuronal cells[J]. J Pharmacol Exp Ther, 2009, 329(3): 865-874.
[20]Kikuchi K, Kawahara K, Biswas KK, et al. Minocycline attenuates both OGD-induced HMGB1release and HMGB1-induced cell death in ischemic neuronal injury in PC12cells[J]. Biochem Biophys Res Commun, 2009, 385(2): 132-136.
[21]Naglova H, Bucova M. HMGB1and its physiological and pathological roles[J]. Bratisl Lek Listy, 2012, 113(3): 163-171.
[22]Jin R, Liu L, Zhang S, et al. Role of inflammation and its mediators in acute ischemic stroke[J]. J Cardiovasc Transl Res,2013, 6(5): 834-851.

