癌细胞/组织靶向多肽研究进展
□郭永娥,侯颖春
(陕西师范大学 肿瘤分子细胞生物学实验室,陕西 西安 10119)
癌细胞/组织靶向多肽研究进展
□郭永娥,侯颖春
(陕西师范大学 肿瘤分子细胞生物学实验室,陕西 西安 10119)
恶性肿瘤是严重威胁人类健康生活的高发性疾病,由于缺乏早期诊断的方法以及放/化疗的巨大毒性,恶性肿瘤仍然是对人类生命健康的最大威胁之一. 未来恶性肿瘤诊治取得突破的关键在于早期诊断和靶向治疗,而特异、敏感的肿瘤标志物对此意义十分重大. 近年来,肿瘤标志物的研究探索取得了一定进展,尤其是肿瘤靶向多肽类标志物的研究进展较大. 本文对近年来恶性肿瘤靶向多肽的筛选、鉴定、应用及未来的发展方向等进行了简要综述,以供从事相关研究的人员参考.
肿瘤靶向多肽;肿瘤标志物;肿瘤早期诊断;肿瘤靶向治疗
癌症是严重威胁人类生命健康的高发性疾病.目前,由于缺乏理想的早期诊断的方法以致大多数病人丧失手术时机,而当前的放/化疗方法仍对患者存在巨大毒性.所以,癌症仍然是当前人类的头号杀手之一,人类对癌症的诊治水平亟需提高.经过多年来的艰辛探索,全世界科学家对未来恶性肿瘤诊治取得突破的关键逐渐趋于一个共识,那就是努力研发癌症早期诊断和靶向治疗的有效方法,而特异、敏感的肿瘤标志物的筛选对此意义十分重大[1-4],其中包括某些与肿瘤发生、发展、转移等关系密切的基因产物的大量研究报导[5-10].但是肿瘤靶向多肽分子片段标志物的研究近年倍受重视,被认为是实现癌症早期诊断和靶向治疗的希望所在[11,12].
以特异性好、敏感性强的肿瘤靶向多肽进行的分子影像学检测对于早期检测肿瘤病灶、提高肿瘤早期诊断率进而提高手术率以及癌症疗效考核等具有重要价值;以这种多肽结合其他纳米载体或药物进行的癌症靶向治疗有望大大提高癌症化疗的效果并明显降低其毒副作用[13,14].近年来上述探索研究工作进展较大,特别是通过本领域广泛使用的噬菌体肽库技术(phage displayed peptide library)筛选肿瘤细胞或组织表面特异性结合的多肽的研究取得了较大进展,本文对这些进展及未来的发展方向等进行简要综述,以供从事相关研究的人员参考.
1 噬菌体肽库筛选技术简介
噬菌体肽库技术是上世纪80年代发展起来的筛选多肽或者配体(含抗原/抗体)的技术.该技术把随机合成的多肽或配体基因序列插入丝状噬菌体基因组并使之与其壳蛋白融合表达呈现于噬菌体表面,从而在各种筛选体系中与细胞或组织表面各种分子表位进行模拟性互作用实现结合,利用消减筛选(通常被称为bio-panning)的程序实现特异、敏感的噬菌体克隆的筛选而获得细胞或组织特异性结合的多肽.Bio-panning技术包括体内、体外筛选,基本原理示意如图1.

图1:噬菌体肽库亲和筛选A.原理示意;B.方法示意;B.体内筛选示意Fig. 1: Bio-panning using phage displayed peptide library A. Mechanism; B. Protocols; C. Bio-panning in vivo
2 常见肿瘤的靶向多肽研究进展
2.1 胃癌
胃癌是常见的消化道恶性肿瘤疾病,全球每年新发胃癌100余万,中国占42%;全球每年死亡约70万,中国占35%[15];在消化系统恶性肿瘤死亡病例中,约半数死于胃癌.
由于胃癌的发生过程是一个慢性的、渐进的、长期积累的过程,多由慢性萎缩性胃炎、溃疡等转化而来,所以胃癌的早期诊断比较困难.目前临床广泛采用的内窥镜加活检的方法存在“摸着石头过河”以及操作者经验不同等等问题,内窥镜技术的发展已经达到一定水准,然而仍然缺乏对早期微小病灶做到不遗漏的准确定位需要的靶向分子元件,胃癌的早期诊断仍面临很大困难,使许多病人丧失早期手术时机,而且术后或者单纯的非靶向化疗的毒性及抗药性影响都极其强大.所以,寻找胃癌特异性结合的靶向分子,结合新型胃内窥镜技术而建立胃癌早期诊断、疗效考核、进而进行术后或者单纯靶向化疗,对于提高胃癌临床诊治水平极其重要,而发现胃癌特异性靶向的分子元件是这一目标实现的关键.
近几年,应用体内或体外噬菌体展示技术筛选出的能与胃癌组织或细胞特异性结合的短肽分子如AADNAKTKSFPV[16]、CTKNSYLMC[17]、ETAPLSTMLSPY[18]、SWKLPPS[19]等,这些短肽分子都显示了较好的胃癌细胞或组织的靶向特异性,由于它们分子小,所以表现出了组织穿透力较强,异源性免疫刺激性小等优势,而且有些还具有抑制癌细胞增殖的功能.
我们实验室以自己独特的体外Bio-panning流程从NEB(New England Biolabs)的PhD 12肽库成功地筛选出了特异性靶向人胃癌细胞SGC-7901和人胃癌组织的若干阳性噬菌体多肽克隆,这些克隆的多肽序列组成了4个共有序列(Consensus sequences),而且这些序列具有一定的基序(Motif sequence)特性.一系列的细胞和组织水平的实验结果显示选定的特异性多肽对人胃癌细胞和临床常见的胃癌病理类型癌组织有很好的结合特异性和敏感性,具有用于胃癌早期诊断和靶向治疗的诱人前景[20],部分已发表结果如图2所示.
2.2 肝癌
肝癌(Hepatocellular carcinoma, HCC)是发病率较高的恶性肿瘤之一,其进展迅速,死亡率高.我国是病毒性肝炎大国,由此而引发的HCC病例众多.HCC早期诊断也面临重大瓶颈问题,虽然甲胎蛋白(AFP)被作为HCC的重要特异性表达蛋白而广泛用于HCC的早期诊断参考,但由于AFP尚不能百分之百地对HCC进行确诊,而且AFP是分泌性蛋白,所以难以用AFP进行HCC的分子影像学诊断以及靶向治疗,加之HCC手术过程中对病灶切缘的判定非常重要,这点也难以用AFP做到.所以,寻找HCC细胞组织特异性结合的分子元件也是HCC早期诊断和靶向治疗的关键.

图2:本实验室筛选的人胃癌多肽探针的细胞、组织的特异性和敏感性分析左:胃癌组织芯片的特异性分析结果;右:对培养的胃癌细胞(a)和其他细胞的特异性分析结果Fig. 2: Assay for the specificity and sensitivity of gastric cancer peptide probe to cells and tissues Left: to gastric cancer tissue trips; Right: to cultured gastric cancer cells (a) and other cells
有人用HCC细胞BEL-7402作为靶细胞,从噬菌体肽库筛选出特异性短肽分子TACHQHVRMVRP,实验证明该肽段与BEL-7402、BEL-7404、SMMC-7721、HEPG2等HCC细胞株显示较高的亲和性,而与正常细胞没有特异性结合[21].他们进一步利用HEPG2为靶细胞,筛选出短肽分子FQHPSFI和AGKGTPSLETTP,后者以阿霉素标记可对肿瘤细胞的增殖起到抑制作用[22].以乙型肝炎或丙型肝炎后早期HCC病人血清为靶标,从噬菌体肽库筛出的多肽RGWCRPLPKGEG可以特异性的与HCC 病人血清反应[23],这显然对于HCC 临床早期诊断具有重要意义.以HepG2细胞为靶细胞从噬菌体12肽库筛出的多肽SLSLITMLKISR被偶联至蜂毒肽(Melittin)后发现对HepG2细胞具有明显的体外杀伤作用[24].
本实验室以人HCC细胞株HEPG2为靶细胞,以PhD 12肽库筛选得到一系列阳性肽序克隆和Consensus sequences,以细胞免疫荧光和临床标本分析了它们的特异性和敏感性,筛选到了最佳肽序列,合成了FITC标记的人HCC多肽探针Hepa probe.一系列细胞、组织水平的实验结果证明该探针对HCC细胞、组织具有良好的结合特异性,对于HCC的早期诊断和靶向治疗都有重要意义,具有很好的临床应用和开发价值[25,26].部分已发表结果如图3所示.

图3:本实验室筛选的人肝癌多肽探针的细胞、组织的特异性和敏感性分析左:对人肝癌组织芯片的特异性分析结果;右:对培养的肝癌细胞(A、B)和其他细胞的特异性分析结果Fig. 3: Assay for the specificity and sensitivity of HCC peptide probe to cells and tissues Left: to HCC tissue trips; Right: to cultured HCC cells (A, B) and other cells
2.3 结直肠癌
结直肠癌也是常见的消化道恶性肿瘤之一,目前临床诊治也存在早期诊断不足和化疗毒性巨大等问题[27],所以结直肠癌的未来临床也亟需早期分子影像学诊断和靶向治疗,利用噬菌体肽库技术筛选能与结直肠癌组织细胞特异性结合的肽段分子对结直肠癌临床的需要具有重要意义.目前,已经筛选出多种能与结直肠癌细胞结合的短肽分子,如与结直肠癌细胞SW480和H29有较强亲和力的短肽分子CP15(VHLGYAT)、与结直肠癌组织特异性结合的短肽分子TCP-1(CTPSPFSHC)[28],利用结直肠癌裸鼠模型对这些多肽的FITC标记的探针的研究结果发现肿瘤组织处有较强的荧光信号,而正常组织荧光较弱.VPAC1受体高表达于结直肠癌细胞,利用噬菌体肽库技术筛选出的短肽分子VP2(GFRFGALHEYNS)能特异性地与结直肠癌细胞结合[29],有望成为结直肠癌早期诊断和治疗的有效导向分子.
本实验室以人结直肠癌细胞株Caco2为靶细胞,以PhD 12肽库筛选得到一系列阳性肽序克隆和Consensus sequences,以细胞免疫荧光和临床标本分析了它们的特异性和敏感性,筛选到最佳肽序列,合成了FITC标记的人结直肠癌多肽探针Caco probe.一系列细胞和组织水平的实验结果证明该探针对结直肠癌细胞、组织具有良好的结合特异性,对于结直肠癌的早期诊断和靶向治疗都有重要意义,具有很好的临床应用和开发价值[30].部分已发表结果如图4所示.
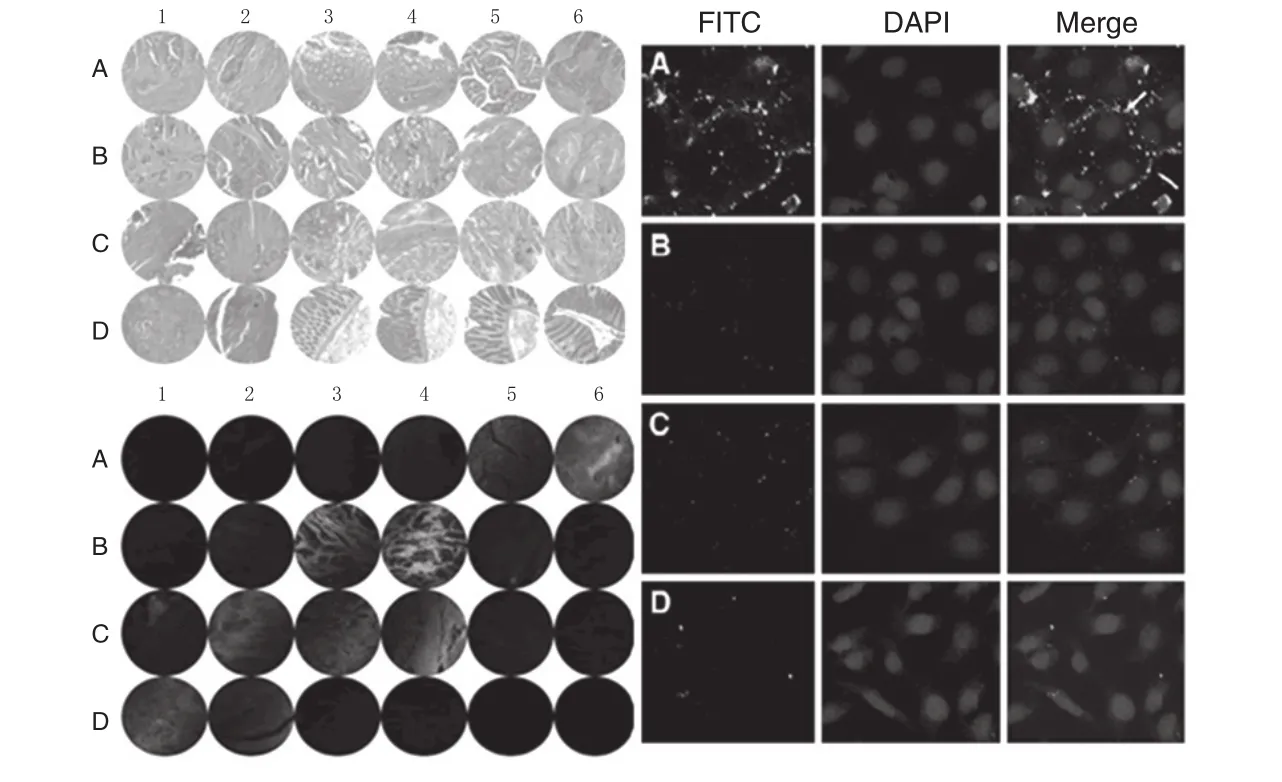
图4:本实验室筛选的人结直肠癌多肽探针的细胞、组织特异性和敏感性分析左:人结直肠癌组织芯片的特异性分析结果;右:对培养的结直肠癌细胞(A)和其他细胞的特异性分析结果Fig. 2: Assay for the specificity and sensitivity of colorectal carcinoma peptide probe to cells and tissues Left: to colorectal carcinoma tissue trips; Right: to cultured colorectal carcinoma cells (A) and other cells
2.4 食道癌
食道癌在我国河南等地高发,位居肿瘤致死的第四位.食道癌的发生也是一个逐渐积累的过程,其早期损害(dysplasia in Barrett's esophagus)是食道癌发生的基础.美国密西根大学Thomas Wang的实验室在这方面做了深入研究,他们以噬菌体肽库筛选出了靶向大鼠食管癌细胞OE-33的多肽分子SNFYMPL,并以该校研制的微型纤维内窥镜在大鼠Barrett模型做了食道癌早期检测研究,结果显示该多肽分子可以满足食道癌早期诊断的要求[31].
本实验室以人食道癌细胞ECA-109和TE-1从PhD 12肽库筛选得到了若干阳性肽序克隆和Consensus sequences,以细胞免疫荧光实验筛选到了最佳克隆,初步研究结果显示该克隆肽序具有对食道癌细胞非常特异、敏感的结合特性.目前正在对其合成的FITC标记探针做深入研究.
2.5 乳腺癌
乳腺癌占女性新发恶性肿瘤的30%,严重危害妇女健康,其发病率在我国呈逐渐上升趋势[32,33].目前,对乳腺癌的早期诊断方法主要有影像检查、肿瘤标志物检测以及穿刺活检等,但这些方法漏检率高,也可能引起癌细胞扩散或产生创伤等问题.目前已有的一些肿瘤标志物大部分是乳腺癌血清肿瘤标志物,特异性和灵敏度较低,对早期乳腺癌检出的特异性和敏感性不强.所以,筛选乳腺肿瘤靶向分子也是当前研究的热点.
酸性成纤维细胞生长因子(aFGF),即FGFI,是一种多功能强力细胞因子,对促进成纤维细胞的代谢和胶原蛋白的形成发挥着重要功能[34].从噬菌体肽库筛到的可与aFGF特异结合的多肽被发现对乳腺癌细胞的生长具有抑制作用.有人利用噬菌体肽库技术筛选出了乳腺癌细胞CD59表面特异性结合的包含22个氨基酸的短肽分子SP22,该多肽可以通过降低Bcl-2的表达、激活Fas和Caspase-3而促进乳腺癌细胞的凋亡[35].也有人从噬菌体肽库筛选到与乳腺癌细胞表面高表达的蛋白CD133特异性结合的短肽分子LS-7(LQNAPRS),并证明该短肽分子可通过降低c-Met和STAT3的表达而抑制乳腺癌细胞的转移和增殖能力[36].还有报导以肽库技术获得了与乳腺癌细胞表面高表达蛋白CD44特异性结合的短肽分子[37].上述这些短肽分子的获得对乳腺癌的早期诊断和靶向治疗均有重要实际价值.
本实验室以人乳腺癌细胞MCF-7从PhD 12肽库筛选得到了若干阳性肽序克隆和4个Consensus sequences,以细胞免疫荧光实验筛选到了最佳克隆,以各种培养的癌细胞做的初步研究结果显示该克隆肽序具有对人乳腺癌细胞非常特异、敏感的结合特性.目前正在对其合成的FITC标记探针做深入研究.
2.6 肺癌
肺癌居世界癌症死因的首位,约占全部恶性肿瘤的19%,全世界每年的新增病例超过120万[38].由于肺癌早期症状不明显,预后差,存活率仅为13%,因此肺癌临床也存在早期诊断困难、化疗药物靶向性不强且毒性大等问题.所以,积极寻找肺癌特异性靶向分子是建立肺癌早期诊断和靶向治疗新方法而改变肺癌临床困难现状的最有效手段.
Oyama等利用3种肺癌细胞系NCI-H1299、NCI-H2009和A549从噬菌体肽库筛选出了与肺癌特异性结合的二十肽和混合肽[39,40].有人利用肺癌细胞NCI-H1299为靶细胞获得了与之特异性结合的短肽分子ZS-1(EHMALTYPFRPP)和ZT-1(QQMHLMSYAPGP)[41,42];也有人利用肺癌细胞H460为靶细胞筛选出另一短肽分子CSNIDARAC,并以该多肽偶联载阿霉素的脂质体做了靶向治疗研究,证明该短肽分子的靶向性在靶向治疗中具有重要作用[43].
2.7 前列腺癌
前列腺癌是男性最常见的恶性肿瘤,近年来在亚洲逐渐呈上升趋势[44].目前,前列腺癌特异性抗原(PSA)作为临床上主要的前列腺癌特异性标志物,对前列腺癌的诊断特异性达90%,被认为是最有价值的前列腺癌标志物,被广泛应用于前列腺癌的筛选、诊断及疗效检测.Mattsson等人以高表达PSA的前列腺癌细胞为靶细胞,从噬菌体肽库筛选出了能与PSA特异性结合的短肽分子,该短肽分子对前列腺肿瘤细胞的增殖和迁移有明显抑制作用[45].此外,成纤维细胞生长因子FGF8b也是前列腺癌细胞表面高表达分子,被认为可作为前列腺癌临床治疗的靶向分子[46-48],有人筛选出了能与FGF8b特异性结合的短肽分子P12(HSQAAVP),P12对高表达FGF8b的肿瘤细胞的增殖有明显的抑制作用,机理可能是P12通过与FGF8b的结合而抑制了FGF8b与其受体的结合,通过抑制细胞周期素D1(Cyclin D1)和增殖细胞核抗原(PCNA)的表达,延迟细胞G1期而抑制前列腺癌细胞增殖[49].
3 靶向多肽在癌细胞的靶点问题
研究细胞、组织靶向多肽在细胞或组织表面的靶点的性质对于揭示靶向多肽对细胞的某些重要行为如增殖、凋亡、运动等的影响机理极其重要,对于未来的靶向治疗研究和应用也具有重要的指导意义.
目前,有的靶向多肽研究以某已知的在某癌细胞表面高表达的分子直接为靶标进行肽库的Biopanning,但大多数靶向多肽研究还是以癌细胞为靶细胞进行肽库的Bio-panning.对于后者,进一步揭示多肽在癌细胞表面的靶分子性质是需要进一步研究的重要任务.
以噬菌体肽库技术对多肽的筛选的基本原理是噬菌体表面呈现的融合表达的肽段与细胞表面表位(Epitope)之间的模拟亲和,所以,这种模拟可以是线性分子间的模拟,也可以是与细胞表面一个区域,即类似信号补丁(Signal patch)这样一个表面区域间的空间构型模拟.肽段的靶分子预测可以用众多的计算机软件在蛋白资料库中筛查,也可以用蛋白组学结合亲和层析的方法筛选.
对于靶向肽段和已经知道的靶点蛋白可以用计算机软件进行分子对接模拟(Docking),这种模拟清晰地显示多肽与靶分子间的空间构型对接.本实验室对自己筛选的人肝癌靶向多肽与酪蛋白激酶II(CK2)分子的Docking模拟部分结果如图5.

图5:本实验室筛选的人肝癌多肽与CK2蛋白分子的Docking模拟Fig. 5: The docking between the HCC targeting peptide we selected and CK2 molecule
4 肿瘤靶向多肽的应用
4.1 应用于肿瘤的早期诊断、筛查、疗效考核、病程评估等分子影像学检查
肿瘤特异性多肽分子由于具有分子小、组织穿透力强等特点而适合用于肿瘤的分子影像学,只要获得某肿瘤特异、敏感的多肽序列,就可以合成以荧光、同位素等标记的探针而用于肿瘤的分子影像学.如与结直肠癌细胞HT29特异性结合的多肽用同位素标记后的体内显像发现可清晰显示肿瘤灶,对小鼠的原位、移植瘤模型的结直肠镜检获得了理想的荧光显像[50].有人以乳腺癌细胞特异性结合的肽分子SP90清楚地显示了小鼠体内肿瘤及其分布[51].
我们实验室筛选出的结直肠癌[30]、胃癌[20]、肝癌[25,26]等FITC标记的特异性多肽探针经细胞水平和临床组织水平的多种检测方法鉴定,显示这些多肽探针与肿瘤细胞和临床组织具有良好的特异性结合,可以清晰地显示癌细胞和组织.
4.2 应用于肿瘤的疫苗研制、靶向药物治疗、术后靶向辅助治疗
肿瘤特异性肽序列可以经重复连接,与佐剂(Adjuvant)序列、协同因子序列等进行共表达而进行肿瘤相关疫苗的研制.
靶向多肽在肿瘤治疗方面最重要的作用就是作为瘤细胞和组织导向元件,最大限度地减少治疗药物的非靶向扩散和作用而大大提高疗效并降低毒副作用,多肽在这里类似于生物导弹(Bio-missile)的制导元件.目前,以包含某药物或治疗剂的纳米泡偶联,配合体外物理能量如超声、光、磁等激发纳米泡而靶向释放药物和治疗剂,从而造成瘤灶局部高药物浓度而大大提高疗效、降低毒副作用的治疗效果(如图6所示).例如有人将结直肠癌细胞特异性结合的多肽与线粒体毒素偶联,获得了理想的结直肠癌靶向治疗效果[50].有报导以乳腺癌细胞特异靶向短肽与纳米药物偶联后,在小鼠体内证实这种偶联纳米颗粒对肿瘤组织更具特异性杀伤力[51].

图6:多肽与生物纳米泡材料构成癌靶向治疗(举例示意)聚焦超声的“气穴现象”引爆药物载体,使微血管壁通透性增加,使药物在靶区释放Fig. 6: The targeting therapy by the peptide conjugated microbubbles (illustration) Focused ultrasound can cause the burst of peptide conjugated microbubbles and enhance the permeability of vessel’s wall, then release the drugs into targeted area
我们实验室筛选出了结直肠癌[30]、胃癌[20]、肝癌[25,26]等癌细胞/组织特异结合的多肽,初步的细胞、临床组织实验结果显示这些多肽对这些癌症的靶向治疗具有重要价值,我们后续的研究将充分重视它们用于癌症靶向治疗的研究,以期早日研发这些靶向多肽导向的癌症靶向治疗新方法.
5 需要解决的问题
近年来,肿瘤靶向多肽的研究倍受重视,许多新的肿瘤多肽被报道.但是,从目前的研发情况来看,还存在一些问题有待于进一步解决.
5.1 特异性和敏感性问题
特异性和敏感性永远是这类研究的永恒主题,它们总是互相消长的!所以,这里从剂量和时间来讲有个“度”的掌握问题.目前,有些被报导的多肽就像大多被应用的肿瘤标志物一样,对来自于不同组织类型的肿瘤不能做到百分之百的特异.当然,多数情况下,这并不一定严重影响它们的应用,因为一般来说,一个个体不可能同时患有多个组织类型的肿瘤.还有,一般来讲,多肽只对同一种肿瘤的不同临床病理分型中的部分类型具有很好的结合特异性和敏感性[20,25,26,30],而且也可能只对部分病人具有理想的诊疗效果.这些都需要在今后的研发工作中制定相应的对策加以对应.
5.2 相应的物理设备的配套
这里主要涉及的是分子影像学诊断的物理设备和靶向治疗研究的体外物理激发能量设备的研发问题.机体几乎所有器官组织都可以发生肿瘤,不同的解剖部位和生理情况复杂,如胃肠道、肝、肺、乳腺、生殖道、脑和神经组织以及血液肿瘤等等,所以对各种肿瘤的分子影像学诊断的物理设备的要求不尽相同,在靶向治疗的体外物理激发能量设备方面同样面临这些问题.尽管目前这些方面已经有了较大进展[13,14,52-54],但总体上还是没有做到针对各种肿瘤特殊的解剖、生理特性相适宜设备的研发.
5.3 噬菌体肽库筛选中的问题
噬菌体肽库技术因其具有筛选简单、容量大、高效率等特性越来越受到重视,其对肿瘤靶向多肽的筛选也得到了广泛的认可.但是,Bio-panning过程中尚有以下问题需注意:(1)宿主菌对噬菌体库可能会存在自主选择性,降低了噬菌体库的多样性.所以一个噬菌体肽库不能被多次地扩增来用于Bio-panning以节约成本;(2)吸附淘洗等过程对时间和洗涤强度的掌握要恰当,以噬菌体input量和output量作为衡量的重要指标;(3)不同来源肿瘤细胞表面靶点可能存在很大差异,所以,针对某一癌细胞或组织筛选出的多肽往往不一定适用于所有该肿瘤的患者.
5.4 与纳米材料和药物研发相结合的问题
目前,许多肿瘤靶向多肽的研究在生物医学特别是肿瘤细胞生物学实验室进行,大多这样的研究在对多肽的特异性和敏感性鉴定完毕之后即难于再进一步深入下去.正如上文所述,一种肿瘤靶向多肽的最重要的应用价值在于作为制导元件而用于纳米药物等偶联物的靶向治疗,但后者的研究大多集中于化学材料、药物等实验室.所以,如何把靶向多肽研究和纳米材料、纳米药物的研发有机的结合起来,是当前癌症靶向诊疗研究领域亟待解决的最重大问题,需要真正做到以特异、敏感和实用为基本要求,向真正体现其临床应用价值的方向探索和发展. ■
[1]Jen-Eing Jeng, Meng-Feng Tsai, Hey-Ru Tsai, Lea-Yea Chuang, Zu-Yau Lin, Min-Yuh Hsieh, Shinn-Chern Chen, Wan-Lung Chuang, Liang-Yen Wang, Min-Lung Yu, Chia-Yen Dai, Jung-Fa Tsai. Urinary transforming growth factor α and serum α-fetoprotein as tumor markers of hepatocellular carcinoma. Tumour Biology, 2013.[Epub ahead of print].
[2]Todd M. Bauer, Bassel F. El-Rayes, Xiaobai Li, Nazik Hammad , Philip A. Philip, Anthony F. Shields, Mark M. Zalupski, Tanios Bekaii-Saab. Carbohydrate antigen 19-9 is a prognostic and predictive biomarker in patients with advanced pancreatic cancer who receive gemcitabinecontaining chemotherapy. Cancer, 2013, 119(2): 285-292.
[3]Olalla Otero-Estévez, Mónica Martínez-Fernández, Lorena Vázquez-Iglesias, María Páez de la Cadena, Francisco J. Rodríguez-Berrocal, and Vicenta S. Martínez-Zorzano. Decreased Expression of Alpha-LFucosidase Gene FUCA1 in Human Colorectal Tumors. International Journal of Molecular science, 2013, 14(8): 16986-16998.
[4]Shenfei Zong, Zhuyuan Wang, Hui Chen, Guohua Hu, Min Liu, Peng Chen, and Yiping Cui. Colorimetry and SERS dual-mode detection of telomerase activity: combining rapid screening with high sensitivity. Nanoscle, 2014, 6(3): 1808-1816.
[5]Mian C, Perrino M, Colombo C, Cavedon E, Pennelli G, Ferrero S, De Leo S, Sarais C, Cacciatore C, Manfredi GI, Verga U, Iacobone M, De Pasquale L, Pelizzo MR, Vicentini L, Persani L, Fugazzola L. Refining calcium test for the diagnosis of medullary thyroid cancer:cut-offs, procedures and safety. Journal of Clinical Endocrinology & Metabolism, 2014, [Epub ahead of print].
[6]Cale D. Fahrenholtz, Ferenc G. Rick, Maria I. Garcia, Marta Zarandi, Ren-Zhi Cai, Norman L. Block, Andrew V. Schally, and Kerry L. Burnstein. Preclinical efficacy of growth hormone-releasing hormone antagonists for androgen-dependent and castration-resistant human prostate cancer. Proceedings of the National Academy of Science of the USA, 2014,111 (3):1084-1089.
[7]Weg M. Ongkeko, Doug Burton, Alan Kiang, Eric Abhold, Selena Z. Kuo, Elham Rahimy, Meng Yang, Robert M. Hoffman, Jessica Wang-Rodriguez, and Leonard J. Deftos. Parathyroid Hormone Related-Protein Promotes Epithelial-to-Mesenchymal Transition in Prostate Cancer. PloS One, 2014, 9 (1): e85803.
[8]Hou Y, Yang L, Mou M, Hou Y, Zhang A, Pan N, Qiang R, Wei L, and Zhang N. Annexin A2 regulates the levels of plasminogen, S100A10 and fascin in L5178Y cells. CancerInvest. 2008, 26:809-815.
[9]Xing R, He H, He Y, Feng Y, Zhang C, Wu H, Sun M, Yu X, Liu Y, Song X, Wang X, Chen Y, and Hou Y. ANXA2 remodels the microstructures of caco2 cells. Cell Mol Biol (Noisy-le-grand). 2013, 59 Suppl: OL1848-1854.
[10]Sun M, Xing R, Gao X, Yu X, He H, Gao N, Shi H, Hu Y, Wang Q, Xu J, and Hou Y. ANXA2 Regulates the Behaviors of SGC-7901 Cells. Asian Pac J Cancer Prev, 2013, 14 (10):1-6.
[11]Bethany Powell Gray, Shunzi Li, and Kathlynn C. From Phage Display to Nanoparticle Delivery: Functionalizing Liposomes with Multivalent Peptides Improves Targeting to a Cancer Biomarker. Brown.Bioconjug Chem, 2013, 24(1): 85-96.
[12]Susan L. Deutscher. Phage display in molecular imaging and diagnosis of cancer. Chem Rev, 2010, 110(5): 3196-3211.
[13]Goetz M, Wang TD. Molecular imaging in gastrointestinal endoscopy. Gastroenterology. 2010, 138(3):828-833.
[14]Wang TD. Targeted imaging of flat and depressed colonic neoplasms. Gastrointest Endosc Clin N Am. 2010, 20(3):579-583.
[15]Noriyuki Akita, Fukuto Maruta, Leonard W. Seymour, David J. Kerr, Alan L. Parker, Tomohiro Asai, Naoto Oku, Jun Nakayama, Shinichi Miyagawa. Identification of oligopeptides binding to peritoneal tumors of gastric cancer. Cancer Science, 2006, 97(10): 1075-1081.
[16]Wenjie Zhang, Yanxia Sui, Arun Budha, Jianbao Zheng, Xuejun Sun, Yingchun Hou, Thomas D Wang and Shaoying Lu. Affinity peptide developed by phage display selection for targeting gastric cancer. World Journal of Gastroenterology, 2012, 18(17): 2053-2060.
[17]Shuhui Liang, Tao Lin, Jie Ding, Yanglin Pan, Dongmei Dang, Changcun Guo, Min Zhi, Pengtao Zhao, Li Sun, Liu Hong, Yongquan Shi, Liping Yao, Jie Liu, Kaichun Wu, Daiming Fan. Screening and identification of vascular-endothelial-cell-specific binding peptide in gastric cancer. Journal of Molecular Medicine, 2006, 84(9): 764-773.
[18]Jianqin kang, Guohong Zhao, Tao Lin, Shanhong Tong, Guanghui Xu, Sijun Hun, Qian Bi, Changcun Guo, Li Sun, Shuang Huan, Qian Xu, Yongzhan Nie, Biaoluo Wang, Shuhui Liang, Jie Ding, Kaichun Wu. A peptide derived from phage display library exhibits anti-tumor activity by targeting GRP78 in gastric cancer multidrug resistance cells. Cancer Letters, 2013, 339(2): 247-159.
[19]Noriyuki Akita, Fukuto Maruta, Leonard W. Seymour, David J. Kerr, Alan L. Parker, Tomohiro Asai, Naoto Oku, Jun Nakayama, Shinichi Miyagawa. Identification of oligopeptides binding to peritoneal tumors of gastric cancer. Cancer science, 2006, 97(10):1075-1081
[20]Han Wang, Rui Li, Caixia Ma, Shaoying Lu, Dan Zhang, Yonge guo, ChunYan Li, JinLing Wu, Qixuan Wang, Jinhui Xu, Yanyan Hu, Yuen Liu. Selection and characterization of a peptide specifically targeting to gastric cancer cell line SGC-7901 using phage display. International Journal of Peptide research and therapeutics. 2013, 19(3):185-274.
[21]Bing Du, Min Qian, Zhongliang Zhou, Peng Wang, Lei Wang, Xiaoping Zhang, Miao Wu, Ping Zhang, Bing Mei. In vitro panning of a targeting peptide to hepatocarcinoma from a phage display peptide library. Biochemical and Biophysical Research Communications, 2006, 342(3): 956-962.
[22]Bing Du, Honghui Han, Ziqiang Wang, Lisha Kuang, Lei Wang, Liping Yu, MiaoWu, Zhongliang Zhou, Min Qian. Targeted drug delivery to hepatocarcinoma in vivo by phage-displayed specific binding peptide. Molecular Cancer Research, 2010, 8(2): 135-144.
[23]Zhang Z, Xu L, Wang Z. Screening serum biomarkers for early primary hepatocellular carcinoma using a phage display technique. J Clin Lab Anal. 2011, 25(6):402-408.
[24]Zhao H, Feng X, Han W, Diao Y, Han D, Tian X, Gao Y, Liu S, Zhu S, Yao C, Gu J, Sun C, Lei L. Enhanced binding to and killing of hepatocellular carcinoma cells in vitro by melittin when linked with a novel targeting peptide screened from phage display. J Pept Sci. 2013, 19(10):639-650.
[25]Guo Y, Ma C, Li C, Wu J, Zhang D, Han J, Wang Q, Xu J, Lu S, Hou Y. Screening and identification of a specific peptide binding to hepatocellular carcinoma cells from a phage display peptide library. J Pept Sci. 2014, 20(3):196-202.
[26]Guo Y, Ma C, Nie G, Li C, Wu J, Han J, Lin F, Tseng H, Chen W, Liang W, Hou Y. The further characterization of the specifically binding peptide to hepatocellular carcinoma. Biomedical Engineering: Applications, Basis and Communications. 2014, [Epub ahead of print]
[27]Sharon J. Miller, Bishnu P. Joshi, Ying Feng,1 Adam Gaustad, Eric R. Fearon, and Thomas D. Wang. In Vivo Fluorescence-Based Endoscopic Detection of Colon Dysplasia in the Mouse Using a Novel Peptide Probe. Plos One, 2011, 6(3): e17384.
[28]Yangde Zhang, Jiji Chen, Yanqiong Zhang, Zhiyuan Hu, Duosha Hu, Yifeng Pan, Sheng Ou, Gang Liu, Xiang Yin, Jingfeng Zhao, Lifeng Ren and Jiwei Wang. Panning and identification of a colon tumor binding peptide from phage display peptide library. Journal of Biomolecular Screening, 2007, 3(12): 429-435.
[29]Bo Tang, Zhexu Li, Dingde Huang, Lei Zheng, Qianwei Li. Screening of a specific peptide binding to VPAC1 receptor from a phage display peptide library. PloS One, 2013, 8 (1): e54264.
[30]Han Wang, Caixia Ma, Rui Li, Yonge Guo, Yakun He, Xiaojing Wang, Yiwen Chen, Yingchun Hou. Selection and characterization of colorectal cancer cell-specific peptides. Biotechnology Letters, 2013, 35(5): 671-677.
[31]Meng Li, Constantinos P. Anastassiades, Bishnu?Joshi, Chris M. Komarck , Cyrus?Piraka, Badih J. Elmunzer, Danielle K. Turgeon, Timothy D. Johnson, Henry?Appelman, David G.?Beer, Thomas D. Wang. Affinity peptide for targeted detection of dysplasia in Barrett's esophagus. Gastroenterology, 2010, 139(5): 1472-1480.
[32]Maria Dolores Tabernero, Lin-Li Lv, Karen S. Anderson. Autoantibody profiles as biomarkers of breast cancer. Cancer Biomarkers, 2010, 6(5-6):247-256.
[33]Ruei-Min Lu, Min-Shan Chen, De-Kuan Chang,Chien-Yu Chiu, Wei-Chuan Lin, Shin-Long Yan, Yi-Ping Wang, Yuan-Sung Kuo, Chen-Yun Yeh, Albert Lo, and Han-Chung Wu. Targeted Drug Delivery Systems Mediated by a Novel Peptide in Breast Cancer Therapy and Imaging. Plos One, 2013, 8(6):e66128.
[34]Xiaoyong Dai, Cuizan Cai, Fei Xiao, Yaoling Xiong, Yadong Huang, Qihao Zhang, Qi Xiang, Guofeng Lou, Mengyang Lian, Zhijian Su, Qing Zheng. Identification of a novel aFGF-binding peptide with anti-tumor effect on breast cancer from phage display library. Biochemical and Biophysical Research Communications, 2014, [Epub ahead of print].
[35]Bing Li, Mei-Hua Ga, Xian-Ming Chu. Molecular mechanism of a novel CD59-binding peptide sp22 induced tumor cells apoptosis. Journal of Cellular Biochemistry, 2012, 113(12): 3810 -3822.
[36]Jinmin Sun, Chao Zhang, Guobing Liu, Hong Liu, Chunping Zhou, Yanxia Lu, Chang Zhou,Li Yuan, Xuenong Li . A novel mouse CD133 binding-peptide screened by phage display inhibits cancer cell motility in vitro. Clinical Experiment Metastasis, 2012, 29 (3):185-196.
[37]Hye-Yeon Park, Kyoung-Jin Lee, Su-Jae Lee, Moon-Young Yoon. Screening of peptides bound to breast cancer stem cell specific surface marker CD44 by phage display. Molecular Biotechnology, 2012, 51 (3): 212 - 220.
[38]Jemal A, Siegel R, Ward E. Cancer statistics. CA Cancer J Clin, 2008, 58(2): 71-96.
[39]Tsuksa?Oyama, Kathryn F.?Sykes, Kausar N.?Samli, John D.?Minna , Stephen Albert?Johnston , Kathlynn C.?Brown. Isolation of lung tumor specific peptides from a random peptide library: generation of diagnostic and cell-targeting reagents. Cancer Letters, 2003, 202(2): 219-230.
[40]Tsukasa Oyama, Irene T. Rombel, Kausar N. Samli, Xin Zhou, Kathlynn C. Brown. Isolation of multiple cellbinding ligands from different phage displayed-peptide libraries. Bioscience and Bioelectronics, 2006, 21(10): 1867-1875
[41]Xiangan Tu, Linquan Zhang, Dongming Lan. Screening and identification of a peptide specifically targeted to NCI-H1299 cells from a phage display peptide library. Molecular Medicine Reports, 2009, 2(6): 1005-1010.
[42]Linquan?Zang, Lei?Shi, Jiao?Guo, Qin?Pan, Wei?Wu, Xuediao?Pan, Junye?Wang. Screening and identification of a peptide specifically targeted to NCI-H1299 from a phage display peptide library. Cancer Letters, 2009, 281(1): 64-70.
[43]Xiaofeng He, Moon-Hee Na, Jin-Sook Kim, Ga-Young Lee, Jae Yong Park, Allan S. Hoffman, Ju-Ock Nam, Su-Eun Han, Ga Yong Sim, Yu-Kyoung Oh, In-San Kim, Byung-Heon Lee. A novel peptide probe for imaging and targeted delivery of liposomal doxorubicin to lung tumor. Molecular Pharmaceutics, 2011, 8(2): 430-438.
[44]Duanwen Shen, Fei Xie, W. Barry Edwards.Evaluation of Phage Display Discovered Peptides as Ligands for Prostate-Specific Membrane Antigen (PSMA). Plos One, 2013, 8(7): e68339
[45]Johanna M. Mattsson, Ale N?rv?nen, Ulf-H?kan Stenman, Hannu Koistinen D.Sc. Peptides binding to prostate specific antigen enhance its antiangiogenic activity. The Prostate, 2012, 72(14): 1588-1594.
[46]B Kwabi-Addo, M Ozen, M Ittmann. The role of fibroblast growth factors and their receptors in prostate cancer. Endocrine-Related Cancer, 2004, 11(4): 709-724.
[47]Mirjami M.?Mattila, Pirkko L.?H?rk?nen. Role of fibroblast growth factor 8 in growth and progression of hormonal cancer. Cytokine Growth Factor Reviews, 2007, 18(3-4): 257-266.
[48]Yongyou Zhang, Jue Zhang, Yongshun Lin, Yongsheng Lan, unhong Lin, Jim W. Xuan, Michael M. Shen, Wallace L. McKeehan, Norman M. Greenberg ,Fen Wang. Role of epithelial cell fibroblast growth factor receptor substrate 2alpha in prostate development, regeneration and tumorigenesis. Development, 2008, 135(4), 775-784.
[49]Wenhui Wang, Xilei Chen, Tao Li, Yanmei Li, Ruixue Wang, Dan He, Wu Luo, Xiaokun Li, Xiaoping Wu. Screening a phage display library for a novel FGF8bbinding peptide with anti-tumor effect on prostate cancer. Experimental Cell Research, 2013, 319(8): 1156-1164.
[50]50. David A Jones, Kimberly A Kelly. Isolation of a colon tumor specific binding peptide using phage display selection. Neoplasia, 2003, 5(5): 437-444.
[51]Ruei-Mi Lu, Min-Shan Chen, De-Kuan Chang, Chien-Yu Chiu, Wei-Chuan Lin, Shin-Long Yan, Yi-Ping Wang, Yuan-Sung Kuo, Chen-Yun Yeh, Albert Lo, Han-Chung Wu . Targeted drug delivery systems mediated by a novel peptide in breast cancer therapy and imaging. PloS One, 2013, 8(6) : e66128.
[52]Qiu Z, Khondee S, Duan X, Li H, Mandella MJ, Joshi BP, Zhou Q, Owens SR, Kurabayashi K, Oldham KR, Wang TD. Vertical cross-sectional imaging of colonic dysplasia in vivo with multi-spectral dual axes confocal endomicroscopy. Gastroenterology. 2014, 146(3):615-617.
[53]Qiu Z, Liu Z, Duan X, Khondee S, Joshi B, Mandella MJ, Oldham K, Kurabayashi K, Wang TD. Targeted vertical cross-sectional imaging with handheld near-infrared dual axes confocal fluorescence endomicroscope. Biomed Opt Express. 2013, 4(2):322-330.
[54]Sevick-Muraca EM, Akers WJ, Joshi BP, Luker GD, Cutler CS, Marnett LJ, Contag CH, Wang TD, Azhdarinia A. Advancing the translation of optical imaging agents for clinical imaging. Biomed Opt Express. 2013, 4(1):160-170.
【责任编辑 谢文海】
Research Progress on Cancer Cell/Targeting Peptides
GUO Yong-e, HOU Ying-chun
(Tumor Molecular Cellular Biology Lab, Shanxi Normal University, Xi’an, Shanxi 710119)
Cancer is the high incidence of the disease that still poses the greatest threat to human health and life in all human diseases because the method of early diagnosis and treatment is not available so far. The breakthrough of the early diagnosis and targeted therapy is a hopeful approach to improve the current cancer diagnosis and treatment, and the recent papers indicate that the specific and sensitive cancer targeting peptides shown significant potential for this purpose. The selection and characterization of cancer targeting peptides have elicited surprised advances in recent years, and this article attempts to summarize and forecast these advancements as the reference to the investigators in this scientific area.
cancer targeting peptide, tumor marker, tumor early diagnosis, tumor targeted therapy
R73-362
A
1004-4671(2014)05-0002-10
2014-02-02
郭永娥(1988~),女,陕西师范大学肿瘤分子细胞生物学实验室2011级硕士研究生,研究方向:癌细胞表面分子。侯颖春(1959~),陕西眉县人,陕西师范大学肿瘤分子细胞生物学实验室教授,博士生导师。研究方向:癌细胞的分子生物学和细胞生物学。

