外来绵羊品种重要单基因遗传病研究进展
岳耀敬,王天翔,秦 哲,郭婷婷,刘建斌,郭 健,杨博辉
(1.中国农业科学院兰州畜牧与兽药研究所,甘肃兰州730050;2.甘肃省绵羊繁育技术推广站)
综述与专论
外来绵羊品种重要单基因遗传病研究进展
岳耀敬1,王天翔2,秦 哲1,郭婷婷1,刘建斌1,郭 健1,杨博辉1
(1.中国农业科学院兰州畜牧与兽药研究所,甘肃兰州730050;2.甘肃省绵羊繁育技术推广站)
随着萨福克羊、杜泊羊、澳洲美利奴羊等国外优良绵羊品种的大量引进,显著提高绵羊生产性能的同时,其携带的各种遗传缺陷病在全国范围内快速蔓延,这将给羊产业带来巨大的经济损失,严重威胁我国绵羊育种和羊业的健康发展。近年来,发达国家通过对种羊进行遗传缺陷病基因诊断进行遗传净化,而我国相关工作尚处于起步阶段。文章就皮肤脆裂症、羔羊蜘蛛综合症和致死型短颌-心脏扩大-肾发育不全综合症等单基因遗传缺陷病的遗传基础、临床症状和检测方法研究进展进行了综述,以期为我国绵羊遗传缺陷病净化提供理论借鉴。
绵羊;单基因;遗传缺陷病;基因诊断
绵羊遗传缺陷病是由于绵羊生殖细胞或受精卵内的遗传物质在结构或功能上发生改变,从而使发育个体出现生理机能的损害,具有先天性和家族性的特征。遗传缺陷多半由缺陷基因引起,可能是致畸、半致死或致死的,也可能影响生活力或外观,在降低羊的经济价值的同时,还可能干扰对流产或其他疾病的诊断,给畜牧生产带来损失[1]。Dennis(1979)指出,据澳大利亚、新西兰、美国等研究资料,绵羊羔羊出生时遗传缺陷病发生率为0.2%~2.0%,其中50%在出生时死亡。贺天涛等[2]报道,新疆和田高寒山区细毛羔羊先天性缺陷发生率为1%,以肌肉骨骼、感觉和中枢神经系统多发。国外对绵羊遗传缺陷病的研究和认识近年取得较大进展,新的病种不断被发现。在动物孟德尔遗传数据库(Online Mendelian Inheritance in Animals,OMIA http://omia.angis. org.au/)中,共收录羊遗传缺陷病213个,符合孟德尔遗传规律的84个,作为潜在人类疾病模型的80个,但已知其遗传分子基础的仅为30个[3]。这些遗传病涉及机体各
个系统,其中以肌肉骨骼系统、神经系统、先天性代谢缺陷、皮肤被毛系统、血液系统、消化系统等病种较多,而在临床上生殖系统遗传病亦较常见。在三大类遗传病中,以单基因遗传病较多,其传递方式又以常染色体隐性遗传最为多见[3]。国内对家畜遗传病的研究起步较晚,20世纪70年代后期有所进展,但主要为奶牛遗传缺陷病的病例、诊断技术研究[4-5],绵羊遗传缺陷病仅有一例报道[2]。我国为提高绵羊个体生产性能和新品种(种系)培育,自上世纪中后期就开始纷纷从国外大量引进绵羊品种达33个(如:澳洲美利奴羊、德国美利奴羊、萨福克羊、特克塞尔羊、杜泊羊、无角陶赛特羊、波德代羊等)与地方羊品种进行杂交改良、品种培育,但上述外来绵羊品种都检出一种或多种遗传病,如杜泊羊携带皮肤脆裂症(Dermatosparaxis)、萨福克羊携带羔羊蜘蛛综合症(spider lamb syndrome,SLS)和澳洲美利奴羊携带致死的短颌-心脏扩大-肾发育不全综合症(brachygnathia,cardiomegalyand renal hypoplasia syndrome,BCRHS)[6]等。近年来,发达国家通过对种羊进行遗传缺陷病基因诊断,计入系谱资料,制定长期育种计划,对遗传缺陷病进行净化,而我国相关工作尚处于起步阶段,虽遗传缺陷病时有发生,但畜牧兽医从业人员对此亦知之甚少,往往被漏诊或误诊,使之得以长期存在和扩散,这将对羊业生产造成重大危害。本文就杜泊羊Dermatosparaxis、萨福克羊SLS和澳洲美利奴BCRHS等单基因遗传缺陷病的遗传基础、临床症状和检测方法研究进展进行综述,以期为加快我国外来绵羊品种开展重要单基因遗传缺陷遗传流行病学调查,遗传缺陷病的遗传机制研究和快速基因诊断技术提供理论借鉴。
1 外来绵羊品种重要单基因遗传缺陷病遗传基础、临床症状研究进展
1.1 杜泊羊携带皮肤脆裂症
杜泊羊(Dorper)原产于南非共和国。杜泊绵羊早期发育快,胴体痩肉率高,肉质细嫩多汁,膻味轻,口感好,特别适于肥羔生产,被国际誉为“钻石级”绵羊肉,具有很高的经济价值。杜泊羊由于品种特性突出,自20世纪90年代起,纷纷被世界上主要羊肉生产国引进。我国2001年开始引入,目前主要分布在山东、陕西、天津、河南、辽宁、北京、山西、云南、宁夏、新疆和甘肃等省、市、自治区,与小尾寒羊、蒙古羊、湖羊、洼地绵羊、呼伦贝尔羊、豫西脂尾羊等品种进行杂交改良,显著提高了杂交后代羔羊的生长发育速度和产肉能力。但杜泊羊携带一种皮肤脆裂症 (Dermatosparaxis),又称 Ehlers-Danlos综合症(Ehlers-Danlos syndrome,EDS)VII C型,本病的临床表现是由于结缔组织异常所致。临床症状主要表现为皮肤和血管十分脆弱或伸展过度,不破皮肤的轻微损伤,可以引起血肿或皮下出血(图1),在人、羊、牛、狗、猫、马和兔中同时也伴随着多种其他临床症状使临床诊断十分困难。H Zhou等(2011)发现由于绵羊ADAMTS2(ADAM metalloproteinase with thrombospondin type 1 motif,2)基因发生SNP c.421G>T突变,导致ADAMTS2提前终止使Ⅰ型前胶原不能进行N端修饰形成有活性的胶原,这些为修饰的前胶原前体组装成不正常胶原纤维在结缔组织不能提供合适的拉伸强度,从而导致Dermatosparaxis[7]。20世纪90年代此病最初流行于南非[8],先后在澳大利亚、新西兰杜泊羊中检测到携带该缺陷基因[7-9],近年来发达国家通过对种羊进行基因诊断,计入系谱资料,制定长期育种计划,对该病进行净化[7-9],我国尚未有关该遗传缺陷病的报道。
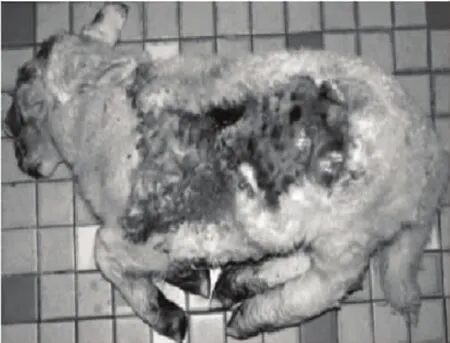
图1 杜泊羊皮肤脆裂症
1.2 萨福克羊羔羊蜘蛛综合症
萨福克羊是世界上优良的生产肉羔的终端父本品种。我国从1978年起先后从澳大利亚、新西兰等国引进,主要分布在新疆、内蒙古、北京、宁夏、吉林、甘肃、河北、青海、山东和山西等省、市、自治区,与我国小尾寒羊、湖羊、滩羊、中国美利奴羊、藏羊、卡拉库尔羊和多浪羊等品种进行杂交改良,可显著提高杂交后代羔羊的生长发育速度和产肉能力[2]。但萨福克羊也携带着一种半致死常染色体隐形遗传缺陷病—SLS,常于出生或出生4~6周时发病,使羔羊骨骼畸形,其症状主要表现为骨骼长度异常、四肢弯曲、脊椎隆起,造成不能正常独立生活而死亡。Beever等[10]发现由于绵羊纤维母细胞生长因子受体3(Fibroblast growth factor receptor 3,FGFR3)基因发生SNPT1719>A错义突变,造成受体酪氨酸激酶Ⅱ功能域上氨基酸突变,受体功能失活,导致SLS。20世纪70年代此病最初流行于美国、加拿大的萨福克羊群中,先后陆续在澳大利亚、新西兰、德国萨福克羊中检测到携
带该缺陷基因,并纷纷淘汰有携带该缺陷基因的种公羊[11-14]。而此阶段我国从上述国家大量引进潜在携带该缺陷基因、无系谱资料的萨福克羊,随着人工授精、胚胎移植技术的应用,将显著提高携带该缺陷基因的羊群比例,这将严重威胁我国羊种业和羊业的安全发展。而我国对于该遗传缺陷病的研究尚处于起步阶段,2011年项目组首次在新疆阿克苏地区某萨福克种羊场发现了该病例,并检测到携带该缺陷基因(内部材料未公开发表),但我国尚未有关该遗传缺陷病的完整记录。

图2 蜘蛛羔羊综合症萨福克羊
1.3 澳洲美利奴羊致死型短颌-心脏扩大-肾发育不全综合症
澳洲美利奴羊产于澳大利亚,具有毛被毛丛结构好、羊毛长、油汗洁白、弯曲呈明显大中弯、光泽好、剪毛量和净毛率高等优点,是世界上最著名的细毛羊品种。分为超细型(Super fine wool merino)和细毛型(Fine wool Merino),中毛型(Medium Wool Merino)及强毛型(Strong Wool Merino),其中又分为有角系与无角系两种。我国从1972年以来,数次从澳大利亚、新西兰等国引进澳洲美利奴公羊,主要分布在新疆、内蒙古、吉林、甘肃、黑龙江等细毛羊产区,用其与各地细毛羊杂交(或导血),对提高我国各地细毛羊的净毛产量,改善羊毛长度、细度、匀度、油汗、光泽和拉伸强度等羊毛质量,起到了积极作用,并起到显著效果,培育出了中国美利奴羊、新吉细毛羊和超细型细毛羊。但澳洲美利奴羊携带最近发现的一种致死型BCRHS[6]。临床症状表现为侏儒,体重偏小不足正常的1/2,短颌,胸腔仅有正常羊的3/4,但心脏显著膨大到原来的1.5倍,腹部膨胀,肝脏也显著膨大到原来的1.5倍并有轻微的斑点,肾脏严重发育不全,仅有正常的1/2,羔羊不能正常行走、呼吸和哺乳,出生后不久就会死亡,通过遗传流行病学调查、系谱分析初步认定为隐型常染色体遗传缺陷病[6]。在国内近年来本项目组在国内某羊场引进澳洲超细美利奴进行培育超细型细毛羊新品种横交固定阶段,也发现类似临床症状的羔羊(见图3),但是否确为该遗传缺陷病还需进一步开展该病的遗传流行病学调查工作。
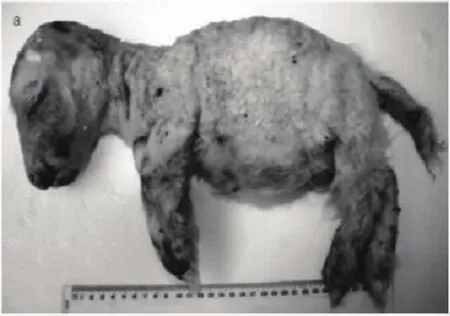
图3 疑似澳洲美利奴羊致死型BCRH临床症状
2 绵羊Dermatosparaxis,SLS,BCRHS遗传缺陷病基因诊断技术研究进展
传统的遗传疾病诊断方法有3种:临床学诊断、遗传流行病调查和生物化学诊断[3]。这些诊断方法都是以疾病的表型病变为依据。而表型则易受外界环境的影响,这就在一定程度上影响了诊断的准确性和可靠性。以分子生物学为基础的基因诊断则是在作为生命的遗传基础物质——DNA水平上对遗传疾病进行诊断,可揭示发病的遗传本质,不但可鉴定表现症状的有害基因纯合个体,也可鉴定出没有异常表型的有害基因携带者,尤其适于早期诊断。因而基因诊断与传统疾病诊断方法相比具有更准确、可靠并且诊断时间早的特点[1]。
遗传缺陷病分为常染色体遗传缺陷病和性染色体遗传缺陷病,其中常染色体遗传缺陷病根据致病原因又分为单基因遗传缺陷病、多基因遗传缺陷病和染色体畸变遗传缺陷病3种,性染色体遗传缺陷较少见[1]。基因诊断首要环节就是开展遗传缺陷病遗传机制研究即致病基因定位研究,对于未知基因、未知突变的单基因遗传病的基因定位,常用策略为通过家系连锁分析(familybased linkage stud ies)的定位克隆 (positional cloning)方法,它需要首先开展家系调查和系谱分析,然后应用微卫星标记[也称短串联重复序列(short tandem repeat,STR)]或单核苷酸多态性(Single nucleotide polymorphism,SNP)进行基因分型、连锁分析及单倍型分析,还可采用关联分析及连锁不平衡分析,以定位单基因遗传病的致病基因及多基因遗传病的易感基因,最后通过候选基因法找出致病基因及易感基因[15]。它在过去的20余年中发挥了重要作用,目前已知的绵羊大部分单基因遗传病的致病基因
均通过这一策略定位,但对于复杂性疾病,分析的作用非常有限[15]。同时该方法耗时费力,如萨福克羔羊蜘蛛综合症从临床发现到将其定位到FGFR3基因的突变用了23年时间。1996年,Risch和Merikangas的研究显示,在常见复杂疾病的遗传学研究中关联研究较连锁研究有更高的效力,并提出全基因组关联分析(genome wide associa ion studies,GWAS)的概念[16]。这一概念是基于“常见疾病,常见变异”(Common disease,common variant)的假设,其基本原理是:在一定人群中选择病例组和对照组,比较全基因组范围内所有SNP位点的等位基因或者基因型频率在病例组与对照组间的差异。如果某个SNP位点的等位基因或基因型在病例组中出现的频率明显高于或低于对照组,则认为该位点与疾病间存在关联性。之后根据该位点在基因组中的位置和连锁不平衡关系推测可能的疾病易感基因。比如某个SNP位点的等位基因C在糖尿病患者中的频率是0.355,而在对照中的频率是0.123,经过统计分析发现差异有显著性,可以说此基因位点与疾病存在关联性。全基因组关联分析是应用人类基因组中数以百万计的SNP为标记进行病例-对照关联分析,以期发现影响复杂性疾病发生的遗传特征的一种新策略[17]。与以往的候选基因关联分析策略明显不同的是,全基因组关联分析(GWAS)不再需要在研究之前构建任何假设(hypothesis free),即不需要预先依据那些尚未充分阐明的生物学基础来假设某些特定的基因或位点与疾病相关联[18]。2005年,Science杂志首次报道了年龄相关性视网膜黄斑变性GWAS结果,在医学界和遗传学界引起了极大的轰动[19],此后一系列GWAS陆续展开。近年来,随着基因芯片、高通量测序技术的快速发展,绵羊基因组计划和基因组单倍体图谱计划(international sheep hap map project)的实施,研究者开始应用GWAS对影响绵羊性状形成和单基因遗传缺陷病、多基因遗传缺陷病产生的遗传特征进行了探索。短短几年内,已经发现并鉴定了多个与绵羊经济性状或复杂性疾病关联的遗传变异,如特克塞尔羊的小眼畸形[20]、软骨发育不全[21],柯立德绵羊的遗传性软骨病[22],美利奴羊控制角的基因[23],为开展我国外来绵羊品种及其杂交群体中遗传缺陷病的遗传机制提供了新的思路。
对已知基因突变位点的遗传缺陷病基因诊断技术主要有:聚合酶链式反应-限制性片段长度多态性技术(polymerasechain reaction-Restriction fragmentlength polymorphism,PCR-RFLP)、变性梯度凝胶电泳(Denatured Gradient Gel Electrophoresis,DGGE)、聚合酶链式反应-单链构象多态性(polymerase chain reaction-singlest rand conformation polymorphism,PCR-SSCP)、扩增片段长度多态性(amplified fragment length polymorphism,AFLP)等技术[18]。在绵羊Dermatosparaxis,SLS,BCRHS遗传缺陷病基因诊断技术方面,H Zhou等[7]和Beever等[10]分别建立了皮肤脆裂症PCR-SSCP基因诊断技术、蜘蛛羔羊综合症PCR-RFLP基因诊断技术,但上述方法操作复杂、价格较高(10元/羊)、检测周期长(1周),且需要大型的仪器设备(如需要凝胶成像分析系统、基因扩增仪、高速离心机、稳压稳流电泳仪,单道可调移液器、电子天平、紫外分光光度计、水平及垂直电泳槽、高压灭菌锅等)和熟练的实验技能(聚丙烯酰胺凝胶的制备、电泳技术要求高,重复性较差)[24-26],因此并不适合于畜牧生产中应用,难以广泛推广,因而亟需建立更为经济、快速而准确的基因诊断技术。高分辨率熔解曲线分析技术(High Resolution Melting,HRM)是近几年兴起的SNP及突变研究工具[27]。它通过实时监测升温过程中双链DNA荧光染料与PCR扩增产物的结合情况,来判断是否存在SNP,而且不同SNP位点、是否是杂合子等都会影响熔解曲线的峰形,因此HRM分析能够有效区分不同SNP位点与不同基因型[28]。这种检测方法不受突变碱基位点与类型的局限,无需序列特异性探针,在PCR结束后直接运行高分辨率熔解,即可完成对样品基因型的分析。该方法无需设计探针,操作简便、快速,成本低,结果准确,并且实现了真正的闭管操作[29]。该方法是在封闭的试管内进行,可降低污染;同时只需要一种试剂在一个平台上进行基因分型和突变扫描,HRM已经在人类(双倍体)和微生物(单倍体)的基因分型中得到应用。人类疾病基因包括β球蛋白、囊肿性纤维化、V因子、凝血素、血色沉着病蛋白、血小板抗原、乳糖分解酵素和MGMT启动子区域的甲基化。微生物基因有:hsp65、16s rRNA基因、gyrA等。目前我们已建立FecB和FeXG高分辨率熔解曲线分析法[27],实现了FecB和FeXG同时检测,该方法操作简单,仅需DNA提取、PCR扩增、高分辨率熔解曲线检测三步,省去了上述PCR产物限制性片段长度多态性分析、PCR产物单链构象多态性分析中PCR扩增后的酶切、制胶、电泳、染色等步骤,检测价格低(3.5元/羊)、检测周期短(600个样/h),仪器设备少(如荧光定量基因扩增仪、高速离心机、单道可调移液器、电子天平、紫外分光光度计、高压灭菌锅等)和对实验技能要求不高。FecB和FeXG高分辨率熔解曲线分析法目前已广泛应用于甘肃高山细毛羊、小尾寒羊、湖羊、滩羊及其杂交羊品种中多胎基因的检测,表明该技术更适用于基层育种单位对多胎性状的早期检测和选育。因此,该技术具有操作简单、成本低廉、时间短、误差少、高通量检测等优点,可弥补PCR产物限制性片段长度多态性分析、PCR产物单链
构象多态性分析检测技术的不足,非常适用于绵羊遗传缺陷病的基因诊断[27]。
总之,近年来发达国家通过对种羊进行遗传缺陷病基因诊断,计入系谱资料,制定长期育种计划,对遗传缺陷病进行净化,但我国畜牧兽医从业人员对此亦知之甚少,往往被漏诊或误诊,使之得以长期存在和扩散,这将对羊业生产造成重大危害。因此,亟需进行遗传缺陷病的遗传机制研究,建立其快速基因诊断技术,为该病的净化奠定基础;亟需在全国开展外来绵羊品种重要遗传缺陷病遗传流行病学调查,应用GWAS初步阐明BCRHS遗传机制,开发基于HRM技术萨福克羊、杜泊羊、澳洲美利奴羊携带的Dermatosparaxis,SLS,BCRHS快速基因诊断试剂盒,建立遗传缺陷病净化技术体系。从而不仅为萨福克羊、杜泊羊、澳洲美利奴羊在中国羊业中的发展扫清障碍,而且可以作为人类相关疾病的理想模型,为人类遗传缺陷疾病遗传机制研究和基因治疗提供基础。
[1]Frank W.Nichola.Introduction to Veterinary Genetics[M].Sydney:Wiley-Blackwell,2010.
[2]贺天涛,刘竹初,戴焕喜,等.高寒山区绵羊遗传病调查[J].中国兽医杂志,2000,26(7):23-24.
[3]Online Mendelian Inheritance in Animals.Frank Nicholas,University of Sydney,Australia.MIA 000593.World Wide Web URL:http://omia. angis.org.au/retrieve.shtml?pid=1160.
[4]李艳华,张胜利,刘振君,等.荷斯坦奶牛有害基因检测方法的建立及诊断平台的组建[J].北京奶业,2007(4):1-2.
[5]王帅,王栋,杜卫华,等.荷斯坦奶牛脊椎畸形综合症的研究进展[J].遗传,2007,29(9):1049-1054.
[6]Shariflou MR,Wade C M,Windsor P A,et al.Lethal genetic disorder in Poll Merino/Merino sheep in Australia[J].Aust Vet J,2011,89:254-259.
[7]Zhou H,Hickford J G H,Fang Q.A premature stop codon in the ADAMTS2 gene is likely to be responsible for dermatosparaxis in Dorper sheep[J].Animal Genetics,2011,42(5):1-3.
[8]Van Halderen A,Green J R.Dermatosparaxis in White Dorper sheep[J].Journal of the South African Veterinary Association,1988,59:45-46.
[9]Anonymous.Screen Test for Fragile Skin.http://www.dpi.nsw.gov. au/research/updates/issues/july-2007/fragile-skin(accessed 19 May 2011).NewSouth Wales Government Department of Primary Industries,Orange,NewSouth Wales,Australia,2007.
[10]Beever J E,Cockett N E.Screening for the molecular defect causing spider lamb syndrome in sheep:USpatent no.6,306,591B1[P].2001.
[11]RookJS,TrappAL,KrehbielJ,etal.Diagnosisofhereditarychondrodysplagia(spiderlambsyndrome)insheep[J].JAmVetMedAssoc,1988, 193:713-718.
[12]KennedyGF.Straight talk[J].Suffolk Banner,1984,7(10):108.
[13]Phillips P H,Bunn C M,Anderson C E.Ovine hereditary chondrodysplasia(spider syndrome)in Suffolk lambs[J].Aust Vet J,1992,70:73 -74.
[14]West D M,Burbidge H M,Vermunt J J,et al.Hereditary chondrodysplasia(“spider syndrome”)in a NewZealand Suffolk lamb ofAmerican origin[J].NZVet J,1995,43:118-122.
[15]杨博辉,岳耀敬,王丽萍,等.绵羊基因组研究进展[J].中国草食动物,2009(6):52-54.
[16]Risch N,Merikangas K.The future of genetic studies of complexhuman diseases[J].Science,1996,273(5281):1516-1517.
[17]Hardy J,Singleton A.Genomew ide association studies and human disease[J].NEngJ Med,2009,360:1759-1768.
[18]Todd J A.Statistical false positive or true disease pathway?[J].Nat Genet,2006,38:731-733.
[19]Klein R J,Zeiss C,ChewE Y,et al.Complement factor H polymorphism in age-related macular degeneration[J].Science,2005,308(5720):385 -389.
[20]Becker DJ,Tetens A,Brunner D,et al.Microphthalmia in Texel sheep isassociated with a missense mutation in the paired-like homeodomain 3(PITX3)gene[J].PLoSONE,2010,5:8689.
[21]ZhaoX,Blair H T,OnteruPiripi SSA,et al.A genome wide association study and fine mapping for Chondrodysplasia of Texel sheep[C]//The International Plant&Animal Genome XVIII Conference.San Diego:California,2010:579.
[22]Zhao X,Dittmer K E,Blair H T,et al,Rothschild MF.A Novel NonsenseMutation in the DMP1 Gene Identified by a Genome-Wide Association Study Is Responsible for Inherited Rickets in Corriedale Sheep[J].PLoSONE,2011,6(7):e21739.
[23]Johnston S E,Mcewan J C,Pickering N K,et al.Genome-wide association mapping identifies the genetic basis of discrete and quantitative variation in sexual weaponryin a wild sheep population[J]. Molecular Ecology,2011,20:2555-2566.
[24]陈扣扣,杨博辉,郎侠,等.8个微卫星位点在甘肃高山细毛羊肉毛兼用品系中的遗传多样性研究[J].中国畜牧兽医,2009(2):77-81.
[25]刘建斌,郎侠,杨博辉,等.BMPR-IB基因和FSHβ基因多态性及其与小尾寒羊产羔数关联性分析[J].中国畜牧杂志,2010(19):1-6.
[26]雒林通,杨博辉,史兆国,等.甘肃高山细毛羊优质毛品系微卫星标记与经济性状的相关性分析[J].江苏农业学报,2010(2):331-338.
[27]Yue Y J,Yang B H,Liang X,et al.Simultaneous identification of FecB and FecX G mutations in Chinese sheep using high resolution melting analysis[J].Journal of Applied Animal Research,2011,39(2):164-168.
[28]Witter C T,Reed G H,Gundry C N.High-resolution genotyping by amplicon melt ing analysis using LCGreen[J].Clin Chem,2003,49:853-860.
[29]LiewM,Seipp M,Durtschi J,et al.Closed-tube SNP genotypingwithout labeled probes/a comparison between unlabeled probe and amplicon melting[J].AmJ Clin Pathol,2007,127:1-8.
The Progess on the Important Single-gene Genetic Disease of the Exotic Sheep Breeds
Yue Yao-jing1,WangTian-xiang2,YangBo-hui1,et al
(1.Lanzhou Institute ofHusbandryand Pharmaceutical Sciences ofCAAS,Lanzhou,730050 China; 2.Gansu Provincial Sheep BreedingTechnologyExtension Station)
The production performance of the sheep was significantly improved by introducing with a large number of Suffolk,Dorper,Australian Merino and other varieties of sheep in our country.However,that made various genetic diseases quickly spreadingacross the country,which would bringhuge economic losses and serious threat to the healthy development ofsheep industry.In recent years,developed countries had clean up the genetic defect diseases bygenetic test,while our related work is still in its infancy.In this paper,the genetic basis,clinical symptoms and diagnostic techniques of the Dermatosparaxis,spider lamb syndrome and brachygnathia,cardiomegaly and renal hypoplasia syndrome were reviewed,which will provide theoretical reference for clean up the genetic defect diseases in our county.
sheep;monogenic;genetic disease;genetic test
S585.26
A
2095-3887(2014)03-0050-05
10.3969/j.issn.2095-3887.2014.03.017
2014-04-15
国家绒毛用羊产业技术体系分子育种岗位(CARS-40-03B);中央级公益性科研院所基本科研业务费专项资金项目(BRF1610322014006)
岳耀敬(1980-),男,在读博士,主要从事绵羊育种研究。
杨博辉(1964-),男,研究员,博士。

