血浆miR-221在小细胞肺癌患者血浆中的表达及其临床意义
广东医学院附属医院肿瘤中心肿瘤3区,广东 湛江 524000
血浆miR-221在小细胞肺癌患者血浆中的表达及其临床意义
冯丽萍 罗亮 苏文媚
广东医学院附属医院肿瘤中心肿瘤3区,广东 湛江 524000
背景与目的:MicroRNAs(miRNAs,miR)与肿瘤的发生、发展和转移密切相关。肿瘤组织中miRNAs表达水平的变化可能会引起循环miRNAs随之改变。本研究目的是探讨小细胞肺癌(small cell lung cancer,SCLC)患者临床标本中miR-221的表达及其临床意义。分析miR-221在51例SCLC患者及20例健康对照者血浆和组织中的表达及其与各临床病理参数的关系。方法:采用实时荧光定量PCR法检测51例SCLC患者癌组织、癌旁及正常组织中miR-221的表达。进一步检测血浆miR-221在51例SCLC患者及20例健康对照者中的表达。结合临床资料分析其表达在临床中的作用和意义,判定血浆miR-221能否作为SCLC早期诊断、治疗及预后的标志。结果:miR-221在SCLC组织中的表达水平较癌旁及正常肺组织高;血浆miR-221在SCLC患者中的表达较健康对照者高(P<0.05)。miR-221的表达与患者的性别、年龄无关(P>0.05),与疾病分期、对化疗的敏感性及生存期密切相关,差异具有统计学意义(P<0.05)。Cox回归分析发现疾病分期、miR-221的表达可作为独立的预后因子。结论:血浆miR-221的表达与SCLC的肿瘤分期、对化疗的敏感性和生存期相关。检测血浆miR-221可作为评估SCLC患者临床预后的靶基因。
小细胞肺癌;实时荧光定量PCR;血浆miR-221
小细胞肺癌(small cell lung cancer,SCLC)是一种以生长迅速、早期转移、高度侵袭性为特点的肺癌类型,其发病率占原发性肺癌的15%~20%[1-2]。SCLC的肿瘤细胞虽对化疗和放疗都非常敏感,但多方案的临床试验并没能找到彻底治愈SCLC的有效方法,多数患者在一线治疗以后仍会发生肿瘤复发或转移,临床预后差[3-4]。因此,需要从分子层面寻找有效的诊断、治疗、监测等标志物;此外,与SCLC、乳腺癌等肿瘤相比,SCLC化疗药物、靶向药物非常有限。
MicroRNAs(miRNAs,miR)是一种内源性的非编码RNA(ncRNA),由17~25个碱基组成单链RNA分子,广泛存在于各种生物体中。miRNA在转录水平和转录后控制调控细胞生命活动。在肿瘤诊断、预后评估等方面,多个组织miRNA表达谱已被鉴定为重要的标志物[5-6]。血浆里同样可以检测到miRNA,循环miRNA来源于肿瘤组织,受内源性RNA酶的保护[7]。目前在淋巴瘤、前列腺癌、胃癌、结直肠癌患者血浆中检测到肿瘤相关的miRNA,而且miRNA具有较强的稳定性和特异性。近年来的研究发现血浆miR-141能区分前列腺癌和健康对照志愿者,miR-21在弥漫性大B细胞淋巴瘤患者血浆中升高,与患者的无复发生存期延长相关[7-10]。在SCLC患者血浆中miR-92水平明显升高,可以作为潜在的无创性诊断分子标志物[11]。前期通过基因芯片发现miR-221在SCLC耐药细胞株中的表达降低。然而关于miR-221在SCLC临床标本中的表达情况目前国内外鲜见相关报道。本研究通过实时荧光定量PCR检测SCLC患者外周血液中血浆miR-221及组织标本中miR-221的表达,分析其血浆miR-221与组织中miR-221的相关性,进一步明确血浆miR-221在SCLC诊断、治疗和预后评估中的作用。
1 资料和方法
1.1 临床标本收集
51例SCLC患者标本取自2009年1月—2013年3月就诊于广东医学院附属医院肿瘤科、胸外科及呼吸内科的患者,其中男性26例,女性25例;患者年龄30~82岁,中位年龄53岁,53岁以下患者22例,53岁以上患者29例;广泛期31例,局限期20例。对化疗敏感者18例,对化疗耐药者33例。51例SCLC组织标本为SCLC纤维支气管镜检查及活检组织,血液标本为放化疗前的标本,所有标本均为经病理学检查确诊的SCLC,全部病例获取前均未行化疗和放疗,临床资料完整,患者未合并其他系统的疾病。20例正常血液标本取自正常人体检血液标本,体检证实未患肿瘤及其他疾病,20例非肿瘤组织为癌旁组织。本研究经广东医学院附属医院伦理委员会批准,所有患者均签署知情同意书。全部108例患者出院后均随访,随访方式为电话随访和复查随访,内容包括一般情况、临床症状及影像学检查。随访起点为确诊日期,末次随访时间为2013年3月31日,至随访截止日,依然生存13例,死亡38例,无失访病例。
1.2 RNA的提取
1.2.1 血浆RNA提取
500 μL低温保存的血浆标本,置于冰上融化,且充分混匀。加入500 μL TRIzol,vortex剧烈震荡30 s,室温静置5 min;加200 μL异丙醇,颠倒混匀,vortex 剧烈震荡2 min(至液体透明),室温静置5 min;于4 ℃,13 000 r/min(离心半径6.9 cm)离心15 min,将上清液移至新eppendorf管;加500 μL三氯甲烷,颠倒混匀,vortex剧烈震荡1 min,室温静置5 min;于4 ℃,13 000 r/min(离心半径6.9 cm)离心15 min,将上清液移至新的eppendorf管;加0.75体积的异丙醇至上清液中,颠倒混匀,室温静置10 min;于4 ℃,13 000 r/min(离心半径6.9 cm)离心10 min,沉淀RNA;吸弃上清液,沉淀用体积分数为75%的乙醇洗1次;于4 ℃,7 500 r/min (离心半径为6.9 cm)离心5 min,沉淀RNA;吸净乙醇,30 μL焦碳酸二乙酯水溶解RNA。
1.2.2 组织RNA提取
收集SCLC癌组织及癌旁组织(约50~100 mg)在液氮中磨成粉末后,加入1 mL TRIzol液研磨(样品总体积不超过所用TRIzol体积的10%),分别移入去RNA酶的EP管中,提取总RNA。
1.3 实时荧光定量PCR分析miR-221的表达
将上述血浆及组织中提取的RNA进行逆转录和实时荧光定量PCR检测。逆转录反应程序为:16 ℃变性30 min,42 ℃延伸30 min,85 ℃终延伸10 min。结束后立即将cDNA产物取出,快速置于冰上冷却,后续所有步骤均在冰上进行。将cDNA产物稀释3~4倍,然后混匀并从中吸取2 μL(20 μL体系)做为定量PCR的模板,剩余产物存放于-20 ℃。PCR反应在ABI7500实时定量PCR反应仪上进行,程序为:95 ℃预变性3 min;95 ℃变性12 s,62 ℃延伸1 min,共40个循环;95 ℃终延伸15 s。反应结束后确认real time PCR的扩增曲线和融解曲线,进行PCR定量时制作标准曲线等。3次独立实验后得到的数据运用公式2-△△Ct的方法进行分析。△△Ct=(待测样品的目的基因的Ct的平均值-待测样本的管家基因的Ct的平均值)-(对照样品的目的基因的Ct的平均值-对照样本的看家基因的Ct的平均值)。
1.4 统计学处理
采用 SPSS 13.0统计学软件进行数据分析。患者血液及组织标本中miR-221的差异表达采用t检验分析,以表示。miR-221的表达与各临床病理参数之间的关系使用χ2检验;生存分析用Kaplan-Meier法。组间生存曲线差别用对数秩检验(Log-rank test);应用Cox比例风险模型分析影响SCLC预后的因素。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-221在SCLC患者血浆及肿瘤组织中的表达
采用实时荧光定量PCR对51例SCLC患者和20例正常人血浆及肿瘤组织中miR-221的表达进行检测,发现miR-221在SCLC患者肿瘤组织中的表达(9.64±1.09)高于癌旁组织(1.11±0.07),差异有统计学意义(图1A、B,P<0.05)。ROC曲线面积为0.722(95%CI:0.597~0.847,图1C)。SCLC患者血浆miR-221的相对表达水平(8.69±0.98)明显高于健康对照(1.01±0.08) ,差异有统计学意义(P<0.001,图2A、B)。ROC曲线分析证实,血浆miR-221可以作为区分SCLC患者和正常对照的潜在分子标志物,ROC曲线面积为0.859(95%CI:0.783~0.934,图2C)。
2.2 miR-221在SCLC中的表达及其与临床病理特征的关系
采用χ2检验分析miR-221的表达与患者年龄、性别、疾病分期、对化疗的敏感性及患者生存期的关系,结果发现,miR-221的表达与患者的性别、年龄无相关性,差异无统计学意义(P均>0.05,表1);与患者对化疗药物的敏感性、疾病分期及生存期密切相关,差异有统计学意义(P均<0.001,表1)。
2.3 SCLC患者生存分析
采用Kaplan-Meier法估计患者生存期,结果发现男性患者与女性患者的生存期差异无统计学意义(χ2=2.155,P=0.230)。≤53岁的患者与>53岁患者生存期差异无统计学意义(χ2=1.049,P=0.092);局限期患者的生存期长于广泛期患者,差异有统计学意义(χ2=32.631,P<0.001);miR-221低表达者的生存期长于高表达者,差异有统计学意义(χ2=26.638,P<0.001),化疗敏感者患者的生存期长于化疗耐药者,差异有统计学意义(χ2=11.907,P<0.001,图3).
采用Cox回归分析患者的性别、年龄、疾病分期及促分泌素表达与患者预后的关系,发现疾病分期和miR-221表达可作为独立的预后因子,广泛期患者的相对危险度为3.993,差异有统计学意义(95%CI:2.172~13.606,χ2=4.898,P=0.027);miR-221高表达的相对危险度为8.569,差异有统计学意义(95%CI:4.375~21.513,χ2=28.703,P<0.001,表2)。
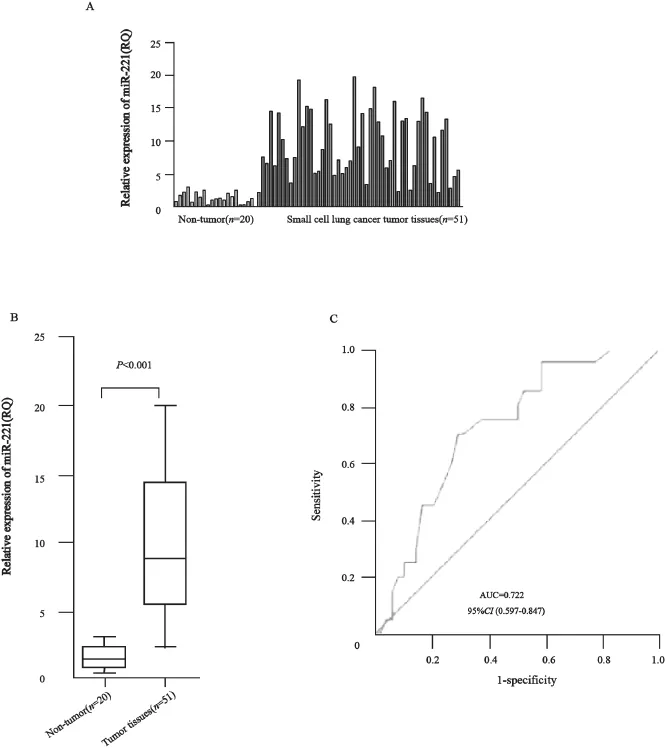
图1 miR-221在51例SCLC患者癌组织和20例癌旁组织及正常肺组织中的表达Fig. 1 The miR-221 expression in the cancer tissues of 51 SCLC patients and the para-cancerous tissues and normal tissues in 20 healthy volunteers
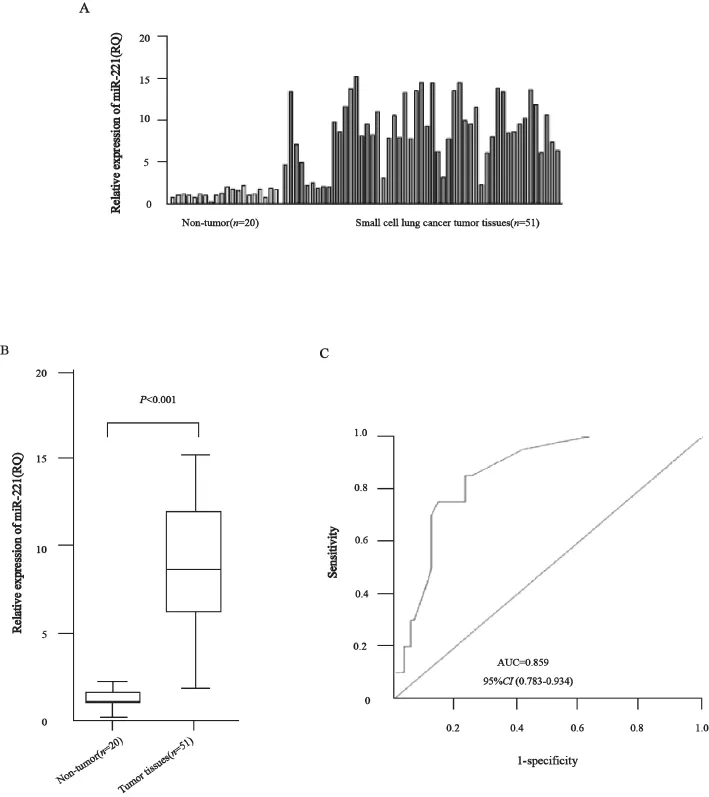
图2 miR-221在51例SCLC患者和20例正常人血浆中的表达Fig. 2 The miR-221 expression in the serum of 51 consecutive SCLC patients and 20 healthy volunteers

表1 miR-221的表达与患者临床特征的关系Tab. 1 Association of miR-221 with clinical parameters

图3 比较不同的疾病分期、miR-221的表达及化疗敏感性与患者生存时间的关系Fig. 3 Compare of survival times considering stage, miR-221 expression and sensitivity to drugs

表2 Cox回归分析发现疾病的分期和miR-221的表达与SCLC预后的关系Tab. 2 Cox regression analysis identi fi ed the relationship of miR-221 and stage with prognostic of SCLC patients
3 讨 论
研究发现miRNA在很多肿瘤异常表达,与肿瘤的关系密切,涉及诸多方面,包括肿瘤形成、侵袭转移、分期预后、治疗反应、疗效预测、耐药等[12]。在不同肿瘤中的差异表达及其与肿瘤的分类、诊断和治疗的相关性,提示其可能成为肿瘤预后检测的重要生物标志分子。Yamamoto等[13]发现,在肝癌患者血浆中miR-500高表达,而3例肝癌术后患者血浆中miR-500表达恢复到正常水平,提示miR-500血浆表达水平不仅可用于肝癌发展过程变化的诊断,还能够反映患者病程的发展过程。肿瘤切除后,测定患者血液中miR-500等能够尽早发现肿瘤转移等情况,有利于决定下一步的治疗方案。Hu等[14]对303例非小细胞肺癌(non-small cell lung cancer,NSCLC)进行了miRNA分析,发现有4种miRNA与患者的生存期密切相关,并且4种miRNA与NSCLC分期有关,这种特异性的miRNA分析,有可能为NSCLC患者病程的预测以及选择更适合的治疗方法提供依据。
近年来的研究发现miR-221通过调节数百种mRNA的表达,影响多种肿瘤的信号通路[15]。miR-221在胰腺癌[16]、乳头状甲状腺癌[17]、脑胶质母细胞瘤[18-19]、乳腺癌[20]和前列腺癌[21]等多种肿瘤中表达上调。高表达的miR-221与肿瘤生成、治疗、耐药相关。在前列腺癌、甲状腺癌等肿瘤组织中miR-221高表达的患者预后较差[19,21-22]。miR-221在肾癌患者循环中的高表达与其预后差相关[23]。miR-221促进三阴性乳腺癌肿瘤的形成[24];增加miR-221的表达能够减少T细胞急性淋巴细胞白血病患者的生存期[25]。与本 研究结果一致,我们采用QRT-PCR对51例SCLC患者和20例正常人血浆及组织中miR-221的表达进行检测,发现SCLC患者肿瘤组织及循环中miR-221的相对表达水平明显高于健康对照者。ROC曲线分析证实miR-221作为区分SCLC患者和正常对照的潜在分子标志,血浆中miR-221的水平能够反映SCLC肿瘤组织中的miR-221表达水平。miR-221的表达与患者的性别、年龄无相关性,与患者对化疗药物的敏感性、疾病分期及生存期密切相关。采用Kaplan-Meier法估计患者生存期,患者的生存期与性别、年龄无关,与疾病的分期、患者对化疗药物的敏感性及miR-221的表达相关。Cox回归分析发现肿瘤分期和miR-221可作为独立的预后因子。以上结果提示通过无创检测血浆miR-221可能作为SCLC潜在的早期诊断、预后及疗效评价的分子标志物。
[1]CALIFANO R, ABIDIN A Z, PECK R, et al. Management of small cell lung cancer: recent developments for optimal care[J]. Drugs, 2012, 72(4): 471-490.
[2]KALEMKERIAN G, PAKERLEY W, BOGNER P, et al. Small cell lung cancer [J]. J Natl Compr Canc Netw, 2013, 11(1): 78-98.
[3]LOPEZ-CHAVEZ A, SANDLER A. Systemic issues in small cell lung cancer[J]. Curr Probl Cancer, 2012, 36(3): 131-155.
[4]METRO G, DURANTI S, FISCHER M J, et al. Emerging drugs for small cell lung cancer--an update [J]. Expert Opin Emerg Drugs, 2012, 17(1): 31-36.
[5]CALIN G A, FERRACIN M, CIMMINO A, et al. A MicroRNA signature associated with prognosis and progression in chronic lymphocytic leukemia [J]. N Engl J Med, 2005, 353(17): 1793-1801.
[6]YU S L, CHEN H Y, CHANG G C, et al. MicroRNA signature predicts survival and relapse in lung cancer [J]. Cancer Cell, 2008, 13(1): 48-57.
[7]MITCHELL P S, PARKIN R K, KROH E M, et al. Circulating microRNAs as stable blood-based markers for cancerdetection[J]. Proc Natl Acad Sci U S A, 2008, 105(30): 10513-105138.
[8]LAWRIE C H, GAL S, DUNLOP H M, et al. Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma [J]. Br J Haematol, 2008, 141(5): 672-675.
[9]TSUJIURA M, ICHIKAWA D, KOMATSU S, et al. Circulating microRNAs in plasma of patients with gastric cancers [J]. Br J Cancer, 102(7): 1174-1179.
[10]LODES M J, CARABALLO M, SUCIU D, et al. Detection of cancer with serum miRNAs on an oligonucleotide microarray[J]. PLoS One, 2009, 4(7): e6229.
[11]HUANG Z, HUANG D, NI S, et al. Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer[J]. Int J Cancer, 2010, 127(1): 118-126.
[12]MELTZER P S. Cancer genomics: small RNAs with big impacts [J]. Nature, 2005, 435(7043): 745-746.
[13]YAMAMOTO Y, KOSAKA N, TANAKA M, et al. MicroRNA-500 as a potential diagnostic marker for hepatocellular carcinoma[J]. Biomarkers, 2009, 14(7): 529-538.
[14]HU Z, CHEN X, ZHAO Y, et al. Serum microRNA signatures identified in a genome-wide serum microRNA expression profiling predict survival of non-small-cell lung cancer[J]. J Clin Oncol, 2010, 28(10): 1721-1726.
[15]LUPINI L, BASSI C, FERRACIN M, et al. miR-221 affects multiple cancer pathways by modulating the level of hundreds messenger RNAs[J]. Front Genet, 2013, 4: 64.
[16]LEE E J, GUSEV Y, JIANG J, et al. Expression profiling identifies microRNA signature in pancreatic cancer [J]. Int J Cancer, 2007, 120(5): 1046-1054.
[17]HE H, JAZDZEWSKI K, LI W, et al. The role of microRNA genes in papillary thyroid carcinoma[J]. Proc Natl Acad Sci U S A, 2005, 102(52): 19075-19080.
[18]CIAFRE S A, GALARDI S, MANGIOLA A, et al. Extensive modulation of a set of microRNAs in primary glioblastoma[J]. Biochem Biophys Res Commun, 2005, 334(4): 1351-1358.
[19]LE SAGE C, NAGEL R, EGAN D A, et al. Regulation of the p27(Kip1) tumor suppressor by miR-221 and miR-222 promotes cancer cell proliferation[J]. EMBO J, 2007, 26(15): 3699-3708.
[20]MILLER T, EGHOSHAL K, RAMASWAMY B, et al. MicroRNA-221/222 confers tamoxifen resistance in breast cancer by targeting p27Kip1 [J]. J Biol Chem, 2008, 283(44): 29897-29903.
[21]GALARDI S, MERCATELLI N, GIORDA E, et al. miR-221 and miR-222 expression affects the proliferation potential of human prostate carcinoma cell lines by targeting p27Kip1[J]. J Biol Chem, 2007, 282(32): 23716-23724.
[22]VISONE R, RUSSO L, PALLANTE P, et al. MicroRNAs (miR)-221 and miR-222, both overexpressed in human thyroid papillary carcinomas, regulate p27Kip1 protein levels and cell cycle [J]. Endocr Relat Cancer, 2007, 14(3): 791-798.
[23]TEIXEIRA A L, FERREIRA M, SILVA J, et al. Higher circulating expression levels of miR-221 associated with poor overall survival in renal cell carcinoma patients [J]. Tumour Biol, 2013, 31. [Epub ahead of print]
[24]NASSIRPOUR R, MEHTA P P, BAXI S M, et al. miR-221 promotes tumorigenesis in human triple negative breast cancer cells [J]. PLoS One, 2013, 8(4): e62170.
[25]GIMENES-TEIXEIRAH L, LUCENA-ARAUJO A R, DOS SANTOS G A, et al. Increased expression of miR-221 is associated with shorter overall survival in T-cell acute lymphoid leukemia [J]. Exp Hematol Oncol, 2013, 2(1): 10.
The expression and clinical signi fi cance of miR-221 in plasma of patients with small cell lung cancer
FENG Li-ping, LUO Liang, SU Wen-mei (the Third Branch of Cancer Center, the Af fi liated Hospital of Guangdong Medical College, Zhanjiang Guangdong 524000, China)
FENG Li-ping E-mail: 6985626@qq.com
Background and purpose:MicroRNAs (miRNAs, miR) are directly involved in cancer initiation, progression and metastasis. Alterations of miRNAs expression in cancer tissue may be reflected in circulation. We attempted to investigate the expression and clinical signi fi cance of plasma miR-221 in patients with small cell lung cancer (SCLC). The plasma and tissues levels of miR-221 in 51 SCLC patients and 20 controls were evaluated and compared among various clinicopathological characteristics.Methods:Confirmation of higher miR-221 levels in primary SCLC tissues than normal lung tissues. Evaluation of plasma miR-221 concentrations by comparing results from 51 consecutive SCLC patients and 20 healthy volunteers. Evaluation of the assay for monitoring tumour dynamics in SCLC patients.Results:Expression of miR-221 was signi fi cantly higher in SCLC tissues than in para-carcinoma tissues and normal lung tissues. Plasma miR-221 concentrations were signi fi cantly higher in SCLC patients than those in normal people (P<0.05). The expression of plasma miR-221 was not associated with gender, and age (P>0.05), correlated with significantly chemosensitivity, overall survival and clinical stage (P<0.05). Cox regression analysis indicated that plasma miR-221 expression and disease stage were found to be significantly independent prognostic factors for the SCLC patients.Conclusion:Plasma miR-221 could be a useful biomarker for cancer detection, monitoring tumour dynamics and predicting malignant outcomes in SCLC patients, and may contribute to clinical decision making in treatments.
Small cell lung cancer; QRT-PCR; Circulating miR-221
10.3969/j.issn.1007-3969.2014.03.011
R734.2
A
1007-3639(2014)03-0217-08
2013-10-30
2014-02-10)
冯丽萍 E-mail:6985626@qq.com

