MTHFR C677T基因多态性与晚期非小细胞肺癌化疗不良反应的关系
寇军燕 洪卫 洪丹 苏丹 娄广媛 张沂平
1.杭州市肿瘤医院肿瘤综合科,浙江 杭州 310002;2.浙江省肿瘤医院化疗中心十六病区,浙江 杭州 310002;3.浙江省肿瘤医院研究所,浙江 杭州 310022
MTHFR C677T基因多态性与晚期非小细胞肺癌化疗不良反应的关系
寇军燕1 洪卫2 洪丹2 苏丹3 娄广媛2 张沂平2
1.杭州市肿瘤医院肿瘤综合科,浙江 杭州 310002;2.浙江省肿瘤医院化疗中心十六病区,浙江 杭州 310002;3.浙江省肿瘤医院研究所,浙江 杭州 310022
背景与目的:亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)是叶酸代谢的关键酶,在DNA甲基化中起重要作用。本研究旨在探讨MTHFR C677T多态性与晚期非小细胞肺癌(nonsmall cell lung cancer,NSCLC)化疗不良反应的关系。方法:收集2007年6月—2009年5月在浙江省肿瘤医院经病理学确诊的晚期NSCLC患者100例。所有患者均接受铂类药物联合吉西他滨的方案化疗。用等位基因特异-PCR技术检测患者MTHFR基因型。结果:100例晚期NSCLC患者中,MTHFR C677T T/T、T/C和C/C基因型频率分别为20%、44%和36%。在血液学不良反应中,C/C基因型血小板减少发生率较T/T、T/C基因型低,差异有统计学意义(P=0.039)。本研究未发现MTHFR各基因型与化疗后恶心、呕吐不良反应相关。结论:MTHFR C677T基因多态性对预测晚期NSCLC含铂类药物方案化疗后不良反应有临床意义。
亚甲基四氢叶酸还原酶;非小细胞肺癌;化疗;铂类;不良反应
化疗是治疗肺癌的主要方法,尤其是对晚期非小细胞肺癌(non-small cell lung cancer,NSCLC),目前其标准化疗方案是以铂类药物为基础加第3代新药的联合化疗。但同样方案、同样剂量强度的药物给予不同患者,其疗效和不良反应差异很大,因此,寻找可靠的预测标记,指导个体化治疗,对于提高临床用药的有效性和安全性具有重要的意义。
亚甲基四氢叶酸还原酶(m e t h y l e n e tetrahydrofolate reductase, MTHFR)是叶酸代谢过程中的关键酶,其基因有多种突变类型,最常见的是C677T点突变(丙氨酸→缬氨酸)。MTHFR活性的高低将影响基因组DNA的甲基化。体外研究已经证明一些基因(如细胞周期关卡基因、DNA修复基因等)的异常甲基化可以影响细胞毒性药物和干扰DNA合成药物的敏感性及不良反应[1-4]。本研究以浙江省肿瘤医院100例晚期NSCLC接受以铂类药物为基础联合吉西他滨方案化疗患者为研究对象,分析MTHFR C677T多态性与晚期NSCLC化疗后不良反应的关系。
1 资料和方法
1.1 患者资料
2007年6月—2009年5月,在浙江省肿瘤医院化疗科入组经病理学或细胞学证实的ⅢB期或Ⅳ期晚期NSCLC患者105例(剔除接受维持化疗或接受靶向药物维持治疗5例,纳入分析100例)。其中男性70例,女性30例;年龄25~71岁,中位年龄56岁;患者均为汉族。临床肿瘤分期采用2009年UICC分期。所有患者经CT证实有可测量或可评估的病灶,最大径>1.5 cm;既往无化疗史,允许先行放疗,观察病灶必须在放射野外;化疗前PS评分≤2,心脏功能、肝肾功能、血常规正常;预计生存≥12周;能随访,依从性好(表1)。
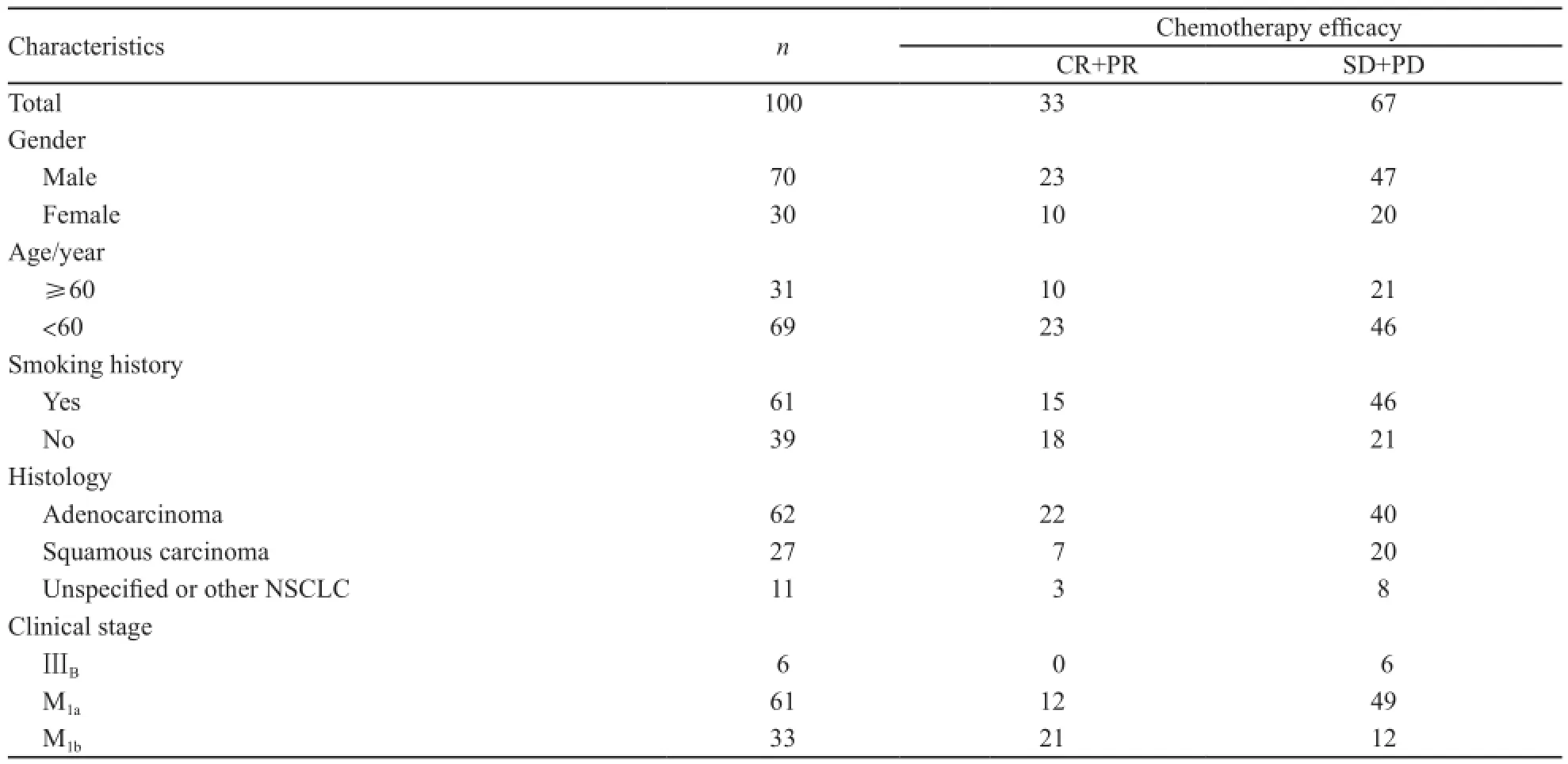
表1 NSCLC患者的基本情况、化疗方案及疗效Tab. 1 Clinical characteristics, chemotherapy regimens and ef fi cacy of 100 patients with non-small cell lung cancer
1.2 样本收集
所有患者化疗前清晨空腹抽静脉2 mL,置乙二胺四乙酸钠抗凝管,分离白细胞层,置-74 ℃低温冰箱保存备用。
1.3 基因型分析
采用由美国ZYMO RESEARCH公司生产的D3025 ZR Genomic DNAⅡ KitTM试剂盒,按照说明书步骤从肺癌全血标本中提取高相对分子质量DNA。单核苷酸多态性检测采用Taqman探针基因分型技术,在ABI 7500适时定量PCR扩增仪上完成(Applied Biosystems Inc.,Foster City,CA)。探针、引物和Taqman通用PCR混合液均购于美国ABI公司。PCR总反应体系为5 μL,混合有0.25 μL的引物和探针,2.5 μLPCR反应液和5 ng DNA。PCR反应条件如下:预变性95 ℃,10 min;92 ℃变性15 s,60 ℃延伸1 min,40个循环。每块板上加2个无DNA空白标本作为阴性对照。7500扩增仪附带的随机软件SDS等位基因分型软件分析结果。MTHFR C677T基因型分为野生型纯合子(C/C)、杂合子(T/C)、变异性纯合子(T/T)3种类型。
1.4 治疗方案
所有患者均接受吉西他滨为基础的联合方案化疗,其中联合顺铂(cisplatin,DDP)治疗者68例(GP组),联合卡铂(carboplatin,CBP)治疗者32例(GC组)。化疗方案为铂类药物加吉西他滨(gemcitabine,GEM)1 000 mg/m2静脉滴注,第1、8天。铂类药物:DDP 75 mg/m2第1~3天或卡铂AUC=5第1天,均为静脉给药。以上方案均每3周为1个周期,所有患者均在化疗2个周期后评定疗效。
1.5 疗效评定标准
疗效评定采用RECIST标准分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。疗效评价有效为CR+PR。化疗后不良反应按照药物评定标准NCI-CTC 3.0评价(包括血液学、消化道不良反应)。
1.6 统计学处理
不同基因型与消化道反应、血液学毒性的比较均采用方差分析,生存研究比较采用Kaplan-Meier法Log-rank检验,应用SPSS 16.0软件包进行统计学处理。P<0.05为差异有统计学意义。
2 结 果
2.1 MTHFR C677T基因型分布
在100例晚期NSCLC患者中,20例携带T/ T基因型,44例携带T/C基因型,36例携带C/C基因型。Hardy-Weinberg平衡检测结果显示,MTHFR C677T基因型分布符合Hardy-Weinberg平衡定律,表明入组患者具有群体代表性。
2.2 MTHFR C677T基因型与临床疗效
患者均进入疾病进展,截止随访时,28例仍存活。无进展生存时间1.5~18.0个月,中位5.0个月,平均5.7个月。总生存时间2.0~33.0个月,中位10.0个月,平均11.4个月。100例患者中,疗效评价有效33例,SD 55例,PD 12例,有效率33%,其中CR 3例。化疗有效组33例患者中,T/T型4例(12.1%),T/C型13例(39.4%),C/C型16例(48.5%),差异均无统计学意义。
2.3 MTHFR C677T基因型与生存期的关系
MTHFR C677T不同基因型患者无进展生存期差异无统计学意义(P=0.194)。其中,T/C型患者较其他基因型患者化疗后无进展生存时间更长,其他两种基因型合并后与T/C型比较,差异有统计学意义(P=0.043,图1),虽然总生存差异无统计学意义(P=0.075,图2),但是值得进一步随访观察。
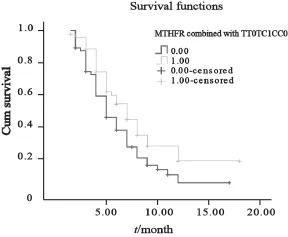
图1 合并后无进展生存期的生存曲线Fig. 1 Survival curves after merger PFS

图2 合并后总生存期的生存曲线Fig. 2 Survival curves after merger OS
2.4 MTHFR C677T基因型与恶心、呕吐反应的关系
在100例患者中,0度恶心、呕吐反应为58例,1~2度为23例,3度及以上为19例。初步分析,GP组有恶心、呕吐反应较大的倾向,但差异无统计学意义(P>0.05)。由于GC组样本较小,故仅对GP组68例患者进行分析。MTHFR C/C、T/C和T/T型与化疗恶心、呕吐反应之间差异无统计学意义(P=0.773,表2)。
2.5 MTHFR C677T基因型与血液学不良反应的关系
初步分析,GP组外周血中性粒细胞和血小板减少的发生率更低。由于GC组患者数较少,同样仅对GP组68例患者进行分析。其中某些亚型样本数较少,进行适当合并。各基因型与贫血之间相关性差异无统计学意义(P=0.658,表3),与中性粒细胞减少相关性差异亦无统计学意义(P=0.446,表4);观察发生血小板减少的比例,C/C型患者显著高于T/C和T/T型患者,差异有统计学意义(P=0.039,表5)。

表2 不同基因型与恶心、呕吐反应的关系Tab. 2 Relationship between MTHFR genotypes and nausea/vomiting

表3 不同基因型与贫血的关系Tab. 3 Relationship between MTHFR genotypes and Anemia
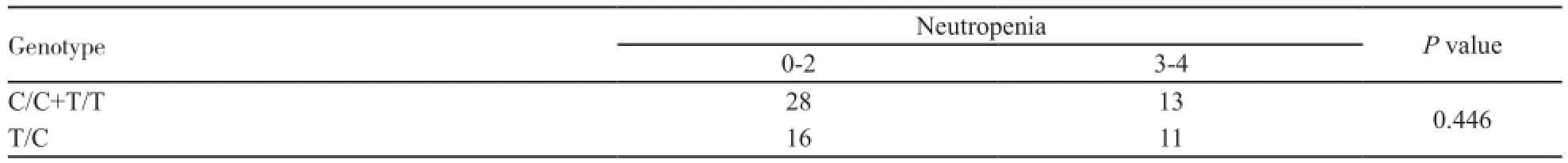
表4 不同基因型与中性粒细胞减少的关系Tab. 4 Relationship between MTHFR genotypes and of neutropenia
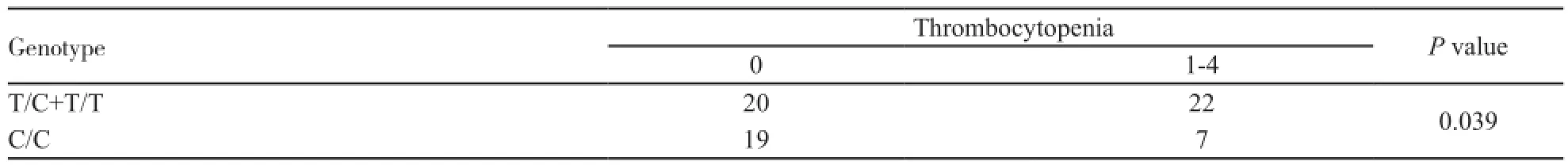
表5 不同基因型与血小板减少的关系Tab. 5 Relationship between MTHFR genotypes and thrombocytopenia
3 讨 论
MTHFR在体内有重要的生物学作用,是机体一碳单位代谢关键酶,也是甲硫氨酸代谢中的关键酶,可催化还原型辅酶Ⅱ相关的5,10-亚甲基四氢叶酸转化为5-甲基四氢叶酸。后者作为一碳单位的供体参与同型半胱氨酸甲基化生成甲硫氨酸。甲硫氨酸活化S-腺苷甲硫氨酸并作为甲基的供体参与许多代谢反应。现已发现MTHFR基因有多种突变类型,不同的基因突变类型对MTHFR的酶活性和热稳定性产生不同的影响,表现出各种不同的酶活性和热稳定性,提示MTHFR基因具有复杂的遗传异质性。MTHFR的基因型、酶活性和表型之间有密切的联系。一般涉及进化保守序列的突变会引起酶活性的急剧下降,危害性较大;相反,处于非保守序列的突变对酶的活性影响较小,危害性也较小。酶活性降低幅度越大,相应的生化表现和临床症状出现越早,程度越严重[5]。C677T点突变是MTHFR最常见的突变类型,已有的研究表明MTHFR 677C→T在不同国家、同一国家不同地区、同一地区不同民族或种族中的分布差异有统计学意义[6-7]。欧洲人677T等位基因频率为22%~44%,在亚洲人中,日本人677T等位基因频率为34%,中国汉族人为40%,因而认为亚洲人MTHFR基因677C→T突变频率偏高。
目前关于MTHFR基因多态性与肺癌之间的关系研究较少,结论不一。Jeng等[8]在台湾地区进行的研究(59例患者和232名对照)未显示MTHFR C677T基因多态性与肺癌发生相关。Siemianowicz等[9]的研究得出了不同的结论。他们检测了146例肺癌患者和44名对照,结果发现MTHFR C677T基因中,TT型的表达在小细胞肺癌中为22.9%,在NSCLC中为36.0%,均高于对照组的13.6%;在小细胞肺癌和NSCLC两组之间基因型的表达无明显差异。西班牙学者Alberola等[10]以晚期NSCLC为对象研究了MTHFR C677T基因多态性与DDP/ GEM方案化疗效果的关系,未发现MTHFR基因C677T多态性与NSCLC化疗效果之间有显著关联,但是C/C基因型比T/C及T/T基因型呈现出TTP延长的倾向。本研究发现化疗有效的33例患者中,MTHFR C677T C/C型与化疗近期有效率高相关,而无进展生存期,T/C型较其他基因型患者更长,且总生存期差异有统计学意义,值得进一步随访观察。
本研究主要化疗方案为铂类联合吉西他滨,其中,铂类药物的作用机制主要是与DNA上的鸟嘌呤、腺嘌呤和胞嘧啶结合形成Pt-DNA加合物,导致DNA的链间交联或链内交联,引起DNA复制障碍,从而抑制瘤细胞分裂[11]。但是,不同个体对铂类药物敏感性有很大差异,不良反应也不相同。而吉西他滨作为一种抗代谢药物,在进入细胞后经过代谢转化为二氟脱氧胞嘧啶核苷酸发挥干扰DNA合成的作用,但它在脱氨酶的作用下也可转化为二氟脱氧尿嘧啶核苷酸,抑制胸苷酸合成酶,发挥类似于5-氟尿嘧啶的抗癌作用[12]。高长明等[13]在观察MTHFR基因多态性与胃癌化疗不良反应中发现,T/T基因型患者的恶心呕吐反应显著高于C/C,T/C基因型患者(P=0.002)。Toffoli等[14]在采用CMF方案进行乳腺癌的辅助化疗中发现,T/T表型者表现出明显高的骨髓不良反应。在本实验中,虽未发现MTHFR C677T各基因型与呕吐反应相关。但是在血液学不良反应上,MTHFR C677T基因C/C型血小板减少发生率明显低于T/T,T/C基因型(P=0.039)。
总之,本研究初步结果表明,MTHFR C677T基因多态性与晚期NSCLC含铂类药物的化疗近期疗效及不良反应有关,值得进一步扩大患者数进行验证。由于本研究不需要检测癌组织中的MTHFR基因,而是直接抽取患者外周血,提取白细胞DNA,检测患者血中的MTHFR基因型,方法简便,对于不能手术取得癌组织的患者,尤其是晚期癌症患者具有较高的临床价值。
[1]SATOH A, TOYOTA M, ITOH F, et al. Epigenetic inactivation of CHFR and sensitivity to microtubule inhibitors in gastric cancer [J]. Cancer Res, 2003, 63(24): 8606-8613.
[2]TANIGUCHI T, TISCHKOWITZ M, AMEZIANE N, et al. Disruption of the Fanconi anemia-BRCA pathway in cisplatin-sensitive ovarian tumors [J]. Nat Med, 2003, 9(5): 568-574.
[3]NARAYAN G, ARIAS-PULIDO H, NANDULA S V, et al. Promoter hypermethylation of FANCF: disruption of Fanconi Anemia-BRCA pathway in cervical cancer [J]. Cancer Res, 2004, 64(9): 2994-2997.
[4]ROTHFUSS A, GROMPE M. Repair kinetics of genomic interstrand DNA cross-links: evidence for DNA double-strand break-dependent activation of the Fanconi anemia/BRCA pathway [J]. Mol Cell Biol, 2004, 24(1): 123-134.
[5]GOYETTE P, FROSST P, ROSENBLATT D S, et al. Seven novel mutations in the methylenetetrahydrofolate reductase gene and genotype/phenotype correlations in severe methylenetetrahydrofolate reductase deficiency [J]. Am J Hum Genet, 1995, 56(5): 1052-1059.
[6]SCHNEIDER J A, RESS D C, LIU Y T, et al. Worldwide distribution of a common methylenetetrahydrofolate reductasemutation [J]. Am J Hum Genet, 1988, 62(5): 1258-1260.
[7]于佳梅, 王新春, 陈白滨, 等. 中国5个民族亚甲基四氢叶酸还原酶基因多态性的研究[J]. 人类学报, 1998, 17(3): 242-245.
[8]JENG Y L, WU M H, HUANG H B, et al. The methylenetetrahydrofolate reductase 677C→T polymorphism and lung cancer risk in a Chinese population [J]. Anticancer Res, 2003, 23(6): 5149-5152.
[9]SIEMIANOWICZ K, GMINSKI J, GARCZORZ W, et al. Methylenetetrahydrofolate reductase gene C677T and A1298C polymorphisms in patients with small cell and non-small cell lung cancer[J]. Oncol Rep, 2003, 10(5): 1341-1344.
[10]ALBEROLA V, SARRIES C, ROSELL R, et al. Effect of the methylenetetrahydrofolate reductase C677T polymorphism on patients with cisplatin/gemcitabine-treated stage Ⅳ nonsmall cell lung cancer [J]. Clin Lung Cancer, 2004, 5(6): 360-365.
[11]钱礼. 肿瘤学基础与临床[M]. 北京: 中国医药科技出版社, 1994: 322.
[12]BARTON-BURKE M. Gemcitabine: a pharmacologic and clinical overview [J]. Cancer Nurs, 1999, 22(2): 176-183.
[13]高长明, 陆建伟, Takezaki Toshiro, 等. 亚甲基四氢叶酸还原酶基因多态性与胃癌化疗的敏感性关系的研究[J].中华流行病学杂志, 2004, 25(12): 1054-1058.
[14]TOFFOLI G, VERONESI A, BOIOCCHI M, et al. MTHFR gene polymorphism and severe toxicity during adjuvant treatment of early breast cancer with cyclophosphamide, methotrexate, and fluorouracil (CMF) [J]. Ann Oncol, 2000, 11(3): 373-374.
Relationship between MTHFR C677T gene polymorphisms and chemotherapy side effects in advanced non-small cell lung cancer
KOU Jun-yan1, HONG Wei2, HONG Dan2, SU Dan3, LOU Guangyuan2, ZHANG Yi-ping2(1.Department of Synthetical Oncology, Hangzhou Cancer Hospital, Hangzhou Zhejiang 310002, China; 2.Department of Chemotherapy, Zhejiang Cancer Hospital, Hangzhou Zhejiang 310002, China; 3.Cancer Research Institution, Zhejiang Cancer Hospital, Hangzhou Zhejiang 310022, China)
ZHANG Yi-ping E-mail: zyp@medmail.com.cn
Background and purpose:Methylene tetrahydrofolate reductase (MTHFR) plays an important role in metabolism of folate and DNA methylation. This study aimed to investigate the relationship between methylene tetrahydrofolate reductase (MTHFR) C677T polymorphism and chemotherapy side effects in advanced non-small cell lung cancer (NSCLC) patients.Methods:A total of 100 patients with advanced NSCLC con fi rmed by pathology were included into this study in Zhejiang Cancer Hospital from Jun. 2007 to May. 2009. All patients received the combined chemotherapy of platinum drug and gemcitabine. MTHFR genotypes were determined by allele-specific-PCR technology.Results:In the 100 cases, genotype frequency of MTHFR C677T T/T, T/C and C/C were 20%, 44% and 36%, respectively. Compared with patients of T/T and T/C genotype, patients of C/C genotype were correlated with decreased rate of thrombocytopenia to chemotherapy (P=0.039). No signi fi cant differences were observed concerning gastrointestinal toxicity.Conclusion:MTHFR C677T gene polymorphism can be used to predict the adverse reactions to platinum-based chemotherapy in patients with advanced NSCLC.
Methylenetetrahydrofolate reductase; Non-small cell lung cancer; Chemotherapy; Platinum; Side effect
10.3969/j.issn.1007-3969.2014.03.007
R734.2
A
1007-3639(2014)03-0197-06
2014-01-12
2014-02-28)
浙江省医药卫生科学研究基金计划项目(No:2007B025)。
张沂平 E-mail:zyp@medmail.com.cn

