脱落酸处理对赤霞珠和烟73葡萄果皮花色苷组分的影响
栾丽英,张振文,2,惠竹梅,2,*,房玉林,2,霍珊珊
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
脱落酸处理对赤霞珠和烟73葡萄果皮花色苷组分的影响
栾丽英1,张振文1,2,惠竹梅1,2,*,房玉林1,2,霍珊珊1
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
目的:比较赤霞珠和烟73葡萄果皮花色苷组分的差异,以及脱落酸(abscisic acid,ABA)处理提高果实着色前提下,对两个品种果皮花色苷组分的影响。方法:以烟73和赤霞珠为试材,在着色前期用200 mg/L ABA处理果穗,对照用清水代替激素。成熟采收后,提取果皮中花色苷,利用高效液相色谱-质谱联用方法,对花色苷组分进行定性和定量检测,然后进行比较分析。结果:对照中共检测到16 种花色苷,其中烟73果皮花色苷组分检测到15 种,含量为8 400.9 mg/kg,赤霞珠检测到12 种,含量为1 131.9 mg/kg。ABA处理显著提高了两品种果皮花色苷总量:烟73提高至10 380.2 mg/kg,赤霞珠提高至1 470.2 mg/kg。花色苷各大类总量也在不同程度得到提高。结论:烟73和赤霞珠两个不同葡萄品种间花色苷种类和含量存在显著差异。ABA处理显著提高了两品种果皮花色苷总量,并且不同种类花色苷含量均在不同程度得到提高,从而促进果实着色。
脱落酸;烟73;赤霞珠;花色苷;葡萄
花色素苷是一种水溶性黄酮类色素,是红色、紫色和蓝色果面色泽的主要构成物,在特定条件下呈现黑色[1]。葡萄果皮花色苷不但含量高,而且种类多,葡萄花色苷作为一种天然食用色素,安全、无毒,且具有降低肝脏及血清中脂肪含量、抗氧化、防止动脉硬化、抗变异、抗肿瘤、抗过敏、保护胃黏膜、延迟血小板凝集等多种生理和药用活性功能[2-4]。葡萄果实的颜色对酿酒和鲜食品种都有作用,果实着色好坏是影响其价格和市场竞争
力的重要因素,也是衡量果实品质的重要指标[5]。葡萄果实中的花色素苷在发酵过程进入到葡萄酒中,使葡萄酒呈现鲜亮的色泽,颜色作为葡萄酒的第一感官品质,在很大程度上影响着消费者的选择心理和对 其他感官品质的评价,并且花色苷对葡萄酒的质量和营养价值的作用更大[6-8]。果实的着色 过程不仅受植物本身的遗传因素调控,也受外部因素,如光照、温度、植物生长调节剂等的影响[1,9]。目前很多研究指出,脱落酸(abscisic acid,ABA)能显著促进各种葡萄品种果实成熟和花色苷合成,提高果实含糖量以及花色苷总量[10-18],但是鲜有研究具体指出ABA处理对葡萄中花色苷单体物质的种类和含量等方面的影响。
本研究中选用了被广泛栽培的酿酒品种赤霞珠和中国自主选育的红色染色品种烟73,研究这两个不同品种果皮花色苷物质组分的区别,以及ABA处理对两品种果皮花色苷物质种类和含量的影响。旨在讨论品种对花色苷组分的影响,以及外源激素ABA对两个品种果皮花色苷物质的组分和含量的影响,也为进一步研究ABA调控花色苷合成机理提供一定理论参考。
1 材料与方法
1.1 材料与试剂
实验在陕西省咸阳市泾阳县白王镇酿酒葡萄基地进行,供试品种为欧亚种酿酒葡萄赤霞珠(Cabernet Sauvignon)和我国自主选育的染色品种烟73,2006年定植,南北行向,株行距为0.8 m×2.5 m,单干双臂整形,选择树势中庸、挂果一致的植株,采用正常的田间管理。
500 mg(+)-ABA 美国Sanland公司;甲醇、甲酸、乙腈、乙酸(均为色谱纯) 美国Fisher公司;二甲花翠素-3-O-葡萄糖苷标样 法国Extrasynthese SA公司。
1.2 仪器与设备
UV-1800型紫外-可见光分光光度计 日本岛津公司;5804R低温冷冻离心机 德国Eppendorf公司;1100高效液相色谱-质谱仪 美国Agilent公司。
1.3 方法
1.3.1 材料处理
选用植物生长调节剂200 mg/L ABA,以清水代替植物激素为对照(CK)。植物激素(或清水)用98%的乙醇溶解后稀释到适宜质量浓度,乙醇最终含量为0.1%(体积分数),用吐温-80作为展开剂,最终含量为0.1%(体积分数)。其中ABA处理质量浓度是根据本课题组之前实验研究结果[18]选定,该质量浓度使果实总花色苷显著提高。选取生长发育长势一致的植株和果穗,每棵植株从不同方位选15~20穗长势一致的果穗挂牌,转色前期(2011年7月2日)分别对赤霞珠和烟73进行喷施处理,激素溶液在挂牌果穗上均匀喷施,直至滴水为止。设3 个重复,每个重复10 株葡萄。
1.3.2 葡萄样品的采集
于2011年7月2日处理前,采集各处理区样品。以后约7 d采样一次,测定葡萄的糖、酸,以及总花色苷,直至果实采收,赤霞珠葡萄采收期为8月31日;烟73葡萄采收期为8月16日。样品采集时间为早晨8:00—10:00。采样时各处理小区分别采样,每个重复选一棵植株,从上中下不同方位采3~4 穗,共采9~10 穗,采后立即放入冰盒,带回实验室后,将每个重复的果穗剪成果粒并混合均匀。
1.3.3 葡萄果皮花色苷的提取
用镊子将葡萄果皮剥离,然后准确称取0.5 g的葡萄果皮加入10 mL含2%甲酸-甲醇溶液,避光超声提取10 min,然后在25 ℃的摇床中避光提取30 min,再以8 000 r/min转速4 ℃条件下离心8 min,将上清液收集于100 mL圆底烧瓶中(避光),以上步骤重复4 次,将合并的上清液避光30 ℃条件下旋转蒸干,残渣用流动相(V(流动相A)∶V(流动相B)=9∶1)转移出来,定容至10 mL,-40 ℃条件下避光保存备用,样品进样前用0.45 μm虑膜过滤[19]。
1.3.4 花色苷组分的定性、定量分析
样品的检测工作在中国农业大学食品科学和营养工程学院葡萄与葡萄酒研究中心进行,定性工作是在该研究中心建立的“葡萄与葡萄酒花色苷HPLC-UV-MS-MS指纹普库”的基础上,结合保留时间和文献资料对样品中的花色苷物质进行定性;定量方法是作二甲花翠素葡萄糖苷的标准曲线,并以其为外标物进行定量计算,所有检测出的花色苷类物质均以二甲花翠素葡萄糖苷的含量计[20],高效液相色谱-质谱分析条件参考He Jianguo[21]、程国利[22]等的研究。
高效液相色谱-质谱条件:样品经过0.45 μm膜过滤后直接进入Agilent 1100高效液相色谱-质谱分析,每样品重复3 次。色谱柱:Kromasil 100-5C18(250 mm×4.6 mm,5 μm);流动相A相:水-甲酸-乙腈(92∶2∶6,V/V);B相:水-甲酸-乙腈(44∶2∶54,V/V)。检测波长:525 nm;样品进样量:30 μL;流速:1.0 mL/min;柱温:50 ℃。洗脱程序:0~4 min,6%~10% B;4~12 min,10%~25% B;12~13 min,25% B;13~20 min,25%~40% B;20~35 min,40%~60% B;35~40 min,60%~100% B;40~45 min,100%~6% B。质谱采用电喷雾离子源,负离子模式,离子扫描范围:200~1500 m/z;雾化气压力:35 psi;干燥气流速:10 L/min;干燥气温度:350 ℃;Trap ICC:30 000 u;碰撞电压1.00 V。
1.4 数据处理
实验数据采用SPSS数据处理软件和Excel进行处理,差异显著性分析采用Duncan新复极差法。
2 结果与分析
2.1 赤霞珠和烟73果皮花色苷比较
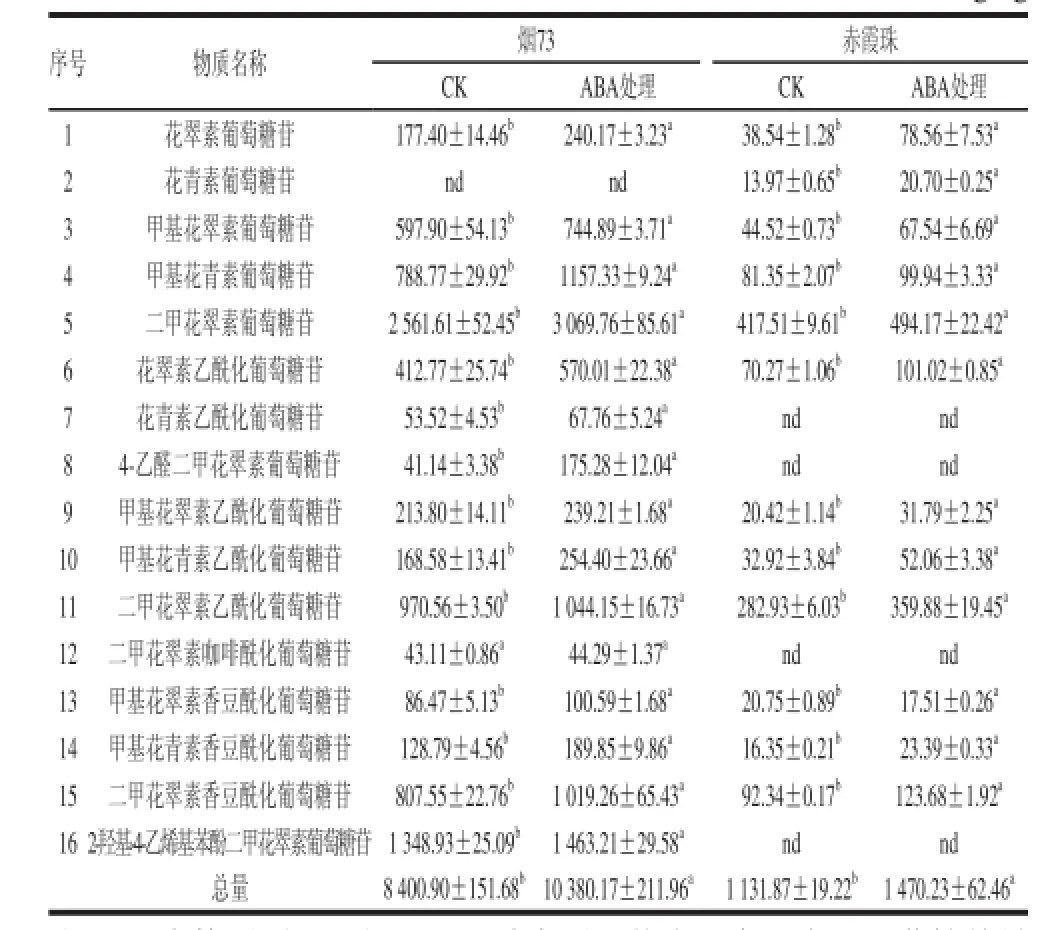
表1 ABA处理对烟73和赤霞珠果皮花色苷组分含量的影响Table 1 Effect of ABA treatment on anthocyanin contents of grape skins from Yan 73 and Cabernet Sauvignonmg/kg
花色苷是红葡萄酒中极为重要的组分之一,它的组成特征与葡萄品种也有很大的关系。实验中通过对赤霞珠和烟73葡萄果皮中花色苷的高效液相色谱-质谱联用分析,共检测到16 种花色苷,结果见表1。其中,赤霞珠果皮中检测到12 种花色苷(未检测到花青素乙酰化葡萄糖苷、4-乙醛二甲花翠素葡萄糖苷、二甲花翠素咖啡酰化葡萄糖苷和2-羟基-4-乙烯基苯酚二甲花翠素葡萄糖苷4 种),含量为1 131.9 mg/kg,烟73检测到15 种花色苷,含量为8 400.9 mg/kg,也证实品种对花色苷组分和含量有极其显著的影响。烟73是我国自主选育的染色品种,由检测结果也可以看出,其果皮中花色苷含量是赤霞珠果皮中的7.4 倍,并且由表1可以看出,两个品种检测到的花色苷组分含量都有几倍甚至10 倍以上的差异,因此在葡萄酒生产中烟73常作为染色品种对其他葡萄酒进行调色[23]。
通过对两个葡萄品种测定结果比较得到(图1),赤霞珠和烟73果皮花色苷均含有二甲花翠素类(malvidin derivatives,Mv)、花翠素类(delphinidin derivatives,Dp)、甲基花翠素类(petunidin derivatives,Pt)、花青素类(cyanidin derivatives,Cy)和甲基花青素类(peonidin derivatives,Pn)5大类,其中所占比例最高的均为Mv,达到70%左右,其次是Pn,所占比例最少的是Cy,仅占1%左右。可见Mv是赤霞珠和烟73葡萄中的主要花色苷聚集类型。并且在其他葡萄品种中Mv的比例也占有绝对优势,如西拉和黑比诺等,也说明这些品种参与此花色苷类生物合成的甲基转移酶活性都很强[24]。果实在成熟过程中,Cy和Dp两大类花色苷可以被转化成其他更稳定的形式[25],因此,这两大类花色苷所占比例一般比较低。
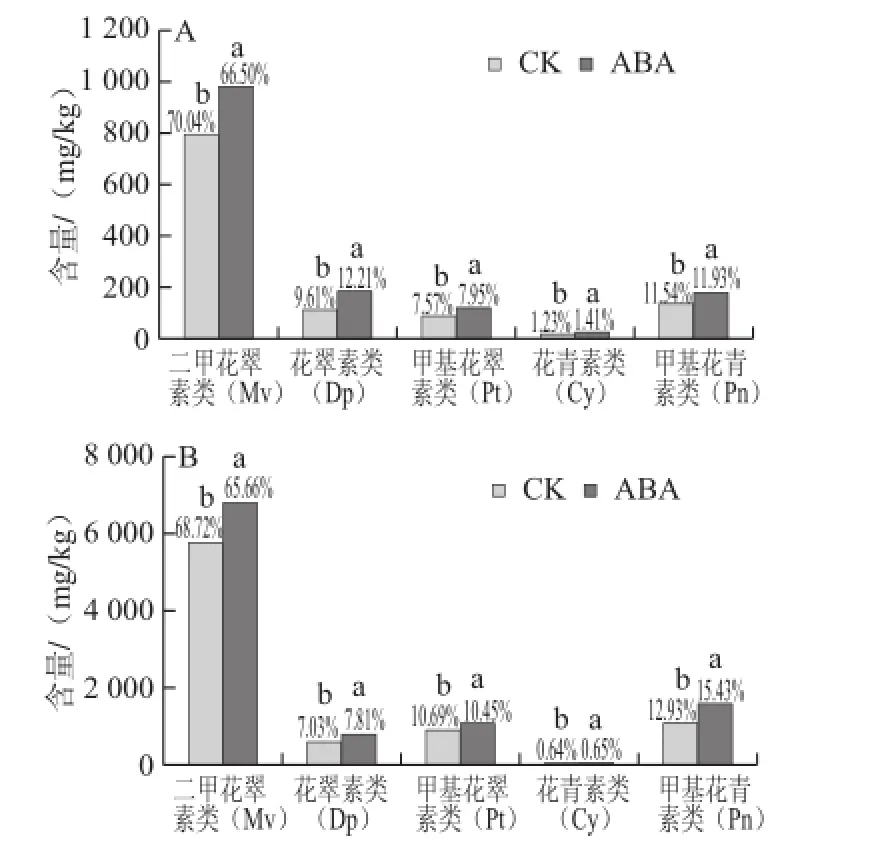
图1 ABA处理对赤霞珠(A)和烟73(B)果皮5 大类花色苷含量的影响Fig.1 Effect of ABA treatment on the contents of five categories of anthocyanins in grape skins from Cabernet Sauvignon and Yan 73
根据花色苷的合成过程,可将葡萄果实中的花色苷分为两种类型,分别为3’-取代花色苷和3’5’-取代花色苷:3’-取代花色苷的B环上3’-位被羟基或甲氧基取代,而5’-位没有羟基或甲氧基取代;3’5’-取代花色苷的B环上3’和5’-位均被羟基或甲氧基取代。本研究中3’-取代花色苷包括花青素衍生物花色苷Cy和Pn两大类,3’5’-取代花色苷包括花翠素衍生物花色苷Dp、Pt和Mv三大类。赤霞珠和烟73两个品种果皮中3’-取代花色苷(Cy+Pn)占花色苷总量比例分别为12.77%和13.57%,烟73果皮中3’-取代花色苷所占比例略高于赤霞珠。并且,赤霞珠和烟73果皮花色苷中,B环甲基修饰的花色苷(Pn+Pt+Mv)所占比例分别为89.16%和92.33%,烟73果皮花色苷的甲基化程度略高于赤霞珠。说明烟73果皮中参与3’-取代花色苷合成和B环甲基修饰的关键酶的基因表达或者酶活性较赤霞珠果皮高。
赤霞珠和烟73两个葡萄果皮中未酰化和酰化形式花色苷的含量和所占比例如图2所示。赤霞珠果
皮中仅含有未酰化、乙酰化和香豆酰化3 类,而烟73果皮中还有咖啡酰化和其他类,共5 类。两个品种中,未酰化类花色苷含量最高(赤霞珠中为52.7%,烟73中为49.1%),这个跟Núñez等[26]在酿酒葡萄如赤霞珠、添帕尼优(Tempranillo)和格拉西亚诺(Graciano)等果皮上得到的结果一致。其次是乙酰化类。因此不同品种之间花色苷组分的酰化方式不同,但是未酰化和乙酰化类的花色苷为主要组成。
2.2 ABA处理对赤霞珠和烟73果皮花色苷组分的影响
由表1可以看出,ABA处理显著提高了两个葡萄品种果皮花色苷的总量,分 别为赤霞珠提高至1 470.2 mg/kg(约1.3 倍),烟73提高至10 380.2 mg/kg(约1.2 倍),并且大部分花色苷组分含量都有不同程度的提高。说明ABA可以显著促进葡萄着色,提高果皮中花色苷的含量,这与周金梅[10]、赵权[11]等的研究结果一致。
如图1所示,ABA处理后5 大类花色素苷的总量都得到显著提高,但是所占比例的变化有所不同,其中Mv在两个品种中所占比例均下降,Cy和Pn在两个品种中所占比例均得到提高。并且,ABA处理使赤霞珠和烟73果皮B环甲基修饰的花色苷( Pn+Pt+Mv)所占比例由对照组89.16%和92.33%,分别降低至86.38%和91.54%,使葡萄果皮花色苷甲基化程度有所降低。同时,ABA处理后3’-取代花色苷(Cy+Pn)所占比例,赤霞珠由12.77%提高至13.34%,烟73由13.57%提高至16.08%;反之3’5’-取代花色苷(Mv+Dp+Pt)在两个品种中所占比例均减少。说明ABA处理对葡萄果皮中3’-取代花色苷合成的关键酶的基因表达或者酶活性的提高幅度大于对3’5’-取代花色苷的提高幅度。另外,ABA处理后Cy和Dp两大类花色苷所占比例有所提高,而这两类花色苷应该转化为其他更稳定的形式存在,说明将Cy和Dp转化为其他稳定花色苷所需酶的活力相对较低[25]。
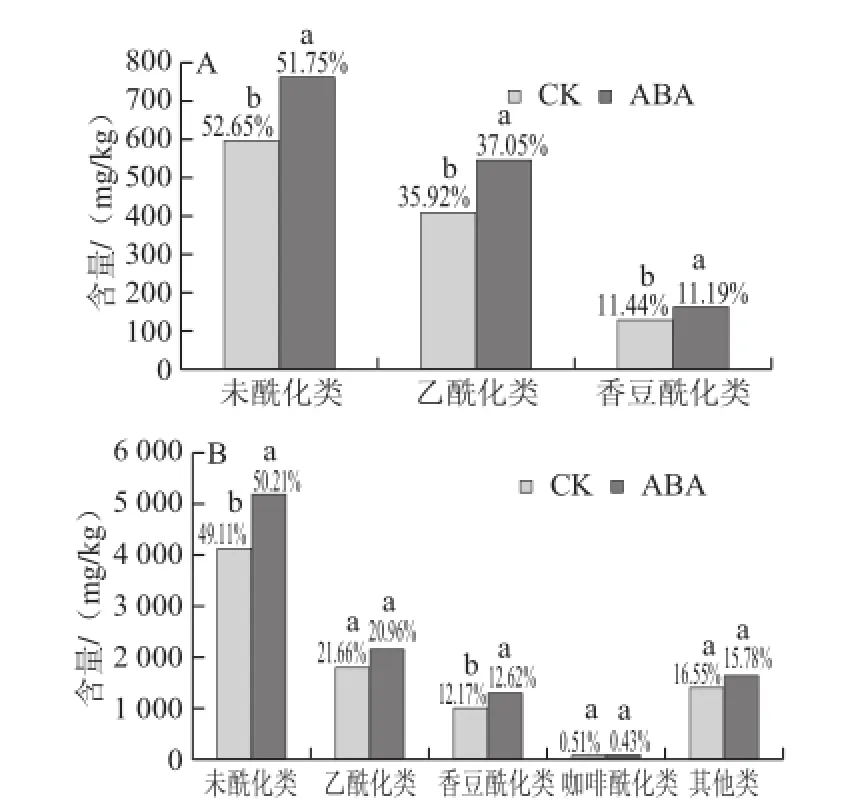
图2 ABA处理对赤霞珠(A)和烟73(B)果皮不同结合形态花色苷含量的影响Fig.2 Effect of ABA on the contents of different anthocyanin derivatives in grape skins from Yan 73 and Cabernet Sauvignon
由图2可以看出,ABA处理后,赤霞珠和烟73果皮不同结合形态花色苷的总量均有不同程度的提高,赤霞珠中3 大类总量均达到显著性提高:未酰化类提高了27.7%(提高165.0 mg/kg),乙酰化提高了34.0%(提高138.2 mg/kg),香豆酰化提高了27%(提高35.1 mg/kg);而烟73五大类中只有未酰化和香豆酰化两大类总量达到显著提高:未酰化提高了26.3%(提高1 086.5 mg/kg),香豆酰化提高了28.0%(提高286.9 mg/kg)。但是处理对几种分类所占比例的改变是不同的,对赤霞珠品种,3 大类中只有乙酰化类所占比例有所提高,由35.9%提高至37.1%;而烟73果皮则是未酰化类和香豆酰化类所占比例有所提高,分别为未酰化类由49.1%提高至50.2%,香豆酰化类由12.2%提高至12.6%。因此ABA处理对不同品种中不同酰化方式的作用效果是不同的。
3 结 论
烟73作为红色染色品种,其果皮中花色苷的总量极显著高于赤霞珠果皮,并且烟73果皮的花色苷物质种类较赤霞珠果皮中多。同时,烟73果皮中3’-取代花色苷和B环甲基化修饰的花色苷所占比例均高于赤霞珠。ABA处理后,两个葡萄品种的花色苷总量均得到显著提高,各种单体花色苷的含量均在不同程度得到提高,对3’-取代花色苷的促进程度大于对3’5’-取代花色苷的促进程度,同时,使赤霞珠和烟73果皮B环甲基修饰的花色苷所占比例均有所降低。而ABA处理对不同品种中不同酰化方式的作用效果是不同的,提高了赤霞珠中乙酰化类所占比例和烟73中未酰化类和香豆酰化类所占比例。
[1] 张上隆, 陈昆松. 果实品质形成与调控的分子生理[M]. 北京: 中国农业出版社, 2007: 150-151.
[2] BOZAN B, TOSUN G, ÖZCAN D. Study of polyphenol content in the seeds of red grape (Vitis vinifera L.) varieties cultivated in Turkey and their antiradical activity[J]. Food Chemistry, 2008, 109(2): 426-430.
[3] KATALINIC V, MILOS M, MODU D, et al. Antioxidant effectiveness of selected wines in comparison with (+)-catechin[J]. Food Chemistry, 2004, 86(4): 593-600.
[4] 唐传核, 彭志英. 天然花色苷类色素的生理功能及应用前景[J]. 冷饮与速冻食品工业, 2000, 6(1): 26-28.
[5] LIANG Z, WU B, FAN P, et al. Anthocyanin composition and content in grape berry skin in Vitis germplasm[J]. Food Chemistry, 2008, 111(4): 837-844.
[6] ZHU Lei, ZHANG Yali, DENG Jiajin, et al. Phenolic concentrations and antioxidant properties of wines made from north american grapes grown in China[J]. Molecules, 2012, 17(3): 3304-3323.
[7] GONZALEZ-MANZANO S, SANTOS-BUELGA C, DUENAS M, et al. Colour implications of self-association processes of wine anthocyanins[J]. European Food Research and Technology, 2007, 226(3): 483-490.
[8] FRITZ J, KERN M, PAHLKE G, et al. Biological activities of malvidin, a red wine anthocyanidin[J]. Molecular Nutrition & Food Research, 2006, 50(4/5): 390-395.
[9] 刘闯萍, 王军. 葡萄花色苷的生物合成[J]. 植物生理学通讯, 2008, 44(2): 363-377.
[10] 周金梅, 刘万全. ABA对“茉莉香”葡萄果实着色及品质的影响研究[J]. 北方园艺, 2011, 35(23): 23-25.
[11] 赵权, 王军. ABA和6-BA对山葡萄果实着色及相关品质的影响[J].江苏农业科学, 2010, 38(2): 189-190.
[12] 于淼, 杨成君, 王军. ABA和乙烯利处理对京优葡萄果皮花色苷和果实品质的影响[J]. 中外葡萄与葡萄酒, 2012, 37(2): 6-11.
[13] CANTIN C, FIDELIBUS M, CRISOSTO C. Application of abscisic acid (ABA) at veraison advanced red color development and maintained postharvest quality of ‘Crimson Seedless’ grapes[J]. Postharvest Biology and Technology, 2007, 46(3): 237-241.
[14] JENOG S T, GOTO-YAMAMOTO N, KOBAYASHI S, et al. Effects of plant hormones and shading on the accumulation of anthocyanins and the expression of anthocyanin biosynthetic genes in grape berry skins[J]. Plant Science, 2004, 167(2): 247-252.
[15] PEPPI M C, FIDELIBUS M W, DOKOOZLIAN N. Abscisic acid application timing and concentration affect firmness, pigmentation, and color of ‘flame seedless’ grapes[J]. HortScience, 2006, 41(6): 1440-1445.
[16] 周良强, 崔永亮, 程祖强, 等. 不同处理措施对巨峰葡萄着色和果实品质的影响[J]. 资源开发与市场, 2013, 29(7): 686-688.
[17] 马立娜, 惠竹梅, 霍珊珊, 等. 油菜素内酯和脱落酸调控葡萄果实花色苷合成的研究[J]. 果树学报, 2012, 29(5): 830-836.
[18] 霍珊珊, 惠竹梅, 马立娜, 等. 植物生长调节剂对赤霞珠葡萄果实品质的影响[J]. 西北农林科技大学学报: 自然科学版, 2012, 77(1): 183-189.
[19] JIN Zanmin, HE Jianjun, BO Heqiang, et al. Phenolic compound profiles in berry skins from nine red wine grape cultivars in northwest China[J]. Molecules, 2009, 14(12): 4922-4935.
[20] 何建军. 影响酿酒葡萄果实中花色苷结构修饰的因素分析[D]. 北京: 中国农业大学, 2010.
[21] HE Jianguo, LIU Yanxia, PAN Qiuhong, et al. Different anthocyanin profiles of the skin and the pulp of Yan73 (Muscat Hamburg × Alicante Bouschet) grape berries[J]. Molecules, 2010, 15(3): 1141-1153.
[22] 程国利. 浸渍酶对蛇龙珠红葡萄酒花色苷的影响[D]. 北京: 中国农业大学, 2007.
[23] 樊玺, 李记明, 吕文鉴. 烟73葡萄酒的苹果酸-乳酸发酵(MLF)[J]. 酿酒科技, 2006, 142(4): 77-78.
[24] BOSS P K, DAVIES C, ROBINSON S P. Anthocyanin composition and anthocyanin pathway gene expression in grapevine sports differing in berry skin colour[J]. Australian Journal of Grape and Wine Research, 1996, 2(3): 163-170.
[25] ESTEBAN M A, VILLANUEVA M J, LISSARRAGUE J R. Effect of irrigation on changes in the anthocyanin composition of the skin of cv Tempranillo (Vitis vinifera L.) grape berries during ripening[J]. Journal of the Science of Food and Agriculture, 2001, 81(4): 409-420.
[26] NÚÑEZ V, MONAGAS M, GOMEZ-CORDOVES M C, et al. Vitis vinifera L. cv. Graciano grapes characterized by its anthocyanin profile[J]. Postharvest Biology and Technology, 2004, 31(1): 69-79.
Effect of Abscisic Acid on Anthocyanin Composition of Grape Skins from Yan 73 and Cabernet Sauvignon
LUAN Li-ying1, ZHANG Zhen-wen1,2, XI Zhu-mei1,2,*, FANG Yu-lin1,2, HUO Shan-shan1
(1. College of Enology, Northwest A & F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, China)
Objective: To evaluate the difference in the anthocyanin composition of grape skins from two cultivars, and the effects of abscisic acid (ABA) treatment used for enhancing color development in grape fruits on anthocyanins compounds of their skins. Methods: Yan 73 and Cabernet Sauvignon grapevines were used in this experiment. Two treatments, a control (water) and an application of 200 mg/L ABA, were applied on pre-veraison clusters. The anthocyanins in the skins of harvested fruits were extracted, and analyzed qualitatively and quantitatively by high performance liquid chromatography (HPLC) and mass spectrometry (MS). Results: A total of 16 anthocyanins were identified from the control skins, including 15 ones (8 400.9 mg/kg) in Yan 73 and 12 ones (1 131.9 mg/kg) in Cabernet Sauvignon. After ABA treatment, the anthocyanins contents of Yan 73 and Cabernet Sauvignon were distinctly enhanced to 10 380.2 and 1 470.2 mg/kg, respectively. All categories of anthocyanins were increased to different levels. Conclusions: The composition and contents of anthocyanins in grape skins were different between Yan 73 and Cabernet Sauvignon. The anthocyanin cont ents of the two cultivars were significantly increased by ABA treatment, and the contents of different anthocyanins categories were enhanced to different levels; as a result, fruit color development was promoted.
abscisic acid; Yan 73; Cabernet Sauvignon; anthocyanins; grape
S663.1
A
1002-6630(2014)18-0110-05
10.7506/spkx1002-6630-201418022
2013-12-26
国家现代农业产业技术体系建设专项(CARS-30-zp-9);陕西省自然科学基金项目(2011JM3004)
栾丽英(1982—),女,博士研究生,研究方向为葡萄与葡萄酒。E-mail:luanliying@163.com
*通信作者:惠竹梅(1969—),女,副教授,博士,研究方向为葡萄与葡萄酒。E-mail:xizhumei@nwsuaf.edu.cn

