响应面法优化二色补血草多糖的乙酰化工艺
赵 鹏,宋 逍,张婷婷,唐志书,张丽华
(陕西中医学院药学院,陕西 咸阳 712046)
响应面法优化二色补血草多糖的乙酰化工艺
赵 鹏,宋 逍,张婷婷,唐志书,张丽华
(陕西中医学院药学院,陕西 咸阳 712046)
采用响应面试验研究合成乙酰化二色补血草多糖的最优工艺条件,以乙酰化多糖取代度为评价指标,考察反应时间、乙酸酐与多糖的物质的量比和反应温度对乙酰化多糖取代度的影响。结果表明,通过响应面试验得到的最优工艺条件为:反应时间2.6 h、乙酸酐与多糖的物质的量比3.3∶1、反应温度65 ℃。在此条件下,二色补血草乙酰化多糖取代度为0.409。初步的抗氧化性实验表明,乙酰化后的二色补血草多糖的抗氧化性能有了明显提高。
二色补血草;多糖;乙酰化;响应面;抗氧化性
二色补血草(Limonium bicolor Kunze)是常用中药,属于白花丹科补血草属植物。其主要生长于我国陕西、甘肃、宁夏、内蒙古等地[1]。二色补血草具有温中健脾、滋补强壮、补血、止血等功效,临床上主要用于治疗月经不调、功血、宫颈癌等症[2-8]。研究表明,二色补血草多糖是二色补血草中的主要活性成分之一,具有抗氧化,抗肿瘤等生物活性[9]。目前对于二色补血草多糖的研究主要集中其分离纯化、药理活性等方面,而对其结构进行衍生化方面的研究尚未见报道。
对于多糖进行衍生化的方法主要包括物理法、化学法及生物法等。利用化学的方法对多糖的分子结构进行修饰,能够提高其生物活性,甚至赋予其新的生物活性。因此,对于多糖的衍生化研究已成为多糖研究者重点关注的热点[10-15]。而对多糖的乙酰化修饰是对多糖进行衍生化的重要途径之一,乙酰化后的多糖在溶解性、生物活性等方面均有了明显的改善[16-19]。
基于上述原因,本研究在前期对二色补血草多糖分离纯化的研究基础之上,利用响应面试验对二色补血草多糖乙酰化修饰的合成工艺条件进行了优化研究,并初步研究了乙酰化后多糖的抗氧化性,考察乙酰化修饰对二色补血草多糖抗氧化活性的影响。本研究成果进一步拓宽了二色补血草这一药用资源的利用途径,对其作为功能性食品添加剂的研究和开发利用提供了一定的技术参考。
1 材料与方法
1.1 材料、试剂与仪器
二色补血草购自西安万寿路中药材批发市场。
乙酸酐、盐酸羟胺、乙醇、乙醚、葡萄糖、苯酚、浓硫酸、邻苯三酚、邻二氮菲、三羟甲基氨基甲烷、β-D-五乙酰葡萄糖标准品及其他试剂均为国产分析纯。
UV-2501PC紫外-可见分光光度仪 日本岛津公司;FA2004电子天平 上海精科天平厂;H2050R台式离心机 湖南湘仪离心机仪器有限公司;ALPHA1-4型真空冷冻干燥机 德国Christ公司。
1.2 方法
1.2.1 二色补血草多糖的制备
将二色补血草在80 ℃条件下干燥,粉碎后过60 目筛。再将其用无水乙醇在回流下脱脂2 次,过滤,滤渣晾干后,用双蒸水,按料液比1∶15(g/mL)80 ℃条件下提取2 次,提取液合并,再按1 g生药材浓缩为1 mL进行浓缩,浓缩液经脱蛋白、脱色处理后醇沉,即得二色补血草粗多糖,用水复溶后,再用Sephadex G-100凝胶柱进行纯化,收集多糖富集峰,浓缩后冻干即得二色补血草多糖,经测定该多糖含量为98.4%,经高效凝胶色谱法检测,其为均一多糖,相对分子质量为14 000。
1.2.2 二色补血草多糖的乙酰化工艺条件优化
参照文献[16-18]的方法,先精确称取一定量的多糖样品,加入适量双蒸水将其溶解,利用氢氧化钠调节反应液的pH值在9.0左右,在一定温度条件下,往多糖溶液滴加一定量的乙酸酐。滴加完毕后,恒温反应一段时间后,待反应结束,再用盐酸溶液将反应液调为中性。将反应液装入截留相对分子质量为3 500的透析袋中用流动水透析48 h。透析液浓缩后即得乙酰化修饰的二色补血草多糖。
本研究按照Box-Behnken试验设计原理,在单因素试验的基础之上,以乙酰化多糖取代度作为指标,选取反应时间、配料比(乙酸酐与多糖的物质的量比)和反应温度单因素进行响应面试验,优化二色补血草多糖乙酰化的工艺条件。响应面试验因素与水平见表1。
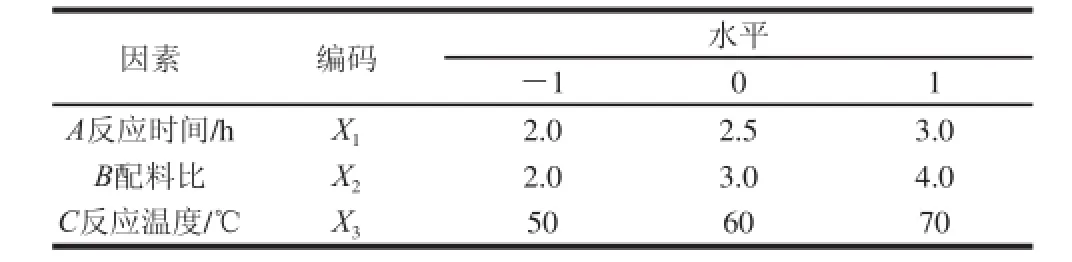
表1 响应面试验因素及水平Table 1 Coded levels for independent variables used in response surface dessiiggnn
1.2.3 二色补血草乙酰化多糖取代度的测定
1.2.3.1 标准曲线的绘制
参照文献[19]测定乙酰化多糖的取代度。准确称取β-D-五乙酰葡萄糖标准品0.500 6 g,定容于100 mL容量瓶。标准溶液中乙酰基质量浓度为2.760 mg/mL。准确吸取标准溶液0、2、4、6、8、10、12 mL,分别置于50 mL容量瓶中,准确加入0.1 mol/L新配的盐酸羟胺溶液5 mL,加入1.5 mol/L氢氧化钠溶液5 mL,静置20 min后,加入2 mol/L盐酸溶液3.5 mL中和过量碱,再静置20 min,加入0.37 mol/L三氯化铁显色剂10 mL,用水定容,静置10 min,于波长500 nm波长处测定吸光度。以吸光度为纵坐标,乙酰基质量浓度为横坐标,作标准曲线,绘制乙酰基标准曲线,线性回归方程为:y = 1.985x-0.029,R2=0.999 7,在0.10~0.70 mg/mL范围内,乙酰基质量浓度与吸光度线性良好。
1.2.3.2 乙酰化样品取代度的测定
配制乙酰化前和乙酰化后样品溶液,精确吸取样品溶液,按1.2.3.1节中的方法,在波长500 nm处测定吸光度A1和A2,然后按照乙酰基含量的线性回归方程,计算样品中的乙酰基含量。
乙酰化多糖的取代程度用改性后的多糖中乙酰基的含量(Ac)表示。乙酰化多糖的程度用取代度(Ds)表示,计算如下:
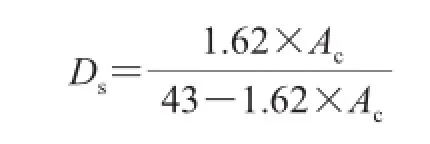
1.2.4 抗氧化性能测试
参照文献[20]测试样品对超氧阴离子自由基和羟自由基的清除效果。
2 结果与分析
2.1 二色补血草多糖乙酰化的合成
2.1.1 单因素对乙酰化多糖取代度的影响
2.1.1.1 反应时间的影响

图1 反应时间对乙酰化多糖取代度的影响Fig.1 Effect of reaction time on the DSof acetylated polysaccharides
预设反应温度50 ℃,配料比(乙酸酐与多糖的物质的量比)2∶1,确定最优的反应时间,结果见图1。图1说明,当反应时间为3.0 h以上时,乙酰化多糖取代度的值基本不再改变,因此确定最优的反应时间为
3.0 h。
2.1.1.2 配料比的影响

图2 配料比对乙酰化多糖取代度的影响Fig.2 Effect of ratio of acetic anhydride to polysaccharide on the DSof acetylated polysaccharides
预设反应温度50℃,反应时间3.0 h,改变配料比,确定最优的配料比(乙酸酐与多糖的物质的量比),结果见图2。
由图2可知,当配料比为3∶1左右时,乙酰化多糖取代度的值达到最大,因此确定最优的配料比为3∶1左右。
2.1.1.3 反应温度的影响
预设反应时间3.0 h、配料比(乙酸酐与多糖的物质的量比)3.0,确定最优的反应温度,结果见图3。

图3 反应温度对乙酰化多糖取代度的影响Fig.3 Effect of reaction temperature on the DSof acetylated polysaccharides
图3说明,当反应温度到60 ℃左右时,乙酰化多糖取代度的值为最大,因此确定最优的反应温度为60 ℃左右。
2.1.2 二色补血草多糖乙酰化修饰工艺条件优化
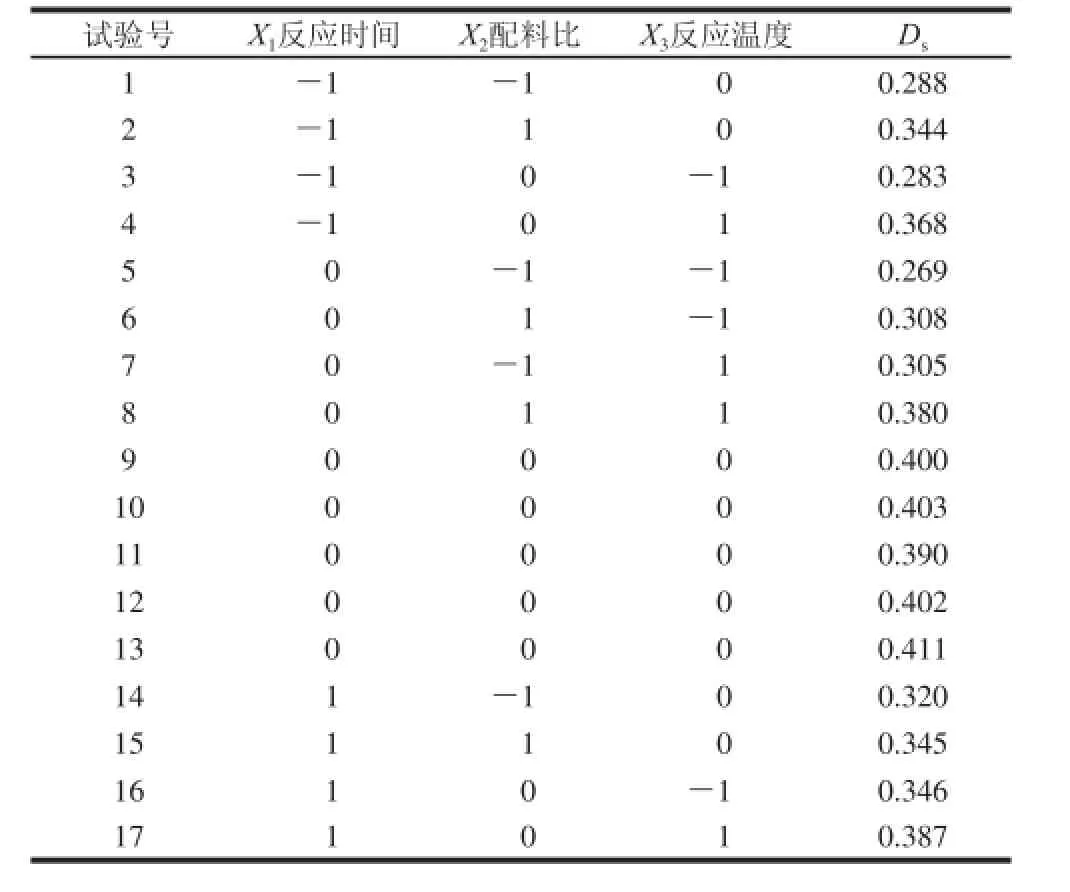
表2 响应面试验设计及结果Table 2 The experimental design and results for response surface analysis
采用Design-Expert 7.01软件对响应面优化试验得到的结果进行分析研究,试验结果见表2,按照各因素对试验结果的影响进行二次方程拟合,拟合得到以下方程:
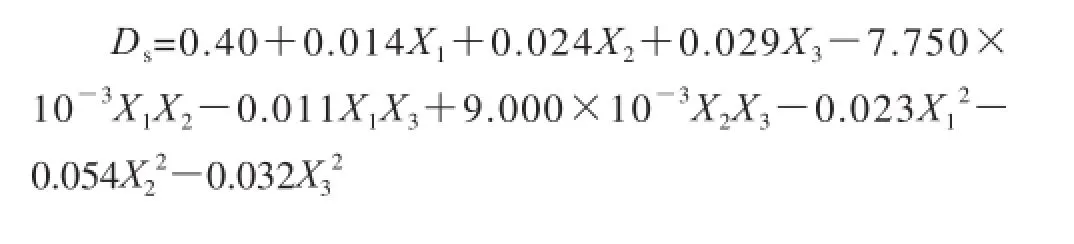
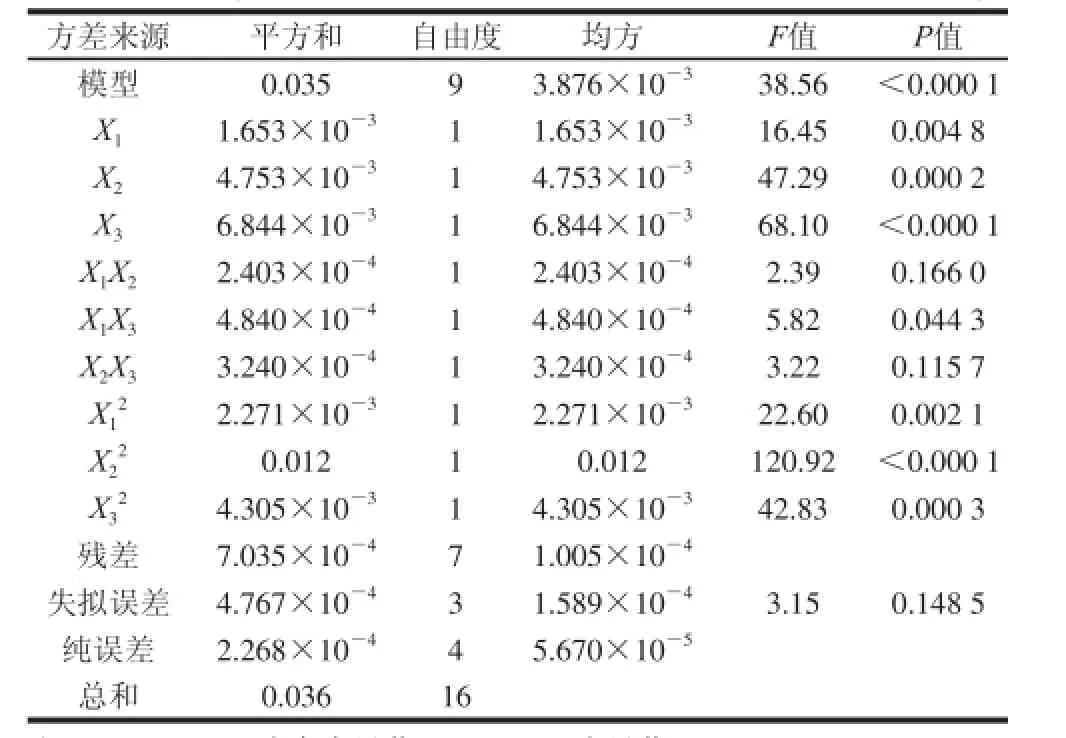
表3 响应面试验结果方差分析表Table 3 Analysis of variance for the results of response surface design
由表3的分析结果可以看出,回归方程的F值为38.56,其显著水平远远低于0.05,这说明利用响应面法拟合得到的试验模型显著性极高,按照拟合模型得到的回归方程,考察其因变量与自变量之间的线性相关系数后发现,r= 0.035/0.036 =0.972 2,这一点表明用该数学模型来评估各相关因素对二色补血草多糖乙酰化取代度的影响相对准确。对表3的方差分析结果可以看出,响应面试验组合的各单因素中,对二色补血草乙酰化多糖取代度的影响最大的是反应温度,其次是配料比,反应时间的影响最小,但上述3 个因素均为显著影响因素,交互影响因素中,反应时间与反应温度之间的交互影响最为显著,为显著影响因素。
2.1.3 响应面图分析

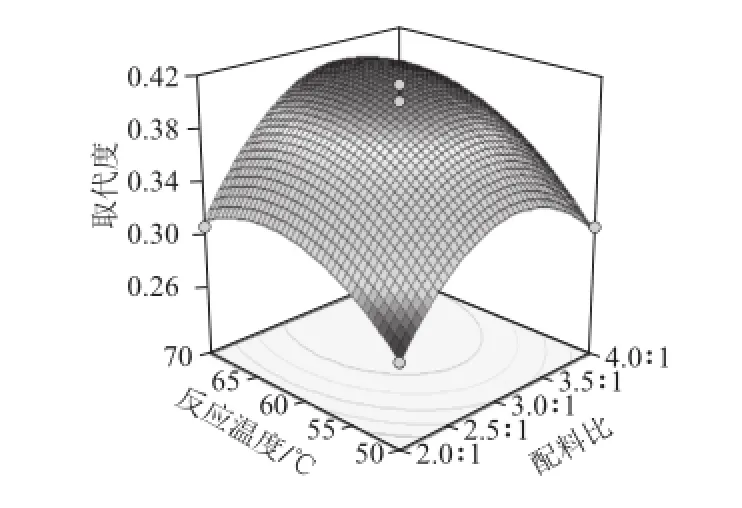
图4 两两因素交互作用对乙酰化多糖取代度的影响Fig.4 Interactive effects of three factors on the DSof acetylated polysaccharides
通过响应面优化试验分析得到相应的响应面图,可以更加直观地反映出各单因素对二色补血草乙酰化多糖取代度的影响结果以及各单因素之间交互影响的强弱关系。响应面试验得到的等高线图见图4。
由图4可知,反应温度对二色补血草乙酰化多糖取代度的影响极为显著,可看出其绘制的曲线最为陡峭;配料比对乙酰化多糖取代度的影响次之,而影响最小的则是反应时间,相较于反应温度而言,其曲线较为平滑一些。通过响应面法预测得到的回归模型分析[21-24],可预测得到二色补血草多糖乙酰化的最优合成工艺条件为反应时间2.57 h、配料比3.26∶1、反应温度65.5 ℃,在预测的工艺条件下,得到的乙酰化多糖的取代度为0.413。
2.1.4 验证实验
按照上述预测的结果,从实验操作的可操作性考虑,微调上述工艺条件为:反应时间2.6 h、配料比3.3∶1、反应温度65 ℃。分别用0.1 g的二色补血草多糖,在微调后的乙酰化修饰的工艺条件下,做3 次多糖乙酰化平行实验,得到的乙酰化二色补血草多糖乙酰基取代度的平均值为0.409,实验结果表明,通过回归方程预测得到的工艺条件与实际操作工艺条件十分吻合。
2.2 二色补血草乙酰化多糖的初步结构分析
2.2.1 红外光谱
分别将二色补血草多糖、二色补血草乙酰化多糖和溴化钾研磨压片后,红外光谱仪进行测定。结果如图5所示。
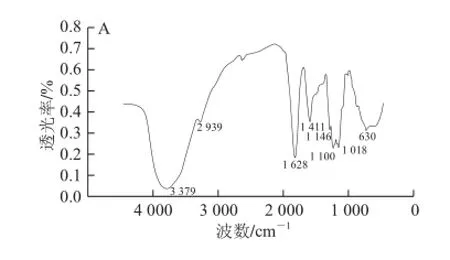
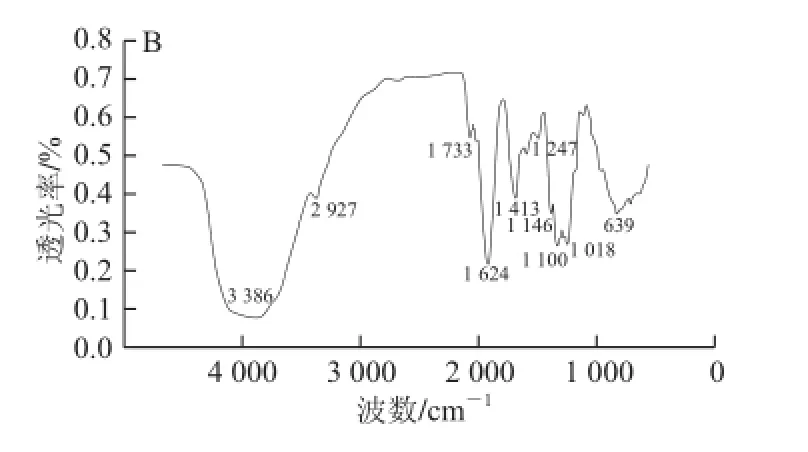
图5 二色补血草多糖(A)和二色补血草乙酰化多糖(B)的红外光谱图Fig.5 IR spectra of native (A) and acetylated (B) Limonium bicolor polysaccharides
由图5可见,经过乙酰化后的二色补血草多糖的红外谱图,在1 733 cm-1出现了酯基的C=O伸缩振动,1 247 cm-1处有一个较弱的酯基的C—O伸缩振动,这表明存在乙酰基[25]。OH伸缩振动强度远远高于C—O伸缩振动,这说明乙酰化样品的取代度并不是太高,这一点通过羟胺比色法已经被证明。此外,从图5还可以看出,两图的红外吸收光谱非常接近,这说明乙酰化修饰并未改变二色补血草多糖的大体结构。
2.2.2 紫外光谱
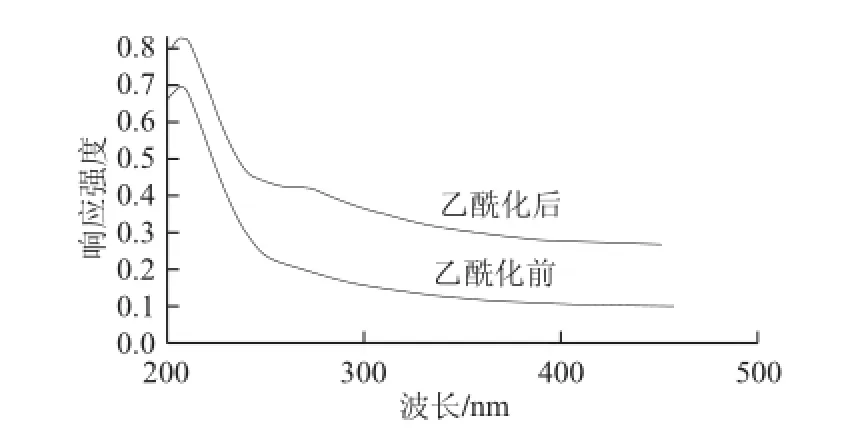
图6 样品的紫外吸收光谱图Fig.6 Ultraviolet absorption spectra of native and acetylated Limonium bicolor polysaccharides
由图6可知,乙酰化前后的二色补血草多糖在200~480 nm波段的紫外光谱比较相似,但是根据UV2501PC 随机软件分析发现,乙酰化后的多糖在252~272 nm波长处存在一个弱的吸收峰,这可能是由于羰基产生的。
通过红外和紫外谱图分析可知,本研究已经成功制备得到了二色补血草乙酰化多糖。
2.3 二色补血草乙酰化多糖的抗氧化活性
2.3.1 羟自由基清除率
由图7可知,经过乙酰化修饰后的二色补血草多糖清除羟自由基的最大清除率为69.2%,比乙酰化前多糖的最大清除率56.3%提高了22.9%,清除羟自由基的能力有了明显的提高。
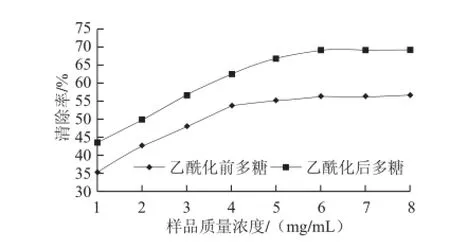
图7 二色补血草乙酰化多糖对羟自由基的清除作用Fig.7 Hydroxyl radical scavenging capacity of native and acetylated Limonium bicolor polysaccharides
2.3.2 超氧阴离子自由基清除率

图8 二色补血草乙酰化多糖对超氧阴离子自由基的清除作用Fig.8 Superoxide anion radical scavenging capacity of native and acetylated Limonium bicolor polysaccharides
由图8可知,经过乙酰化修饰后的二色补血草多糖清除超氧阴离子自由基的最大清除率为81.3%,比乙酰化前多糖的最大清除率65.2%提高了24.7%,清除超氧阴离子自由基的能力也有了明显的提高。
抗氧化性实验结果说明,乙酰化修饰二色补血草多糖,可有效地提高其抗氧化活性。
3 结 论
本研究对二色补血草多糖进行乙酰化修饰的工艺路线进行研究,并通过响应面试验分析方法优化了其最优的修饰工艺条件为反应时间2.6 h、配料比3.3∶1、反应温度65 ℃,在此条件下修饰制得的二色补血草乙酰化多糖的乙酰化取代度为0.409。利用该方法对多糖进行乙酰化修饰,具有反应可操作性强、试剂便宜易得、多糖的乙酰化取代度较高的优点,是一种较理想的多糖乙酰化修饰方法。通过二色补血草多糖乙酰化衍生物超氧阴离子自由基和羟自由基的清除实验表明,经过乙酰化修饰后的抗氧化能力较之乙酰化修饰前的多糖有了非常明显的改善,其抗氧化能力进一步增强。
[1] 汤新慧, 沈敏. 补血草属植物化学成分及药理作用研究进展[J]. 时珍国医国药, 2007, 18(8): 1874-1876.
[2] 魏友霞, 王军宪, 姚鸿萍. 补血草属植物化学成分和药理作用研究进展[J]. 西北药学杂志, 2007, 22(4): 222-225.
[3] LIN L C, KUOY C, CHOU C J. Anti-herpes simplex virus type-1 flavonoids and a new flavanone from the root of Limonium sinese[J]. Planta Medica, 2000, 66(3): 333-336.
[4] BASHIR A K, ABDALLA A A, WASFI I A. Flavonoids of Limonium axillare[J]. International Journal of Pharmacognosy, 1994, 32(4): 366-372.
[5] 魏友霞, 王军宪, 姚鸿萍. 二色补血草挥发油成分气相-质谱联用分析[J]. 中国现代应用药学杂志, 2007, 24(5): 398-401.
[6] 吴冬青, 安红钢, 林敏, 等. 二色补血草不同部位总黄酮含量的测定[J].光谱实验室, 2006, 23(1): 127-129.
[7] 魏有霞, 王军宪. 二色补血草地下部分化学成分研究[J]. 中草药, 2006, 29(11): 1182-1184.
[8] 李莉, 杨汉民. 二色补血草临床止血206 例疗效观察[J]. 陕西中医, 2001, 22(11): 649.
[9] 张连茹, 陈喀林, 李妮, 等. 二色补血草多糖的结构表征及其对HeLa细胞的抑制作用[J]. 高等学校化学学报, 2004, 25(11): 2034-2037.
[10] 王晶, 张全斌, 张忠山, 等. 乙酰化海带褐藻多糖硫酸酯的制备及其抗氧化活性研究[J]. 中国海洋药物杂志, 2008, 27(1): 50-54.
[11] 梁忠岩, 苗春艳, 张翼伸, 等. 化学修饰对斜顶菌多糖抑菌活性影响的研究[J]. 中国药学杂志, 1996, 30(10): 613-615.
[12] QI Huimin, ZHANG Quanbin, ZHAO Tingting, et al. In vitro antioxidant activity of acetylated and benzoylated derivatives of polysaccharide extracted from Ulva pertusa (Chlorophyta)[J]. Bioorganic and Medicinal Chemistry Letters, 2006, 16: 2441-2445.
[13] QI Huimin, ZHAO Tingting, ZHANG Quanbin, et al. Antioxidant activity of different molecular weight sulfated polysaccharides from Ulva pertusa Kjellm (Chlorophyta)[J]. Journal of Applied Phycology, 2005, 17: 527-534.
[14] 朱玉婷, 谭姚, 莫开菊. 硫酸酯化修饰葛仙米多糖工艺研究[J]. 食品科学, 2011, 32(24): 46-49.
[15] 田龙, 王庆林, 阚云超, 等. 正交试验优化猕猴桃果水溶性多糖硫酸酯化条件的研究[J]. 食品科学, 2007, 28(5): 103-106.
[16] 梁进, 张剑韵, 崔莹莹, 等. 茶多糖的化学修饰及体外抗凝血作用研究[J]. 茶叶科学, 2008, 28(3): 166-171.
[17] 李书福, 周革非, 王长海. 乙酰化修饰的角叉菜λ-卡拉胶的免疫和抗氧化活性研究[J]. 食品科技, 2010, 35(5): 124-128.
[18] 黄丹菲, 聂少平, 江乐明, 等. 乙酰化大粒车前子多糖的制备及其活性初探[J]. 食品科学, 2013, 34(22): 1-4.
[19] 殷殷, 张燕, 彭芳, 等. 紫外分光光度法测定魔芋多糖中乙酰取代度[J]. 药物分析杂志, 2010, 30(5): 919-921.
[20] 赵鹏. 款冬花多糖提取纯化工艺研究及结构鉴定[D]. 西安: 西北大学, 2010.
[21] 赵鹏, 李稳宏, 朱骤海, 等. 超声提取款冬花多糖的响应面法工艺优化研究[J]. 精细化工, 2009, 26(6): 546-549.
[22] 王俊杰, 赵燕, 涂勇刚, 等. 响应面法优化受精蛋蛋清制备抗氧化肽酶解工艺[J]. 食品科学, 2014, 35(9): 187-191.
[23] 邱远, 芮昕, 谢翌冬, 等. 响应面法优化超声提取葛根素工艺[J]. 食品科学, 2014, 35(6): 1-5.
[24] 张辉, 张娜娜, 马丽, 等. 响应面法优化大麦苗叶绿素提取工艺[J].食品科学, 2014, 35(2): 75-80.
[25] 周林, 郭祀远, 郑必胜, 等. 裂褶多糖的乙酰化及光谱分析[J]. 华南理工大学学报: 自然科学版, 2006, 34(12): 88-91.
Optimization of Acetylation Process for Polysaccharides from Limonium bicolor Kunze
ZHAO Peng, SONG Xiao, ZHANG Ting-ting, TANG Zhi-shu, ZHANG Li-hua
(School of Pharmacy, Shaanxi University of Chinese Medicine, Xianyang 712046, China)
In this study, response surface methodology was employed to optimize the acetylation conditions of polysaccharides from Limonium bicolor Kunze. The degree of substitution (Ds) of acetylated polysaccharides was investigated as a function of reaction time, molar ratio of acetic anhydride to polysaccharides, and reaction temperature. The optimal conditions for acetylating polysaccharides from Limonium bicolor Kunze were found to be reaction at 65 ℃ for 2.6 h with an acetic anhydride-to-polysaccharide ratio of 3.3:1. The maximum DS of 0.409 was obtained under the optimized reaction conditions. Antioxidant assays demonstrated that compared with Limonium bicolor Kunze polysaccharides, the antioxidant capacity of acetylated derivatives was significantly improved.
Limonium bicolor Kunze; polysaccharides; acetylation; response surface methodology; antioxidant capacity
TS272
A
1002-6630(2014)18-0052-05
10.7506/spkx1002-6630-201418010
2014-04-11
陕西省科学技术研究发展计划项目(2012K19-04-07);陕西省教育厅专项科研计划项目(2010JK521)
赵鹏(1977—),男,副教授,博士,研究方向为天然产物分离纯化及修饰。E-mail:zhaopeng65@sina.com

