下关生沱茶和熟沱茶成分分析和体外功能性效果比较研究
王 睿,赵 欣
(重庆第二师范学院,生物与化学工程系,重庆400067)
下关生沱茶和熟沱茶成分分析和体外功能性效果比较研究
王 睿,赵 欣*
(重庆第二师范学院,生物与化学工程系,重庆400067)
通过液质联用(LC-MS)分析,下关生沱茶和熟沱茶里均发现存在12种成分,分别是没食子酸、表没食子儿茶素、儿茶素、咖啡因、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯、槲皮素-3-半乳糖甙、山柰酚-3-芸香糖甙、山柰酚-3-葡萄糖苷、槲皮苷和叶黄素。经过发酵后,在熟沱茶中新发现了二羟基苯酸和山奈酚。同时,熟沱茶的没食子酸和槲皮苷含量增加。经过体外实验发现,随着功能性成分的增加,熟沱茶比生沱茶表现出更好的抗氧化、抗突变和抗癌的效果。
下关沱茶,成分分析,LC-MS,抗氧化,抗癌
沱茶是由优质晒青毛茶经蒸制加工而成的圆锥窝头状的紧压茶,主要产地是云南,而云南沱茶创制于下关,所以云南沱茶又称下关沱茶[1]。下关沱茶也是普洱茶的一类,又可分为生沱茶和熟沱茶,生沱茶为晒青毛茶直接制成的紧压茶,熟沱茶为晒青毛茶经过人工渥堆发酵后再制成紧压茶[2]。普洱熟茶因经过了发酵过程,生成了更多的功效成分,已经被证实比普洱生茶具有更好的降血脂和减缓脂质过氧化的作用[3]。同时,沱茶也已经被证实具有抗氧化作用[4],作为健康食品可以应用于各类人群。现今国内外还未有对下关沱茶发酵前后成分分析的研究,本文对熟沱茶成分较未发酵的生沱茶发生的变化和体外抗氧化、抗突变和抗癌效果变化之间的关系进行了系统研究,对发酵产生的功能性作用差异进行了比较,为更好的开发下关沱茶这一功能性饮品提供理论依据。
1 材料与方法
1.1 材料与仪器
沱茶提取物 云南下关沱茶(集团)股份有限公司提供2012年产生沱茶和熟沱茶,生沱茶和熟沱茶为同一批次原料茶制成。沱茶叶粉碎后用20倍80%的甲醇进行提取,反复提取三次后合并提取液,用旋转蒸发仪蒸干甲醇溶液后得到沱茶的提取物[5];NaH2PO4·2H2O、FeCl3、三氯乙酸 广州化学试剂厂;2-硫代巴比妥酸 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)、抗坏血酸、D-Biotin、L-histidine·HCl(monohydrate)、D-glucose-6-phosphate、NADP、deoxyribose(脱氧核糖) 美国Sigma公司;DMSO 日本纯正化学株式会社;RPMI 1640培养液、FBS、trypsin、EDTA、100U/mL Penicillin-Streptomycin
美国Gibco公司;其余化学试剂药品 均为国产分析纯;致突变物:N-甲基-N’-硝基-N-亚硝基胍(N-methyl-N’-nitro-N-nitrosoguanidine,MNNG) 美国Aldrich公司;标准菌株:TA100营养缺陷型鼠伤寒沙氏菌 美国Sigma公司;癌细胞:AGS胃癌细胞株(AGS human gastric carcinoma cells)、HT-29结肠癌细胞株(HT-29 human colon carcinoma cells) 韩国细胞株银行。R-114型旋转蒸发仪 瑞士Buchi公司;LSB75L型高压蒸气灭菌锅 江阴滨江医疗设备有限公司;WPL-30型恒温培养箱 江东精密仪器有限公司;UV-1750型紫外分光光度计、LCMS-2020液相色谱-质谱联用仪 日本岛津公司;VS-15CFN型冷冻离心机 韩国Vision科学株式会社;MC096型二氧化碳培养箱 日本三洋电机株式会社;Elx800型酶标仪 美国Bio Tekinstruments公司。
1.2 实验方法
1.2.1 液质联用(LC-MS)测定沱茶的成分 色谱柱为Waters Xterra MS C18(2.1mm×150mm,5μm),流动相A为蒸馏水,流动相B为乙腈,A、B流动相均含有0.1%的甲酸,进行梯度洗脱,流速为0.2mL/min,顺序为:0~5min,使用0%~40%B(线性梯度);5~20min,使用40%~80%B(线性梯度);20~25min,使用80~100% B(线性渐变);25~30min,100%B,扫描范围100~1000m/z。通过比对MS/MS谱库,检索沱茶提取物内所含物质的结构[6]。
1.2.2 羟基自由基清除能力测定 将6mol/L浓度的deoxyribose(脱氧核糖)溶液0.2mL,pH7.4的磷酸钠缓冲溶液0.2mL,400mmol/L浓度的FeCl3溶液0.2mL,400mmol/L浓度的FeSO4-EDTA溶液0.2mL,3mol/L浓度的H2O2溶液0.2mL,400mmol/L浓度的抗坏血酸溶液0.2mL和0.2mL沱茶提取物溶液混合,在37℃水浴中放置60min,再加入1mL的三氯乙酸,1mL的2-硫代巴比妥酸,混合溶液在90℃水浴中煮沸20~25min后在532nm处测定吸光度,计算清除自由基能力[7]。
1.2.3 DPPH自由基清除能力测定 将100μL不同浓度沱茶提取物溶液和60μL、0.15mmol/L的DPPH试剂混匀后加入96孔板中室温下避光放置30min,再在540nm波长下测定光度值。测得的OD数值按公式计算:清除DPPH自由基能力(%)=[(对照值-对照空白值)-(样品值-样品空白值)]×100/(对照值-对照空白值)[8],对照组为没有加入样品孔,空白组为加入样品但没有加入DPPH试剂孔。
1.2.4 Ames抗突变实验 沱茶提取物设两个实验剂量组(1.25、2.5mg/皿)、自发回变组(加入浓度为1~2× 109个/mL的TA100菌株0.1mL,不加入致突变物)和对照组(加入TA100菌株和致突变物(MNNG)50μL),每组设3个平行皿。在样品实验组的灭菌试管中加入磷酸盐缓冲液、浓度为1~2×109个/mL的培养12h后的TA100菌株0.1mL、样品物质提取物溶液50μL和致突变物(MNNG)50μL。轻微振荡后37℃下放置30min后加入顶层培养基2mL混合,再倒在底层培养基上,37℃培养48h后进行平板计数计算结果。抑制率(%)=[(对照组菌落数-样品处理组菌落数)/(对照组菌落数-自发回变组菌落数)]×100[9]。
1.2.5 MMT法测定沱茶提取物的体外癌细胞增值抑制效果 将体外培养的AGS人胃癌细胞和HT-29人结肠癌细胞复苏后接种在含10%灭活小牛血清的RPMI1640培养液中,将癌细胞放置在培养箱中以5%的CO2、37℃条件下培养,每周更换培养液2~3次并进行传代培养一次。按每孔200μL将含癌细胞培养液接种于96孔培养板,培养液的癌细胞浓度为1×104个/mL。然后将96孔培养板放入培养箱中继续培养24h。吸出96孔板中各孔的培养液,样品组各孔中加入沱茶提取物的培养液200μL,空白组各孔中加入新培养液200μL。再经过48h培养后,再次吸出各孔内上清液,各孔再加入200μL浓度5mg/mL的MTT试剂后继续培养4h后吸出各孔内的上清液,在每孔中加入200μL的DMSO后避光振荡30min,用酶标仪在540nm波长下测定各孔OD值,按公式:抑制率(%)=[(空白孔OD值-样品孔OD值)/空白孔OD值]×100计算细胞增殖抑制率[10]。
1.3 数据统计
使用SAS统计软件对所得到数据采用one-way ANOVA法分析数据结果是否存在差异性(p<0.05)。
2 结果与分析
2.1 下关生沱茶和熟沱茶成分的比较
通过LC-MS分析,通过MS/M分解图中各样品质谱图(图1)和对照标准品比对,观察到在生沱茶含有没食子酸(1.70min,m/z169)、表没食子儿茶素(9.10min,m/z305)、儿茶素(9.30min,m/z289)、咖啡因(9.62min,m/z195)、表儿茶素(10.73min,m/z289)、表没食子儿茶素没食子酸酯(10.87min,m/z457)、表儿茶素没食子酸酯(12.51min,m/z441)、槲皮素-3-半乳糖甙(12.74min,m/z463)、山柰酚-3-芸香糖甙(13.24min,m/z593)、山柰酚-3-葡萄糖苷(13.51min,m/z447)、槲皮苷(15.39min,m/z301)和叶黄素(25.09min,m/z568)这十二种化合物(图2A)。经过发酵后在熟沱茶中除了生沱茶中出现的十二种化合物外还出现了两种新的化合物,为二羟基苯酸(3.43min,m/z153)和山奈酚(17.37min,m/z285),另外经过发酵后熟沱茶中的没食子酸、二羟基苯酸、槲皮苷、山奈酚和两种未知成分的含量较生沱茶明显提高,表没食子儿茶素没食子酸酯和一种未知成分的含量大幅度下降,含量下降的未知成分有待进一步研究(图2B,1)。
2.2 下关生沱茶和熟沱茶抗氧化效果的比较
通过测定下关生沱茶和熟沱茶提取物的羟基自由基和DPPH自由基清除能力可以判断沱茶的抗氧化效果。100、200、500μg/mL三个浓度下,随着浓度的升高,生沱茶和熟沱茶的羟基自由基和DPPH自由基清除能力均得到提高;在不同实验浓度下,熟沱茶的清除自由基能力都强于生沱茶(图3、图4)。表没食子儿茶素、表儿茶素、表没食子儿茶素没食子酸酯和表儿茶素没食子酸酯作为茶多酚的四种单体存在形式具有较强的抗氧化效果[9],没食子酸和槲皮苷也是具有很强清除自由基能力的化合物[11-12]。沱茶生茶和熟茶都含有这些具有抗氧化物质,特别是茶多酚物质等有效成分使沱茶产生抗氧化效果。山奈酚是一种黄酮醇类物质,也是一种强抗氧化物质[13],也存在与生沱茶和熟沱茶中,经过发酵中一系列生化反应,熟沱茶中的山奈酚增加,是使熟沱茶具有更强抗氧化性效果的原因之一。同时,经过发酵后,熟沱茶内的原有的抗氧化成分含量增加并且生成了新的抗氧化物质,进一步提高了沱茶的抗氧化作用。有研究表明,通过SD大鼠高脂模型对云南普洱茶体内抗氧化性研究中,普洱熟茶表现出比普洱生茶更好的抗氧化作用[14],沱茶的原料和生产方式都和普洱茶十分接近,本研究得出的熟沱茶具有更好抗氧化性的结果也与之相同。
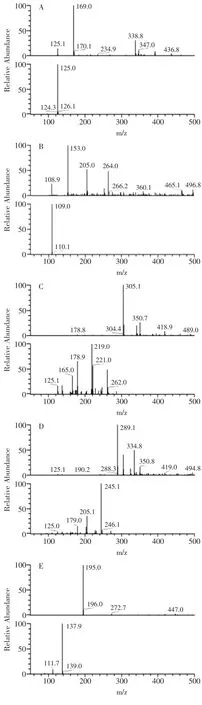
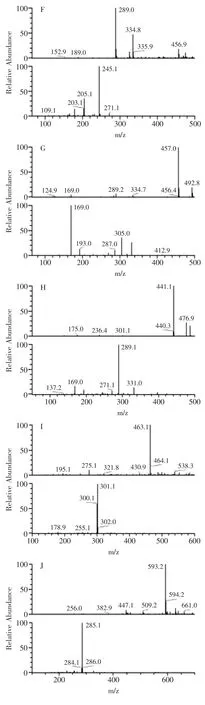
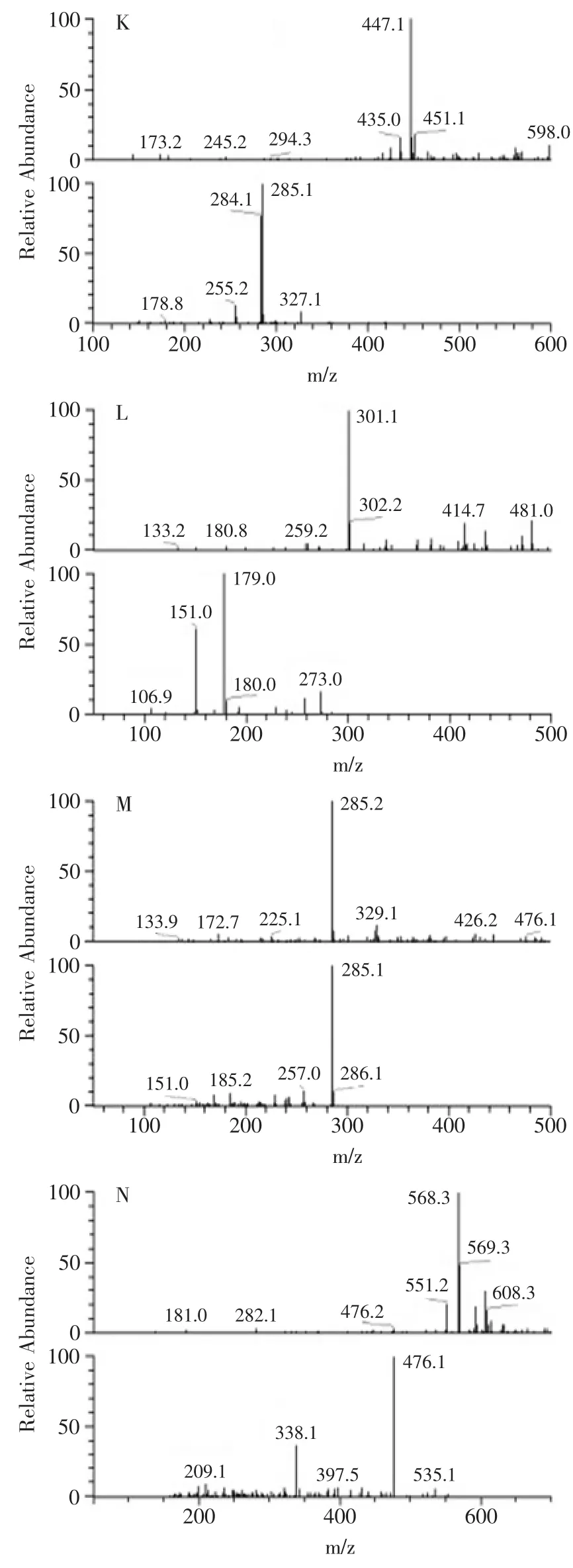
图1 下关熟沱茶质谱和MS/MS分解图中重要的14个峰图Fig.1 Mass spectra and MS/MS fragmentation patterns of 14 important peaks of Xiaguan ripe bowl tea
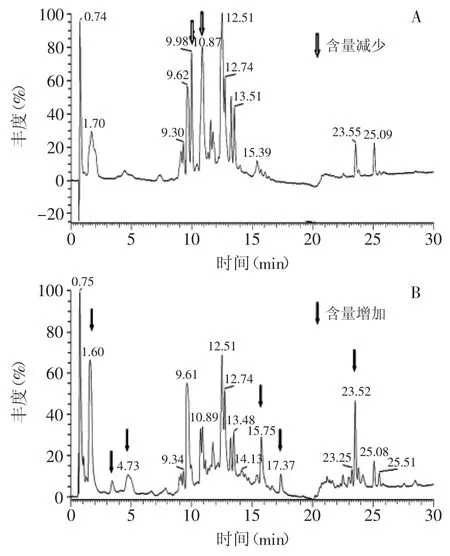
图2 下关沱茶的HPLC-PDA色谱图(200~600nm)Fig.2 HPLC-PDA chromatogram(200~600nm)for Xiaguan bowl tea

图3 下关沱茶提取物的羟基自由基清除效果Fig.3 Effect of Xiaguan bowl tea extracts in hydroxyl radical(OH)radical scavenging activity

图4 下关沱茶提取物的DPPH自由基清除效果Fig.4 Effect of Xiaguan bowl tea extracts in DPPH radical scavenging activity
2.3 下关生沱茶和熟沱茶抗突变效果的比较
总体上,下关生沱茶和熟沱茶的提取物对MNNG诱导的TA100菌具有一定的抑制作用。由表1可知,提取物浓度为1.25、2.5mg/皿时生沱茶的抑制率为33.6%和61.2%,熟沱茶对TA100的抑制率比生沱茶有所提高,分别为39.7%和74.2%。茶叶中提取的茶多酚具有很强的抗突变效果,它不仅有促进细胞的DNA损伤修复功能,也有减少诱变剂活化表现抗诱变功能,可以作为去突变剂[15]。生熟沱茶中都含有表没食子儿茶素、儿茶素、表没食子儿茶素没食子酸酯和表儿茶素没食子酸酯等茶多酚物质,这些茶多酚促进了沱茶的抗突变效果。没食子酸和槲皮苷已经被证实为具有良好抗突变性的化合物[16-17],熟沱茶中含有很多的没食子酸和槲皮苷,进一步促进了沱茶的抗突变效果。食品的抗氧化效果与抗突变效果相对应,抗氧化性强的食品常常也表现出强的抗突变性[18-19],本研究中熟沱茶抗氧化性强于生沱茶。由此可见,沱茶具有抗突变作用,并且经过发酵的熟沱茶效果更为明显。
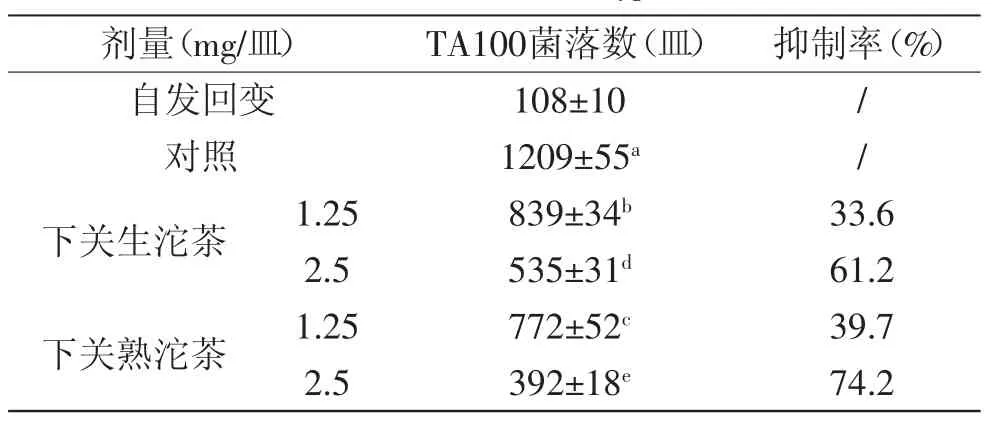
表1 沱茶提取物在致突变物N-甲基-N’-硝基-N-亚硝基胍(MNNG,0.4μg/皿)诱导TAIO0菌株下抗突变效果Table.1 Inhibitory effects of Xiaguan bowl tea extracts against MNNG·induced mutation(0.4μg/disc)of nutrient deficiency strain TA100 of Salmonella typhimurium
2.4 下关生沱茶和熟沱茶癌细胞体外增殖抑制效果的比较
观察体外癌细胞增殖的变化情况可以从一定程度上判断食品的抗癌功能性[20]。下关生沱茶和熟沱茶提取物分别对体外生长的AGS胃癌细胞和HT-29结肠癌细胞进行处理,观察其体外增殖抑制效果。由表2可知,用MTT法观察不同浓度提取物处理癌细胞后的OD值读数可以看到样品处理各组细胞的OD值较对照组OD值明显下降(p<0.05),高浓度生沱茶和熟沱茶提取物处理癌细胞后,AGS和HT-29细胞的OD值均低于低浓度处理时,通过计算可得出高浓度样品处理时具有更高的体外癌细胞生长抑制率,而且熟沱茶提取物对AGS和HT-29癌细胞在两个浓度上的生长抑制效果均高于生沱茶提取物。
普洱熟茶在发酵过程发生了例如多酚类化合物非酶性自动氧化等反应,茶叶内的物质发生了变化[21],这些变化使普洱熟茶比生茶具有更好的保健作用,同时发酵过程中的发酵时间、温度、湿度、微生物种群和数量都是造成这些差异的关键因素[22]。体内细胞突变可导致癌症,防止突变是控制癌症的一个重要方式[23]。沱茶在发酵过程中含量增加的没食子酸和槲皮苷增强了熟沱茶的抗突变效果,对癌细胞的作用也随之加强。本文中下关沱茶作为普洱茶的一种也表现出了类似的结果,除了在抗氧化和抗突变效果上优于生沱茶,在体外抗癌效果上也表现出更强的效果。由成分分析的结果也可以看出随着成分含量的变化和新的成分在发酵过程的产生,这些成分造成的协同作用也发生了变化,产生了更好的抗癌保健作用,使熟沱茶成为一种更有保健价值的食品。

表2 沱茶提取物对AGS和HT-29癌细胞的体外增值抑制效果Table.2 Growth inhibitory effect of Xiaguan bowl tea extracts on AGS and HT-29 cancer cells
3 结论
从实验结果可以看出,沱茶中含有十多种有效成分,其中包括多种茶多酚类物质,这些物质是茶叶中重要的功效成分,这些功效成分使生熟沱茶都具有很好的体外抗氧化、抗突变和抗癌效果。熟沱茶由于经过了发酵过程,其化学成分与未发酵的生沱茶也有一定的差异。由于发酵前后沱茶的成分发生改变,发酵前后生沱茶与熟沱茶的抗氧化、抗突变和癌细胞生长抑制作用也出现差异,熟沱茶中产生了没食子酸和槲皮苷等化合物,这些功能性物质加强了熟沱茶的体外功能性作用,所以熟沱茶具有很好的体外抗氧化、抗突变和抗癌能力。综合本研究中各项结果可以看出下关沱茶是一种含有多种功能性成分的健康食品,并且经过发酵后得到的熟沱茶的功能性成分更多,具有更高的价值。
[1]张竞文,赵欣.下关生沱茶的HT-29人体结肠癌细胞的体外抗癌效果[J].食品工程,2010(1):37-39.
[2]朱宏涛,杨崇仁,李元,等.普洱茶后发酵过程中微生物的研究进展[J].云南植物研究,2008,30(6):718-724.
[3]侯艳,肖蓉,徐昆龙,等.普洱茶对实验大鼠血清中血脂水平和脂质过氧化的影响[J].中国食品学报,2009,9(2):80-86.
[3]赵瑞,聂淑琴.沱茶的抗氧化和抗肝损害机理[J].国外医学:中医中药分册,2004,26(4):234-235.
[4]Lee JS,Kim DH,Liu KH,et al.Identification of flavonoidsusing liquid chromatography with electrospray ionization and ion trap tandem mass spectrometry with an MS/MS library[J].Rapid Communications in Mass Spectrometry,2005,19(23):3539-3548.
[5]Zhao X.Hawk tea(Litsea coreana Levl.var.lanuginose)attenuates CCl4-induced hepatic damage in Sprague-Dawley rats [J].Experimental and Therapeutic Medicine,2013,5(2):555-560.
[6]Kang HS,Chung HY,Jung,JH,et al.Antioxidant effect of Salvia miltiorrhiza[J].Archives of Pharmacal Research,1997,20(5):496-500.
[7]Banerijee A,Dasgupta N,Bratati D.In vitro study of antioxidant activity of Syzygium cumini fruit[J].Food Chemistry,2005,90(4):727-733.
[8]赵欣,邵林楠,郑妍菲.老鹰茶的抗突变和体外抗癌效果[J].食品工程,2008(4):29-31.
[9]Zhao X,Kim SH,Qi YC,et al.Effects of different kinds of salt in comutagenicity and growth of cancer cells[J].Journal of the Korean Society of Food Science and Nutrition,2012,41(1):26-32.
[10]王婧,高玉堂.茶多酚抗癌的流行病学研究进展[J].肿瘤,2011,34(6):553-557.
[11]陈丛瑾,黄克瀛,李德良,等.香椿叶提取物清除DPPH自由基能力的测定方法[J].林产化学与工业,2006,26(3):69-72.
[12]陆瑞利,胡丰林.亚热带部分常见芳香油树种鲜叶提取物清除自由基的活性研究[J].林产化学与工业,2006,23(2):51-56.
[13]林智,吕海鹏,崔文锐,等.普洱茶的抗氧化酚类化学成分的研究[J].茶叶科学,2006,26(2):112-116.
[14]徐湘婷,王鹏,罗绍忠,等.普洱茶预防SD大鼠高脂血症及抗氧化、保护血管内皮的研究[J].云南农业大学学报,2011,26(2):260-264.
[15]陈留记,杨贤强.茶提取物和茶多酚抗突变机理研究进展[J].天然产物研究与开发,2001,13(2):84-89.
[16]李沐涵,殷美琦,冯靖涵,等.没食子酸抗肿瘤作用研究进展[J].中医药信息,2011,28(1):109-111.
[17]潘宪伟,赵余庆.侧柏叶和果实中黄酮类和萜类物质的现代药学研究进展[J].中草药,2012,43(8):1641-1646.
[18]陈美珍,余杰,龙梓洁,等.龙须菜多糖抗突变和清除自由基作用的研究[J].食品科学,2005,26(7):219-222.
[19]履新.大麦麸皮多酚类提取物抗氧化活性和抗突变性[J].粮食与油脂,2004(6):9-12.
[20]王刚,赵欣.两种白茶的抗突变和体外抗癌效果[J].食品科学,2009,30(11):243-245.
[21]李家华,赵明,胡艳萍,等.普洱茶发酵过程中黄酮醇类物质含量变化的研究[J].西南大学学报:自然科学版,2012,34(2):59-65.
[22]徐湘婷,王鹏,罗绍忠,等.普洱茶预防SD大鼠高脂血症及抗氧化、保护血管内皮的研究[J].云南农业大学学报,2011,26(2):260-264.
[23]李毅民,李申德.癌症易感基因及其所致肿瘤综合征的防治策略[J].癌变·畸变·突变,2002,14(3):202-204.
表11 凝胶时间对内酯豆乳凝胶质构特性的影响(x±SD)Table.11 Effect of gel time on the texture properties of lactone soybean ge(lx±SD)

表12 凝胶时间对内酯牛乳凝胶的质构特性的影响(x±SD)Table.12 Effect of gel time on the texture properties of lactone milk ge(lx±SD)
参考文献
[1]张海悦,焦万龙,郭镧.高纤维内酯豆腐的研制[J].食品科技,2004(3):26-28.
[2]于滨,王喜波.糖类对内酯豆腐质构的影响[J].中国粮油学报,2012,27(7):22-25.
[3]王雪,乔君,刘海波.豆浆加热程度对内酯凝胶强度的影响
[J].农产品加工·学刊,2008(7):106-108.
[4]金嫘,李新华,宿哲然.牛奶内酯豆腐的研制[J].粮油食品科技,2006,14(3):29-30.
[5]李里特,刘志胜.加工条件对豆腐凝胶物品质的影响[J].食品科学,2000(5):26-29.
[6]金嫘,李新华,徐亚平,等.葡萄糖酸-δ-内酯(GDL)对牛乳的凝固及其影响因素的研究[J].食品与发酵工业,2006,32(8):115-118.
Comparative study on component analysis and in vitro functional effects of Xiaguan raw and ripe bowl tea
WANG Rui,ZHAO Xin*
(Department of Biological and Chemical Engineering,Chongqing University of Education,Chongqing 400067,China)
By LC-MS analysis,twelve kinds of components were found in both Xiaguan raw and ripe bowl tea,they weregallic acid,epigallocatechin,catechin,caffeine,epicatechin,epigallocatechin gallate,epicatechin gallate,quercetin-3-galactoside,kaempferol-3-rutinoside,kaempferol-3-glucoside,quercetin,and lutein.After fermentation,resorcylic acid and kaempferol were only found in ripe Xiaguan bowl tea,and the gallic acid and quercetin concentrations were increased in ripe Xiaguan bowl tea.By the functional components increasing,ripe Xiaguan bowl tea showed the better antioxidant,antimutagenicity and anticancer effects than raw Xiaguan bowl tea in using in vitro experiments.
Xiaguan bowl tea;component analysis;LC-MS;antioxidant;anticancer
TS201.1
A
1002-0306(2014)06-0150-06
2013-07-17 *通讯联系人
王睿(1982-),男,硕士研究生,讲师,研究方向:食品加工及工程化。
重庆高校创新团队建设计划资助项目(KJTD201325)。

