表皮生长因子和前列腺素E2在合并幽门螺杆菌感染的胃上皮内瘤变中的作用研究
徐 丹,孙圣斌,黄曼玲,张 姮,吴 杰
2000年,世界卫生组织(WHO)肿瘤新分类,将胃上皮组织形态学上具有一定异型性,在浸润前的肿瘤性改变,即胃上皮恶性肿瘤的前驱病变称为胃上皮内瘤变(gastric intraepithelial neoplasia,GIN),取代了以往异型增生、不典型增生和原位癌等术语。根据细胞异型和结构紊乱程度分为低级别胃上皮内瘤变(low gastric intraepithelial neoplasia,LGIN)和高级别胃上皮内瘤变(high gastric intraepithelial neoplasia,HGIN) 两类,在胃癌的发生过程中胃黏膜的变化是一个由黏膜炎症、LGIN、HGIN、癌变的发展过程。LGIN和HGIN代表着胃黏膜上皮不同程度的瘤变过程[1-2]。慢性胃炎、消化性溃疡、胃癌、胃黏膜相关淋巴样组织淋巴瘤等与幽门螺杆菌(Hp)密切相关[3-4]。众所周知,表皮生长因子(EGF)和前列腺素E2(PGE2)是重要的胃黏膜保护因子。郝英霞等[5]研究发现从慢性浅表性胃炎→慢性萎缩性胃炎→胃癌,血清EGF水平逐渐升高,Hp有升高EGF的作用。而EGF和PGE2在GIN中的作用如何,目前尚不清楚,因此,本研究对EGF和PGE2在合并Hp感染的GIN中的作用进行研究。
1 资料与方法
1.1 临床资料 选取2012年5月—2013年4月武汉市中心医院收治的胃镜下初次行黏膜钳取活检,病理诊断为LGIN的患者82例为研究对象,其中男49例,女33例;年龄32~77岁,平均53.4岁。均排除胃镜或病理诊断为上消化道溃疡、食管癌、胃癌及其他上消化道非上皮性肿瘤者。
1.2 胃镜下分型 采用2003年中华消化内镜学会大连会议制定的慢性胃炎分型分级标准,分为浅表性胃炎、糜烂性胃炎、出血性胃炎、萎缩性胃炎。同时存在多种病变时以主要病变计算。
1.3 病理诊断及炎症的病理分级 胃镜下取5块标本,胃窦2块,取自距幽门2~3 cm 的大弯和小弯;胃体2块,取自距贲门8 cm 的大弯和约距胃角近侧4 cm的小弯;胃角1块,用于组织病理学观察病理。将病理切片进行苏木素-伊红染色,诊断LGIN。按2000版WHO标准进行诊断,LGIN指结构和细胞学异常多发生于上皮下半部;细胞核紧密排列在基底,核染色质密集深染,核增大,分裂象较少,可保持一定极性;腺体结构较不规则,形态较紊乱,可出现背靠背及共壁。根据慢性炎性细胞的密集程度和浸润深度分级,轻度炎症:慢性炎性细胞较少并局限于黏膜浅层,不超过黏膜层的1/3;中度炎症:慢性炎性细胞较密集,超过黏膜层的1/3,达到2/3;重度炎症:慢性炎性细胞密集,超过黏膜层的2/3。
1.4 Hp感染的诊断 快速尿素酶法:于胃窦和胃体各钳取1小块组织,两者均为阳性结果判为Hp阳性,否则为Hp阴性。
本文要点提示——
(1)幽门螺杆菌(Hp)阳性患者血清表皮生长因子(EGF)水平高于Hp阴性患者,但前列腺素E2(PGE2)水平低于Hp阴性患者。血清EGF和PGE2在合并Hp感染的胃上皮内瘤变起一定作用。
(2)浅表性胃炎、糜烂性胃炎、出血性胃炎及萎缩性胃炎患者无论是否感染Hp其血清EGF、PGE2水平比较均无差异。
(3)无论是否感染Hp,胃炎伴低级别胃上皮内瘤变患者,随着炎症程度的加重,血清EGF水平升高,PGE2水平降低。
1.5 血清EGF及PGE2水平测定 患者均隔夜空腹10 h以上取肘静脉血6~8 ml,2 903 r/min(离心半径4 cm) 离心10 min,收集血清。将血清于-70 ℃保存,用于EGF及PGE2水平的测定。EGF检测试剂盒及PGE2检测试剂盒均为美国R&D公司生产,采用酶联免疫吸附试验(ELISA)法,操作按说明书进行,检测血清EGF和PGE2的水平。

2 结果
2.1 胃镜和病理诊断结果 82例患者初次胃镜诊断为浅表性胃炎16例、糜烂性胃炎52例、出血性胃炎9例、萎缩性胃炎5例。病理诊断为慢性炎症伴LGIN,其中轻度炎症34例、中度炎症42例、重度炎症6例。Hp阳性58例,Hp阴性24例。
2.2 Hp阳性和Hp阴性患者血清EGF及PGE2水平比较 Hp阳性患者较Hp阴性血清EGF水平升高,PGE2水平降低,差异均有统计学意义(P<0.05,见表1)。

Table1 Comparison of serum EGF and PGE2 levels in Hp positive and Hp negative patients
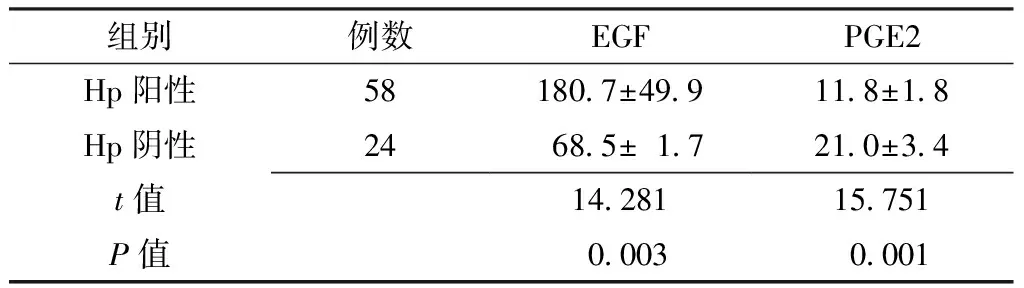
组别例数EGFPGE2Hp阳性581807±499118±18Hp阴性24 685±17 210±34t值1428115751P值 0003 0001
注:EGF=表皮生长因子,PGE2=前列腺素E2
2.3 Hp阳性和Hp阴性不同胃镜下分型患者血清EGF、PGE2水平比较 Hp阳性患者中浅表性胃炎12例、糜烂性胃炎38例、出血性胃炎5例、萎缩性胃炎3例。Hp阳性不同胃镜下分型患者血清EGF、PGE2水平比较,差异无统计学意义(P>0.05,见表2)。Hp阴性患者中浅表性胃炎4例、糜烂性胃炎14例、出血性胃炎4例、萎缩性胃炎2例。Hp阴性不同胃镜下分型患者血清EGF、PGE2水平比较,差异无统计学意义(P>0.05,见表3)。
2.4 Hp阳性和Hp阴性不同病理分级患者血清EGF、PGE2水平比较 Hp阳性患者中轻度炎症24例、中度炎症30例、重度炎症4例。Hp阳性不同病理分级患者血清EGF、PGE2水平比较,差异有统计学意义(P<0.05);其中与轻度炎症患者比较,中度炎症患者和重度炎症患者血清EGF水平升高、PGE2水平降低,差异有统计学意义(P<0.05);与中度炎症患者比较,重度炎症患者血清EGF水平升高、PGE2水平降低,差异有统计学意义(P<0.05,见表4)。
Hp阴性患者中轻度炎症10例、中度炎症12例、重度炎症2例。Hp阴性不同病理分级患者血清EGF、PGE2水平比较,差异有统计学意义(P<0.05);其中与轻度炎症患者比较,中度炎症患者和重度炎症患者血清EGF水平升高、PGE2水平降低,差异有统计学意义(P<0.05);与中度炎症患者比较,重度炎症患者血清EGF水平升高、PGE2水平降低,差异有统计学意义(P<0.05,见表5)。

Table2 Comparison of serum EGF and PGE2 levels in Hp positive patients with different endoscopic classifications

分型例数EGFPGE2浅表性胃炎121921±509115±14糜烂性胃炎381753±458118±20出血性胃炎51876±668114±20萎缩性胃炎31919±858134±12F值08270919P值05340438

Table3 Comparison of serum EGF and PGE2 levels in Hp negative patients with different endoscopic classifcations
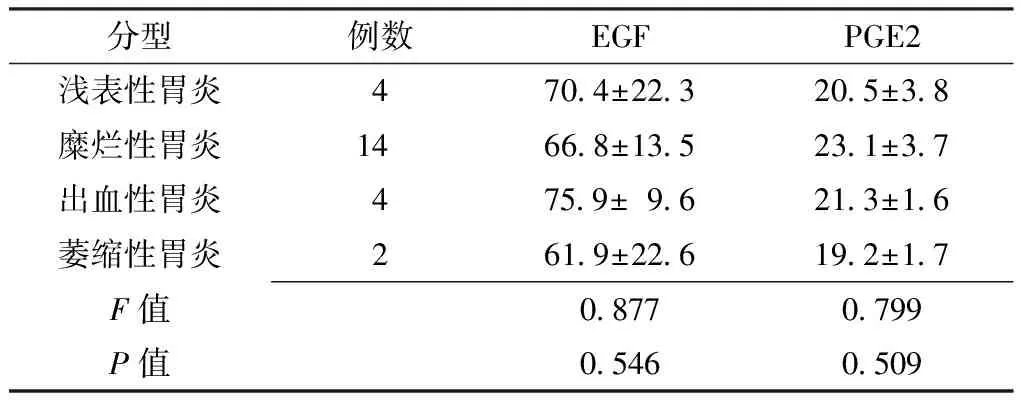
分型例数EGFPGE2浅表性胃炎4704±223205±38糜烂性胃炎14668±135231±37出血性胃炎4759±96213±16萎缩性胃炎2619±226192±17F值08770799P值05460509

Table4 Comparison of serum EGF and PGE2 levels in Hp positive patients with different pathological grading
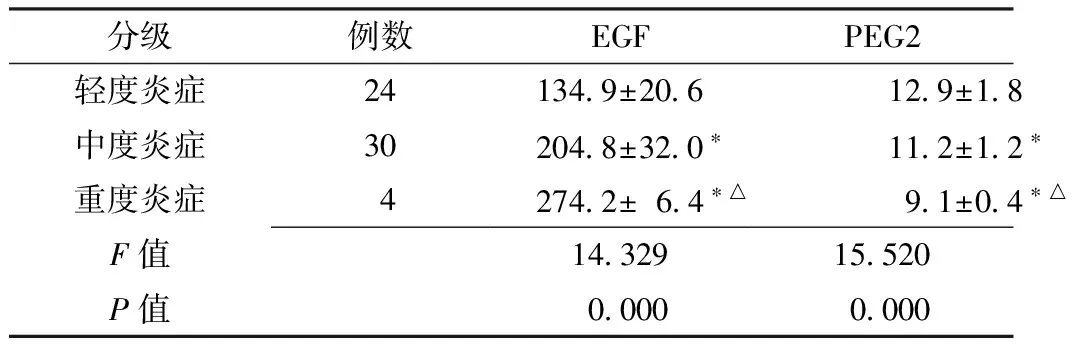
分级例数EGFPEG2轻度炎症241349±206129±18中度炎症302048±320∗112±12∗重度炎症42742±64∗△91±04∗△F值1432915520P值00000000
注:与轻度炎症比较,*P<0.05;与中度炎症比较,△P<0.05

Table5 Comparison of serum EGF and PGE2 levels in Hp negative patients with different pathological grading

分级例数EGFPEG2轻度炎症10545±114219±39中度炎症12772±44∗203±24∗重度炎症2865±106∗△197±67∗△F值1467512321P值00210038
注:与轻度炎症比较,*P<0.05;与中度炎症比较,△P<0.05
3 讨论
EGF是一种能刺激或抑制多种细胞增殖和分化的多肽。EGF可以刺激上皮细胞中mRNA、 DNA以及蛋白质的合成,促进黏膜上皮的增生[6-7]。在慢性萎缩性胃炎大鼠中,EGF水平明显升高,血清PGE2和胃泌素水平明显降低,同时慢性萎缩性胃炎大鼠EGF水平的升高与表皮生长因子受体(EGFR)高表达有关[8-10]。EGF和EGFR在胃癌中有很强的表达[11]。EGF基因过度表达或拷贝数增加能促进正常细胞的转化。癌旁组织或不典型增生细胞和肿瘤细胞的过渡区有EGF异常表达,肿瘤细胞分泌因子刺激肿瘤周围的细胞表达EGF,从而使周围的正常组织,细胞等逐渐向恶性表型转化[12]。
有研究显示Hp感染和高盐饮食为GIN的致病因素,这与胃癌的发病机制和肿瘤演进过程是一致的[13-14]。Hp感染可使上皮细胞增生活跃,其增殖超出正常水平1倍以上。根除Hp后,其增殖水平恢复正常。新近研究也表明Hp可通过促进上皮细胞的凋亡而刺激代偿增生过程[15-16]。本研究中,Hp阳性率达70.7%(58/82),推测Hp可能参与GIN的发病。Hp阳性患者EGF水平高于Hp阴性患者,且随着炎症程度的加重,EGF水平逐渐上升。Hp感染引起GIN患者EGF 水平升高与胃黏膜炎症程度有一定的关系,Hp对胃黏膜的损伤,引起的炎症越重,对EGF的促分泌作用越明显。合并Hp感染GIN患者EGF参与胃黏膜炎症的发生,可能由于Hp引起局部黏膜反复炎症,刺激血清中EGF分泌增加,从而刺激胃黏膜上皮细胞的分裂、增殖,进而导致胃黏膜上皮增生产生GIN。
PGE2为目前公认的细胞保护因子,能通过抑制胃酸分泌,增加黏膜血流,使已受损的胃黏膜修复[17-18]。本研究中Hp阳性患者PGE2水平低于Hp阴性患者,随着内镜下炎症程度加重,PGE2水平逐渐下降。Hp可以引起较重的炎性反应,Hp对黏膜上皮的直接作用,使胃黏膜炎性细胞数量增加,同时产生大量的炎性递质,损伤细胞免疫功能,同时也影响胃黏膜的分泌功能,这可能是本研究所见Hp阳性GIN患者PGE2减少的原因之一。
本研究所有病例的初次胃镜诊断中,糜烂性胃炎占慢性胃炎的63.4%(52/82),浅表性胃炎、出血性胃炎和萎缩性胃炎共占36.6%(30/82),说明多种类型的胃炎均可能发生GIN,以糜烂性胃炎居多,但是在不同类型的胃炎中,EGF及PGE2水平没有差异。而随着炎症程度加重,EGF及PGE2水平差异显著,胃镜下分型与炎症程度的进展不是一定相伴发生,其机制需要进一步研究。
因血液中EGF水平过度升高,而主要作为局部激素的PGE2水平升高相对不足,从而引起胃黏膜上皮细胞的过度增生导致GIN。在合并Hp感染的情况下EGF参与二次打击,造成胃黏膜损害加重,存在矫枉过正现象,这种矫枉过正也可能是合并Hp感染胃炎容易发生GIN的重要机制之一。GIN患者胃黏膜慢性炎症程度与EGF分泌升高和PGE2分泌相对不足有关。血清EGF和PGE2在合并Hp感染的GIN患者胃黏膜损伤中起一定作用,为预防Hp感染造成胃黏膜损伤加重应尽早根除Hp。HGIN具备与肿瘤细胞相类似的生物学特征,有发展为肿瘤细胞的潜在趋势,临床上多采取手术或内镜下切除等方式从而达到治疗目的。而LGIN经过药物及保守治疗,部分可以逆转。因此,本研究将LGIN作为研究对象,研究EGF和PGE2在合并Hp感染的GIN患者中的作用,为GIN癌变的预防提供了参考依据。
1 Fassan M,Pizzi M,Farinati F,et al.Lesions indefinite for intraepithelial neoplasia and OLGA staging for gastric atrophy[J].Am J Clin Pathol,2012,37(5):727-732.
2 陈思杰,邹清云,黄中华,等.食管鳞状上皮低级别上皮内瘤变的随访研究[J].中国全科医学,2010,13(2):531.
3 Kato M,Asaka M.Recent development of gastric cancer prevention[J].Jpn J Clin Oncol,2012,42(11):987-994.
4 Takeuchi T,Umegaki E,Takeuchi N,et al.Strategies for peptic ulcer healing after 1 week proton pump inhibitor-based triple Helicobacter pylori eradication therapy in Japanese patients:differences of gastric ulcers and duodenal ulcers[J].J Clin Biochem Nutr,2012,51(3):189-195.
5 郝英霞,乔占涛,孙璐,等. Hp相关胃炎患者血清表皮生长因子(EGF)和β-微球蛋白(β-MG) 水平研究[J]. 河北职工医学院学报,2003,20(1):1-4.
6 Jiang L,Lan T,Chen Y,et al.PKG Ⅱ inhibits EGF/EGFR-induced migration of gastric cancer Cells[J].PLoS One,2013,8(4):e61674.
7 张志勇,孙公凯,杨世忠.表皮生长因子在消化性溃疡中的研究进展[J].海南医学院学报,2010,16(3):388-390.
8 Lin HY,Zhao Y,Yu JN,et al.Effects of traditional Chinese medicine Wei-Wei-Kang-Granule on the expression of EGFR and NF-κB in chronicatrophic gastritis rats[J].Afr J Tradit Complement Altern Med,2011,9(1):1-7.
9 Fujiyama S,Matsubara H,Nozawa Y,et al.Angiotensin AT(1) and AT(2) receptors differentially regulate angiopoietin-2 and vascular endothelial growth factorexpression and angiogenesis by modulating heparin binding-epidermal growth factor(EGF)-mediated EGF receptor transactivation[J].Circ Res,2001,88(1):22-29.
10 任守忠,何书华,郭建生,等.胃泌素、生长抑素、表皮生长因子及炎性细胞因子与大鼠慢性胃炎相关性研究[J].海南医学院学报,2011,17(2):165-168.
11 田云霄,张小辉.表皮生长因子受体及其与胃癌的关系研究[J].实用心脑肺血管病杂志,2012,20(5):920.
12 Baek MK,Kim MH,Jang HJ,et al.EGF stimulates uPAR expression and cell invasiveness through ERK,AP-1,and NF-kappaB signaling in human gastric carcinoma cells[J].Oncol Rep,2008,20(6):1569-1575.
13 Okumura T,Ericksen RE,Takaishi S,et al.K-ras mutation targeted to gastric tissue progenitor cells results in chronic inflammation,an altered microenvironment,and progression to intraepithelial neoplasia[J].Cancer Res,2010,70(21):8435-8445.
14 Lofgren JL,Whary MT,Ge Z,et al.Lack of commensal flora in Helicobacter pylori-infected INS-GAS mice reduces gastritis and delays intraepithelial neoplasia[J].Gastroenterology,2011,140(1):210-220.
16 Song MY,Su HJ,Zhang L,et al.Genetic polymorphisms of miR-146a and miR-27a,H.pylori infection,and risk of gastric lesions in a Chinese population[J].PLoS One,2013,8(4):e61250.
17 Slomiany BL,Slomiany A.Induction in gastric mucosal prostaglandin and nitric oxide by Helicobacter pylori is dependent on MAPK/ERK-mediated activation of IKK-β and cPLA2:modulatory effect of ghrelin[J].Inflammopharmacology,2013,21(3):241-251.
18 Gyires K,Németh J,Zádori ZS.Gastric mucosal protection and central nervous system[J].Curr Pharm Des,2013,19(1):34-39.

