试卤灵类光学探针的研究进展
李 照,马会民
(中国科学院 化学研究所 活体分析化学重点实验室,北京100190)
光学探针是指与目标物质发生反应(包括配位、包合、基团反应等)并引起光学(吸光、荧光或发光)性质的变化,从而可对目标物质进行分析与测定的一类特殊试剂[1]。其特点是通过向无或低光学响应的物质提供光学基团,使原先无法或难于进行的光学分析变得可能。这种光学分析除了在传统的光学、色谱衍生等领域获得广泛应用外,目前已成为生命科学中深入了解各种生理参数、生物分子的变化,进而揭示生理功能的重要传感与分析工具[2-6]。由于性能优良的光学探针是构筑相应光学分析方法的物质基础和根本,因此,新型光学探针的研究一直受到人们的关注。试卤灵为一性能优良的荧光体。它具有发射波长长、光稳定性好、荧光量子产率高等优点,特别是其7-羟基的取代作用通常会封闭光信号。这一特性近年引起了人们的兴趣,并被广泛用于发展具有低背景光信号的新型探针。
本文将简要综述试卤灵类光学探针的发展及其在蛋白酶、离子、活性氧物种分析方面的应用,包括探针分子的设计、检测机理以及生物成像等方面的研究,以展望此类探针的发展趋势与应用前景。
1 试卤灵荧光体的性质
试卤灵属氧杂蒽类荧光染料,其化学名称为7-羟基吩恶嗪酮,英文俗名为resorufin。它的7-羟基可以发生解离,其pKa=5.8,故试卤灵的吸收光谱和荧光光谱对弱酸性pH较为敏感[7,8],例如,当pH值从4升至7时,荧光逐渐增强。然而,当pH>7时,试卤灵主要以阴离子形式存在,其溶液呈粉红色并显示强的红色荧光,最大吸收波长在574nm左右(伴有535nm肩峰),最大发射波长位于585nm,量子产率达0.75,且这些光谱性质几乎不再随pH 而改变[7,8]。因此,试卤灵在生理pH范围内其光信号是稳定的。
除了分析波长长、受样品背景干扰少、水溶性和生物兼容性好等优点外,试卤灵及其衍生物还具有良好的细胞膜通透性和分散性[8,9]。更重要的是,试卤灵分子中7-位酚羟基的取代作用通常会导致荧光猝灭、且颜色变浅(一般呈淡黄色),但当这些取代基与相关物质作用而移除后,则又会释放出试卤灵,从而伴随其颜色和荧光的恢复[2,8]。人们利用这一特性以及试卤灵的其它优点,通过在7-羟基上设置不同的识别单元,发展了一系列新的光信号打开型探针(图1),并用于生物、环境等样品中相关物质的检测与成像分析,取得了良好的效果。
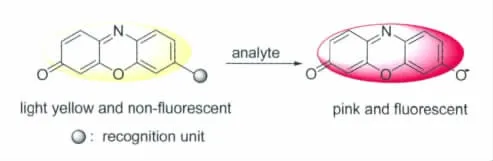
图1 试卤灵类光学探针的响应Response of resorufin-based spectroscopic probe
2 检测蛋白酶活性的试卤灵类光学探针
蛋白酶可选择性与其底物反应。基于这一性质,并借助多米诺消除反应等,通过合理设计识别单元并将其引入到试卤灵的7-羟基,人们已成功发展了检测单胺氧化酶、硝基还原酶、β-半乳糖苷酶、α-葡萄糖苷酶、β-内酰胺酶、酯酶以及乙酰胆碱酯酶的高灵敏度光学探针。以下将分别给予简要介绍。
单胺氧化酶(monoamine oxidase,MAO)是一种重要的脑疾病治疗靶点。MAO可催化单胺(R-NH2)发生氧化脱氨反应,即在有氧参与下,MAO可催化单胺氧化,继而生成相应的醛、氨和过氧化氢。Chang等[10]利用这一反应,合成了两种试卤灵类光学探针(1和2;图2),并用于类神经元细胞中单胺氧化酶的活性检测。
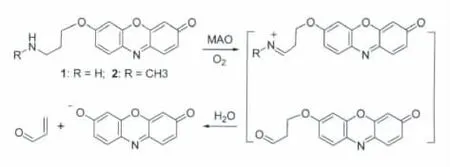
图2 单胺氧化酶光学探针1和2Spectroscopic probes 1 and 2 for MAO activity
硝基还原酶(nitroreductase)可利用还原型烟酰胺腺嘌呤二核苷酸(NADH)等作为电子供体,在缺氧条件下催化多种外源硝基芳香族化合物发生单电子转移,生成硝基阴离子自由基,随后进一步被还原生成氨基或羟胺。这一反应不仅用在药物的激活和解毒研究中,还可用于光学探针的设计和实体瘤细胞缺氧状况的检测。最近,Ma等[11,12]以试卤灵为母体,5-硝基呋喃、5-硝基噻吩作为底物,设计合成了两种检测硝基还原酶的光学探针3和4(图3),其中探针4具有更低的背景信号(这是由于5-硝基噻吩表现出更强的猝灭效应)。这些探针本身荧光均很弱且几乎无色,但在NADH存在下,硝基还原酶可将探针中的硝基还原为氨基或羟胺,并发生1,6-重排与消除反应,从而释放出试卤灵荧光体,导致溶液荧光显著增强、颜色由无色变成紫红色。而且,这些探针对细胞中的不同还原性物质(如谷胱甘肽、半胱氨酸,维生素C等)均无响应。据此特性,构建了高灵敏度、高选择性的检测硝基还原酶的荧光分析法,并成功用于HeLa和A549细胞缺氧成像分析以及大肠杆菌生长过程中硝基还原酶的检测。
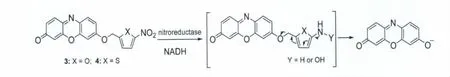
图3 探针3和4与硝基还原酶的反应机理Reaction mechanism of probes 3 and 4 with nitroreductase
β-半乳糖苷酶(β-galactosidase)是一种能将β-半乳糖苷水解为半乳糖和糖苷的酶。它还能催化β-D-半乳糖残基的水解。Sernetz等[13]利用这一特性,发展了一种检测β-半乳糖苷酶的荧光探针5(图4)。该探针与β-半乳糖苷酶反应可释放出强荧光的试卤灵,从而可用于该酶的灵敏检测。
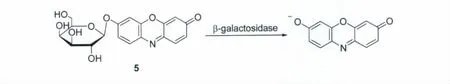
图4 β-半乳糖苷酶催化探针5的水解Hydrolysis of probe 5 byβ-galactosidase
α-葡萄糖苷酶(α-glucosidase)也是一类重要的水解酶,并参与生物体的糖代谢。如果人类和哺乳动物组织中α-葡萄糖苷酶缺失,就会引起庞贝氏症(又称酸性麦芽糖酵素缺乏症),所以发展检测α-葡萄糖苷酶的分析方法对于该类疾病的早期诊断非常重要。Zheng等[14]利用α-葡萄糖苷酶可以专一性水解糖类底物分子中的α-1,4糖苷键,设计合成了检测该酶活性的荧光探针6(图5)。该探针与酶作用同样释放出试卤灵,伴随反应体系的荧光增强。基于该现象,构建了检测α-葡萄糖苷酶活性的荧光分析法,并可用于该酶抑制剂的高通量筛选。

图5 α-葡萄糖苷酶催化探针6的水解Hydrolysis of probe 6 byα-glucosidase
β-内酰胺酶(β-lactamase)可以催化水解β-内酰胺类抗生素的β-内酰胺环,使其丧失抗菌活性。因此,β-内酰胺酶的分析检测对药物研究以及疾病治疗十分重要。Rao等[15]利用β-内酰胺酶可水解β-内酰胺环的反应,制备了检测该酶活性的荧光探针7(图6)。该探针已用于β-内酰胺酶基因表达的成像分析与研究。
酯酶是人们研究的较多的一种水解酶,它能催化酯键的水解。最近,Ma等[8]和Raines等[16]分别发展了检测羧酸酯酶的荧光探针8和9(图7);其中,探针8的荧光强度与酶的浓度在0.04~0.30U/mL的范围内成良好的线性关系,检测限达到8.6×10-5U/mL,比现有的羧酸酯酶类探针更为灵敏。探针8和9与羧酸酯酶作用后,均能释放出具有强荧光的试卤灵,使体系的荧光得以恢复。这些探针已用于活细胞的荧光成像分析。
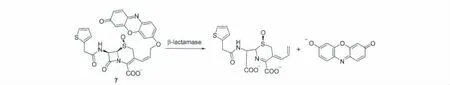
图6 β-内酰胺酶催化探针7的水解Hydrolysis of probe 7 byβ-lactamase

图7 探针8和9的结构Structures of probes 8 and 9
乙酰胆碱酯酶(AChE)可选择性水解乙酰胆碱,生成胆碱和乙酸。该酶在神经信号传递过程中扮演着重要的角色。Zhang等[17]利用串联化学反应,发展了一种含有2,4-二硝基苯磺酸酯键识别单元的光学探针10,可用于AChE的活性检测。当AChE浓度为0.001U/mL时,探针仍能产生明显的响应。检测体系由探针10和碘化乙酰硫代胆碱(ATC)的磷酸盐缓冲溶液(pH 8)组成,反应机理如图8所示。当AChE加入到该体系后,AChE会催化ATC生成硫代胆碱和乙酸;由于硫代胆碱分子含有巯基,可进一步与探针10发生反应并导致试卤灵的释放和反应体系的荧光恢复。然而,探针10受其它巯基物质(如半胱氨酸和谷胱甘肽)的干扰。
3 检测离子的试卤灵类光学探针
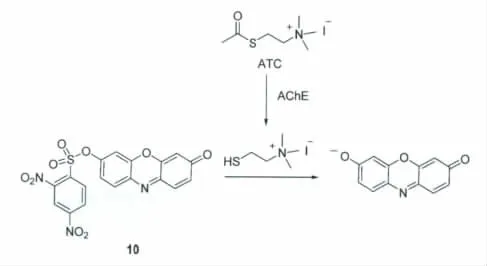
图8 探针10检测乙酰胆碱酯酶的机理The detection mechanism of AChE activity by probe 10
以试卤灵为荧光体,并借助选择性水解切断、保护-脱保护等化学反应,人们还发展了一些检测金属离子和阴离子的新型光学探针;其中,部分探针的分析性能与已有的探针相比得到了显著改善。例如,设计Pb2+的选择性光学探针颇具挑战性,因为过渡金属离子经常共存,且与通常的荧光试剂反应性能相近,彼此干扰严重。为克服此困难,Ma等[18]利用Pb2+能选择性催化水解磷酸二酯键的特性,以POCl3为桥联剂,将试卤灵荧光体与猝灭剂p-硝基苯酚联接,制得了新的检测Pb2+的光学探针11(图9)。该探针由于可发生分子内光诱导电子转移作用而导致荧光自猝灭,仅表现出较弱的荧光;然而,铅离子的引入可选择性催化探针中的磷酸酯键水解而断裂,从而使试卤灵得以释放、荧光得到恢复。研究表明,在磷酸盐缓冲溶液(pH 8)中,该探针对 Pb2+的检测限为22 nmol/L,且常见的各种碱土金属与过渡金属离子均无影响,对Pb2+的选择性很高。
Wei等[19]利用 Hg2+可催化吡喃烯醇醚生成环己酮衍生物的重排反应(成碳环反应),设计合成了一种含有糖结构单元的水溶性光学探针12(图10)。在磷酸盐缓冲溶液(pH 7.4)中,该探针与Hg2+产生很高的选择性光学响应(Ag+及其它金属离子均无此作用),反应在15min内即可完成 ,对Hg2+的 检测限达0.1 5μmol/L。此 外,该探针还被用于A549细胞和斑马鱼中Hg2+的荧光成像分析。

图10 检测Hg2+的光学探针12Spectroscopic probe 12 for Hg2+
最近,Kim 等[20]利用Pd2+对炔丙基的识别作用,设计合成了探针13用于Pd2+检测(图11);反应是在含80%甲醇的磷酸盐缓冲溶液(pH 7.4)中进行的。研究表明,在炔丙基醚的邻位引入噻吩甲基胺单元后,能很好的提高探针与Pd2+的反应速度。探针13对Pd2+有很好的选择性,对其它金属离子无明显响应,检测限为0.05μmol/L。
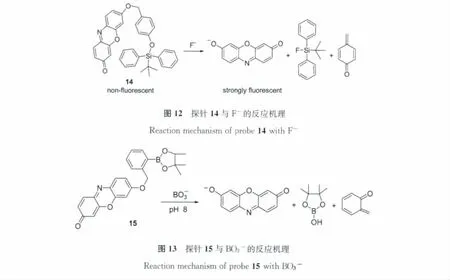
Hong等[21]利用F-可选择性切断Si—O键的原理,设计合成了探针14(图12)。该探针本身无荧光,但在含50%乙腈的水溶液中与F-反应后,生成了强荧光的试卤灵,使体系的荧光得到恢复。探针对F-的选择性良好,对 Cl-、Br-、I-、AcO-、H2PO4-、HSO4-、NO3-、N3-均无明显响应。
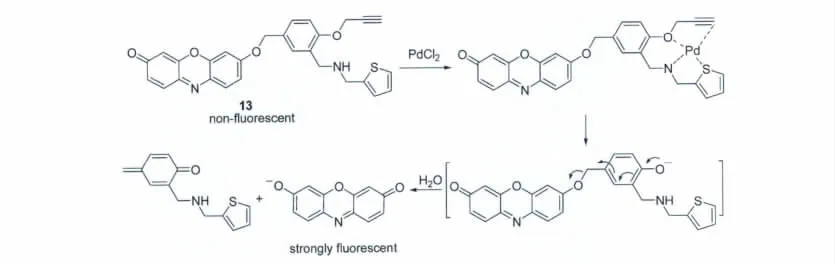
图11 探针13与PdCl2的反应机理Reaction mechanism of probe 13 with PdCl2
过硼酸钠能直接引起有机体突变,并且过硼酸钠或其它硼化合物对人体健康和环境的危害性已引起了人们的关注。因此,硼化合物的分析检测十分重要。Ma等[22]利用过硼酸根离子(BO3-)的去硼化作用,发展了新型光学探针15(图13)。该探针可对BO3-产生快速和灵敏的显色及荧光响应。而且,该探针还可用于过氧化苯甲酰的检测,即在含10%乙醇的KH2PO4-Na2HPO4缓冲溶液(20mmol/L,pH 7.4)中,探针15可与过氧化苯甲酰产生灵敏的光学响应,其中荧光分析的检测限达23nmol/L。此外,该探针还用于发展过氧化苯甲酰快速检测试剂盒,在面粉和抗菌剂等实际样品中过氧化苯甲酰的检测方面具有重要的应用前景。
Chang等[23]基于BO3-可选择性切断乙酸酯键的原理,利用商品化的探针16(图14),实现了对BO3-的检测。该探针本身无荧光,但在含10%乙腈的乙酸-乙酸钠缓冲溶液(pH 4.8)中与BO3-反应后,生成了强荧光的试卤灵,使体系的荧光恢复。该探针对BO3-有很好的选择性,其它常见的阴离子均无明显响应。

图14 检测BO3-的探针16Probe 16 for BO3-
探针17是借助乙酰丙酸基的保护-脱保护作用 而 设 计(图1 5)。该 探 针 可 用 于SO32-的 检测[24]。探针本身无荧光,但在含2%乙腈的4-羟乙基哌嗪乙磺酸缓冲溶液(pH 7)中与SO32-反应后,产生荧光反应,且其它常见阴离子均无明显响应,对SO32-具有良好的选择性。

图15 探针17与SO32-的反应机理Reaction mechanism of probe 17 with SO32-
4 检测活性氧物种的试卤灵类光学探针
活性氧物种(ROS)是指具有高反应活性的含氧物种,包括过氧化氢、次氯酸、超氧阴离子、羟基自由基、单线态氧、一氧化氮、臭氧等[2,25]。活性氧物种在维持生物体的生理功能方面发挥着重要的作用。高于正常水平的活性氧物种会损伤蛋白质、DNA等生物分子,进而导致疾病。因此,发展活性氧物种的高选择性、高灵敏度光学探针与检测方法,对疾病的预防、诊断和治疗均具有重要意义。
Chang等[26]利用硼酸酯为识别单元,以试卤灵为信号单元,设计合成了检测过氧化氢的光学探针18(图16)。该探针在4-羟乙基哌嗪乙磺酸缓冲溶液(pH 7)中只对过氧化氢有很好的荧光响应,而其它的活性氧物种几乎不响应。荧光成像研究发现,该探针能用于活细胞内过氧化氢的检测。

图16 检测H2O2的探针18Probe 18 for H2O2
Milligan等[27]发展了一种检测羟基自由基的探针19(图17)。该探针可与羟基自由基反应生成强荧光的试卤灵,因而可用于羟基自由基的检测。

图17 探针19与 ·OH的反应Reaction of probe 19 with·OH
臭氧(O3)是氧的同素异形体,也是活性氧物种之一。在大气中,臭氧层可吸收太阳释放出来的绝大部分紫外线,使动、植物免遭这种射线的危害,对地球生物具有重要的保护作用。另一方面,当环境中臭氧浓度偏高时,则成为环境污染气体,也是PM2.5的组分之一,在杀灭细菌的同时也对人体细胞构成损伤;在紫外灯、打印机旁,都应注意通风,避免臭氧浓度过高引起的毒性效应。换句话说,臭氧的检测是一个重要的课题。然而,目前检测臭氧的光学探针相对较少。Ma等[28]以试卤灵作为光信号响应单元,以可与臭氧发生特异性加成反应的丁烯基作识别单元,设计合成了对臭氧具有高选择性、高灵敏度的光信号打开型探针20(图18)。该探针对臭氧的检测限为0.056mg/m3,低于国际环境空气质量的标准(0.1mg/m3),目前已用于细胞中臭氧的荧光成像和空气样品中臭氧的分析测定。

图18 探针20与O3的反应机理Reaction mechanism of probe 20 with O3
5 结论
综上所述,由于试卤灵的性能优良,特别是其分子结构中的7-位酚羟基的修饰通常可猝灭荧光,目前该荧光体越来越受到人们的重视,并成为发展具有低背景光信号探针、进而实现相关分析物质高灵敏检测的有效途径之一。预计今后该方面的研究热点可能集中在以下两方面:(1)对试卤灵的结构进行改造,合成出具有更多修饰位点的母体化合物,以用于该类光学探针的进一步发展。例如,可将分子结构中的碳氮双键进行还原,然后对形成的氨基进行化学修饰,来构建相应的新型光学探针;(2)目前检测活性氧物种的试卤灵类光学探针报道较少,因此,设计合成此类物种的检测探针有待于深入开展。总之,随着更多的反应机理被发现,人们一方面将会不断设计出新的试卤灵类光学探针,另一方面通过改变现有的光学探针的反应和分析条件以扩大其应用范围。
[1] Shi W,Ma H M.Spectroscopic probes with changeableπconjugated systems[J].Chemical Communications,2012,48(70):8732-8744.
[2] Li X H,Gao X H,Shi W,et al.Design strategies for water-soluble small molecular chromogenic and fluorogenic probes[J].Chemical Reviews,2013,ASAP(doi:10.1021/cr300508p).
[3] 邱 波,于天君,陈金平,等.水相氟离子“turn-on”型荧光传感器[J].影像科学与光化学,2013,31(5):383-389.Qiu B,Yu T J,Chen J P,et al.A rapid aqueous fluoride anion sensor with turn-on fluorescence mode[J].Imaging Science and Photochemistry,2013,31(5):383-389.
[4] 胡 睿,郭旭东,杨国强.激发态分子内质子转移化合物的性能及作为荧光化学传感器的应用研究[J].影像科学与光化学,2013,31(5):335-348.Hu R,Guo X D,Yang G Q.Investigation on the property of the excited state intramolecular proton transfer compounds and its application as fluorescence chemical sensor[J].Imaging Science and Photochemistry,2013,31(5):335-348.
[5] Kim H N,Guo Z,Zhu W,et al.Recent progress on polymer-based fluorescent and colorimetric chemosensors[J].Chemical Society Reviews,2011,40:79-93.
[6] Chen X Q,Sun M,Ma H M.Progress in spectroscopic probes with cleavable active bonds[J].Current Organic Chemistry,2006,10:477-489.
[7] Bueno C,Villegas M L,Bertolotti S G,et al.The excitedstate interaction of resazurin and resorufin with amines in aqueous solutions.Photophysics and photochemical reaction[J].Photochemistry Photobiology,2002,76(4):385-390.
[8] Zhang Y Y,Chen W,Feng D,et al.A spectroscopic off-on probe for simple and sensitive detection of carboxylesterase activity and its application to cell imaging[J].Analyst,2012,137:716-721.
[9] 宋延超,刘俊秀,张阳阳,等 纳米材料在生物分析应用中存在的若干问题[J].化学学报,2013,71:1607-1610.Song Y C,Liu J X,Zhang Y Y,et al.Some problems of nanomaterials in bioanalytical applications[J].Acta Chimica Sinica,2013,71:1607-1610.
[10] Albers A E,Rawls K E,Chang C J.Activity-based fluorescent reporters for monoamine oxidases in living cells[J].Chemical Communication,2007,4647-4649.
[11] Li Z,Li X H,Gao X H,et al.Nitroreductase detection and hypoxic tumor cell imaging by a designed sensitive and selective fluorescent probe,7-[(5-nitrofuran-2-yl)methoxy]-3H-phenoxazin-3-one[J].Analytical Chemistry,2013,85:3926-3932.
[12] Li Z,Gao X H,Shi W,et al.7-((5-Nitrothiophen-2-yl)methoxy)-3H-phenoxazin-3-one as a spectroscopic off-on probe for highly sensitive and selective detection of nitroreductase[J].Chemical Communication,2013,49:5859-5861.
[13] Hofmann J,Sernetz M.Immobilized enzyme kinetics analyzed by flow-through microfluorimetry:resorufin-β-D-galactopyranoside as a new fluorogenic substrate forβ-galactosidase[J].Analytica Chimica Acta,1984,163:67-72.
[14] Motabar O,Shi Z D,Goldin E,et al.A new resorufinbasedβ-glucosidase assay for high-throughput screening[J].Analytical Biochemitry,2009,390:79-84.
[15] Gao W,Xing B,Tsien R Y,et al.Novel fluorogenic substrates for imaging lactamase gene expression[J].Journal of American Chemical Society,2003,125:11146-11147.
[16] Lavis L D,Chao T Y,Raines R T.Synthesis and utility of fluorogenic acetoxymethyl ethers[J].Chemical Science,2011,2:521-530.
[17] Cui K,Chen Z L,Wang Z,et al.A naked-eye visible and fluorescence"turn-on'probe for acetyl-cholinesterase assay and thiols as well as imaging of living cells[J].Analyst,2011,136:191-195.
[18] Sun M,Shangguan D H,Ma H M,et al.Simple PbIIfluorescent probe based on the PbII-catalyzed hydrolysis of phosphodiester[J].Biopolymers,2003,72:413-420.
[19] Ma X,Wang J,Du Y,et al.A"Turn-on"fluorescent Hg2+chemosensor based on ferrier carbocyclization[J].Organic Letters,2012,14:820-823.
[20] Ren W X,Pradhan T,Yang Z,et al.Rapid responsive palladium sensor under mild condition[J].Sensors and Ac-tuators B,2012,171-172:1277-1282.
[21] Kim S Y,Hong J I.Chromogenic and fluorescent chemodosimeter for detection of fluoride in aqueous solution[J].Organic Letters,2007,9:3109-3112.
[22] Chen W,Li Z,Shi W,et al.A new resorufin-based spectroscopic probe for simple and sensitive detection of benzoyl peroxide via deboronation[J].Chemical Communication,2012,48:2809-2811.
[23] Choi M G,Cha S,Park J E,et al.Selective perborate signaling by deprotection of fluorescein and resorufin acetates[J].Organic Letters,2010,12:1468-1471.
[24] Choi M G,Hwang J,Eor S,et al.Chromogenic and fluorogenic signaling of sulfite by selective deprotection of resorufin levulinate[J].Organic Letters,2010,12:5624-5627.
[25] 陈 巍,马会民.检测活性氧物种的氧杂蒽类光学探针的研究进展[J].分析化学,2012,40(9):1311-1321.Chen W,Ma H M.Progress in xanthene-based spectroscopic probes for reactive oxygen species[J].Chinese Journal of Analytical Chemistry,2012,40(9):1311-1321.
[26] Miller E W,Tulyathan O,Isacoff E Y,et al.Molecular imaging of hydrogen peroxide produced for cell signaling[J].Nature Chemical Biology,2007,3:263-267.
[27] Newton G L,Milligan J R.Fluorescence detection of hydroxyl radicals[J].Radiation Physics and Chemistry,2006,75:473-478.
[28] Zhang Y Y,Shi W,Li X H,et al.Sensitive detection of ozone by apractical resorufin-based spectroscopic probe with extremely low background signal[J].Scientific Reports,2013,3:2830.

