无功能性垂体瘤术后垂体功能的变化及激素替代治疗
张彦杰 张 慧 王卿峰 韩 东 祝启海
1.焦作市第二人民医院神经外科,河南焦作 454001;2.焦作市第二人民医院内分泌科,河南焦作 454001
无功能性垂体瘤术后垂体功能的变化及激素替代治疗
张彦杰1张 慧2王卿峰1韩 东1祝启海1
1.焦作市第二人民医院神经外科,河南焦作 454001;2.焦作市第二人民医院内分泌科,河南焦作 454001
目的探讨无功能垂体瘤术后垂体功能变化及替代治疗后下丘脑-垂体-靶腺轴功能的重建规律。方法回顾性分析2004年1月—2011年12月期间36例无功能垂体瘤患者的临床资料,将受试者分为3组:A组:垂体瘤完全切除;B组:垂体瘤大部分或部分切除;C组:垂体瘤大部或部分切除并行垂体放疗。放疗在垂体瘤术后1个月开始。根据术后垂体功能进行激素替代治疗,采用激发试验评估垂体功能,包括胰岛素诱发的低血糖试验,TSH刺激试验和GnRH兴奋试验。所有患者分别在术前、术后3 d、3个月、半年及1年进行随访,以后每年随访1次。结果患者于术后1年垂体前叶功能完成了重建。术前GH低下的比例明显高于F、TSH、LH、FSH低下的比例(66.7%VS 22.2%、11.1%、25.0%、30.6%),随访终点时仍显示GH低下的患病率最高(36.1%)。术后F低下的比例低于TSH、LH、FSH低下的患病率(19.4%VS 22.2%、30.6%、30.6%、30.6%)。随访结束时A组患者没有出现垂体前叶功能减退;B组间断出现新的垂体功能的损伤;C组于随访结束时垂体功能减退的发生率最高。结论术后进行垂体放疗的无功能垂体瘤患者需要长期进行内分泌功能的评估;而肿瘤完全切除且术后1年没有发生垂体功能减退,则不必长期进行内分泌随访。
无功能垂体瘤;垂体前叶功能;手术;放疗;长期随访
无功能垂体瘤患者主要的临床表现是视力改变和视野受损,事实上几乎所有的患者均伴随有不同程度的内分泌功能紊乱。既往有研究报道无功能垂体瘤患者术后可出现视力改变、短期垂体前叶功能变化[1]。从发现垂体肿瘤、手术切除及术后内分泌功能的变化,这些因素无一不影响到患者的生活质量。长期随访无功能垂体瘤患者术后垂体前叶功能的变化非常重要,为探讨无功能垂体瘤术后垂体功能变化及替代治疗后下丘脑-垂体-靶腺轴功能的重建规律。该研究回顾性分析2004年1月—2011年12月期间36例无功能垂体瘤患者的临床资料,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析在该科住院并行手术治疗的无功能垂体瘤患者36例,其中男性19例,女性17例,平均年龄(51±19)岁,所有受试者分别于术后3个月、6个月、1年入院进行评估,以后每年住院评估 1次,平均随访时间(3.5±1.9)年。患者入院前的症状包括:视野缺损27例,头痛6例,意外瘤 3例。其中经蝶手术 26例,经颅手术10例。肿瘤完全切除20例,大部切除10例,部分切术6例。8例术后进行鞍区放疗,其中大部切除术6例,部分切除2例。予以直线加速治疗,总剂量50 Gy,2 Gy/d,每周5 d。放疗于术后1个月开始。根据手术切除范围及术后治疗方式,将人群分为3组:A组:垂体瘤完全切除(20例),其中男11例(55%),平均年龄(50±20)岁;B组:垂体瘤大部分或部分切除(8例),其中男4例(50%),平均年龄(52±19)岁;C组:肿瘤大部切除或者部分切除并行术后垂体放疗(8例),其中男4例(55%),平均年龄(50±18)岁。3组人群肿瘤体积大小分别为:(20±7.6)、(33±8.9)和(35±9.5)mm,3组之间的肿瘤大小差异有统计学意义(P<0.05)。
1.2 研究方法
A、B、C 3组的所有患者分别在术前、术后3 d、3个月、半年及1年进行垂体前叶功能评估,以后每年评估1次,同时C组于术后1个月开始放疗。低血糖兴奋试验评估GH、皮质醇的储备功能;GnRH兴奋试验评估LH和FSH的储备功能;由于第4代TSH测定方法的出现,已经能够鉴别中枢性甲状腺功能减退,因此没有进行TRH兴奋试验。垂体肾上腺轴的评估以皮质醇代替了ACTH。血清GH、皮质醇、TSH、LH、FSH及PRL采用化学发光法测定。高泌素血症是由于病变累及垂体柄,促使泌乳素抑制因子(PIF)释放增加。垂体功能低下是指激素基础值很低或者在激发试验中反应低下;垂体功能重建是指基础激素水平恢复正常,或者激发试验出现正常反应。术后出现肾上腺或者甲状腺功能低下的,分别予以糖皮质激素或者甲状腺激素替代,并在试验前停药。
1.3 实验方法
1.3.1 低血糖兴奋试验 空腹状态下进行,抽取0分钟静脉血后,予以生物合成人胰岛素注射液 R(商品名:诺和灵R,生产厂家:Novo Nordisk A/S,批号:国药准字J20100041)0.1~0.15 IU/kg iv(胰岛素0.1~0.15 u/kg iv,)然后分别于注射后30 min、60 min、90 min、120 min抽血化验皮质醇、生长激素,病人多在注射后15~45
min发生低血糖,对症状严重者在取血后静脉注射50%葡萄糖注射液40 mL,提前终止试验。
1.3.2 GnRH兴奋实验 实验于空腹状态下进行,实验前抽取静脉血,予以戈那瑞林(商品名:戈那瑞林,国药准字H10960063)10 μg溶于2 mL生理盐水中,静脉注射后,15 min、30 min、45 min、60 min、90 min分别抽血化验LH、FSH。
1.4 统计方法
采用SPSS17.0统计学软件对数据进行分析,计量资料采用均数±标准差()表示,计数资料采用百分比(率)表示,3组之间连续性变量采用单因素方差分析,率的比较采用χ2检验。
2 结果
2.1 术后病变部位的随访结果
A组没有出现肿瘤复发,B组出现3(37%)例复发,2例进行二次手术。C组有2(25%)例出现复发,没有进行二次手术。
2.2 术前及随访结束时垂体功能评估情况
术前及随访结束后时分别进行激发试验评估垂体-甲状腺轴、肾上腺轴、性腺轴和生长激素的储备功能,结果表明术前3组之间的GH、F、TSH、LH、FSH、PRL异常的发生率进行χ2检验后差异有统计学意义(P<0.05),随访终点各组之间上述各指标仍差异有统计学意义(P<0.001)。但是A组的患者随访结束时垂体功能基本完全恢复正常水平,C组随访结束时垂体前叶功能减退的比例明显高于A组合B组,和术前相比,C组随访结束时垂体-肾上腺轴、垂体-甲状腺轴、垂体-性腺轴和生长激素发生功能减退的比例明显升高。见表1。
2.3 各组激素替代治疗情况
C组激素替代治疗的发生率最高,A组随访结束时基本无需替代治疗,B组激素替代治疗的比例小于C组,但是>A组,3组之间进行χ2检验差异有统计学意义(P<0.05)。
2.4 垂体功能重建的情况
A组于术后1年完成了垂体功能重建。A组术后1年没有出现新发的垂体前叶功能减退;B组部分患者由于垂体瘤生长,间断出现新的垂体功能损伤;C组不论有无肿瘤生长,随着随访时间的延长,垂体前叶功能减退的比例越来越高。

表1 3组之间及总体人群术前和术后激素异常的情况[n(%)]
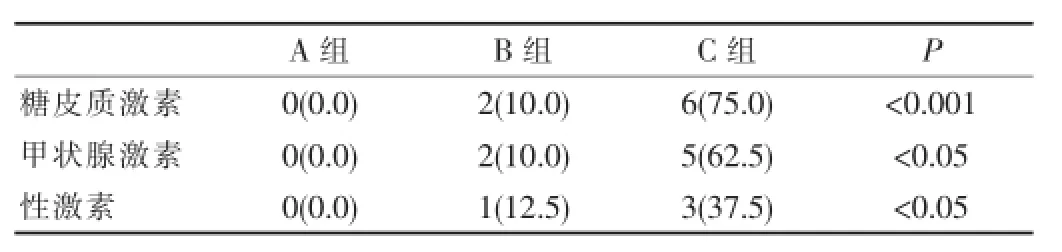
表2 随访结束时三组之间激素替代治疗的情况[n(%)]
3 讨论
垂体腺瘤是一种常见的临床肿瘤,在正常人群随机MRI检查时发现垂体腺瘤的几率为10%~38.5%(平均22.5%)[2],生长激素分泌功能受损的比例都远远高于其它垂体前叶激素,该研究结果显示术前GH低下的比例明显高于F、TSH、LH、FSH低下的比例(66.7%VS 22.2%、11.1%、25.0%、30.6%),随访终点时仍显示GH低下的患病率最高(36.1%),这和蒋[3]报道的研究结果相一致。该研究结果表明术后F低下的比例低于低TSH、LH、FSH的发生率(19.4%VS 22.2%、30.6%、30.6%、30.6%),提示垂体-肾上腺轴(HPA)功能重建的比例要高于其它轴系,这和Tominaga的研究结果相一致[4]。该研究HPA轴功能重建的发生率比较高的原因可能和本试验方法有一定的相关性,因为胰岛素诱发的低血糖刺激试验不需要通过下丘脑,而是直接刺激垂体分泌ACTH[5],这可能在一定程度上提高了试验的灵敏性,C组在随访结束时发生垂体前叶功能减退的比例最高,GH、F、TSH、LH、FSH低下的比例分别为:100%、67.5%、62.5%、100%和100%,而且远远高于术前这些激素低下的比例,考虑术后垂体功能低下比例升高的原因和垂体放疗相关,因为放疗起效的时间较晚,作用缓慢,随着时间的延长,发生垂体前叶功能减退的比例越高,放疗后10年几乎所有的患者都会出现垂体前叶功能减退症,这与既往的研究结果相一致[6-7]。
该研究有以下几点发现:①垂体功能重建大约需要1年的时间,如果1年后垂体功能仍未恢复,可能患者发生了永久性垂体功能减退。重建的时间一般在术后3个月~1年之间,如果没有出现肿瘤的复发,那么1年后基本不用继续随访并评估垂体功能;②是否进行周期性内分泌的随访和评估取决于治疗方式。A组由于肿瘤完整切除,随着随访时间延长,垂体前叶功能基本完全恢复重建。B组合C组的肿瘤体积无明显差别,但是术后垂体功能的恢复结局差异明显,原因在于C组术后进行了垂体放疗,发生垂体前叶功能减退的比例明显升高;③垂体瘤手术未完全切除接受放疗时,即使肿瘤没有复发,数年后仍有多数出现垂体前叶功能减退。术后放疗有助于预防垂体肿瘤的复发,很多专家推荐此疗法,但是不可避免的带来了垂体前叶功能减退。因此术后接受垂体放疗的患者,需要长期随访并评估垂体功能。有研究者认为,术后放疗不仅可以影响到垂体的分泌功能,还有可能损伤下丘脑的功能,造成垂体促激素的分泌功能受损[8-9]。
目前对于垂体前叶功能减退替代治疗的药物主要是氢化可
的松(没有条件时可以选用强的松)和左旋甲状腺素,尽管生长激素分泌功能受损的发生率比较高,但是由于市场上生长激素价格昂贵,因此生长激素替代治疗的人群并不多。但是随着对疾病认识的逐渐深入及经济水平的提高,目前会有更多的患者接受生长激素替代治疗,还需要更多此方面的临床试验,寻找合适的替代剂量。
综上所述,该研究表明术后接受垂体放疗的,建议进行长期内分泌功能的随访,肿瘤完全切除的患者如果术后1年没有出现垂体前叶功能减退,则不必继续进行内分泌随访。
[1]Halvorsen H,Ramm-Pettersen J,Josefsen R,et al.Surgical complications after transsphenoidal microscopic and endoscopic surgery for pituitary adenoma:a consecutive series of 506 procedure[J].Acta neurochirurgica,2014,156(3):441-449.
[2]Ammirati M,Wei L,Ciric I.Short-term outcome of endoscopic versus microscopic pituitary adenoma surgery:a systematic review and metaanalysis[J].Journal of neurology,neurosurgery,and psychiatry,2013,84(8): 843-849.
[3]蒋翠萍.垂体瘤术后成人生长激素缺乏症的临床研究[J].中国临床医学,2011,3(18):369-370.
[4]Tominaga A,Uozumi T,Arita K,et al.Anterior pituitary function in patients with nonfunctioning pituitary adenoma:results of longitudinal follow-up[J].Endocrine journal,1995,42(3):421-427.
[5]Yuen KC,Amin R,Cook MB,et al.Evaluation of the pituitary function with insulin tolerance(hypoglycaemia)testing:are there any differences using insulin lispro compared to regular insulin[J].Hormone research, 2008,69(4):233-239.
[6]潘绵顺,王鹏,牛朝诗.功能性垂体腺瘤放疗[J].立体定向和功能性神经外科杂志,2008,21(2):121-125.
[7]付晓红,周培志,尹森林,等.垂体瘤术后垂体功能变化及激素替代[J].四川大学学报:医学版,2013,44(3):448-451.
[8]Pollock BE.Comparing radiation therapy and radiosurgery for pituitary adenoma patients[J].World neurosurgery,2012,78(1-2):58-59.
[9]Kopp C,Theodorou M,Poullos N,et al.Tumor shrinkage assessed by volumetric MRI in long-term follow-up after fractionated stereotactic radiotherapy of nonfunctioning pituitary adenoma[J].International journal of radiation oncology,biology,physics,2012,82(3):1262-1267.
R4
A
1674-0742(2014)08(a)-0036-03
2014-05-04)
张彦杰(1979-),男,河南焦作人,本科,主治医师,主要从事头颅肿瘤和头颅外伤。

