微波辅助提取葛根黄酮的工艺研究
王端,周鸿翔,田娅玲,柳荫,陈龙,吴凤智,邱树毅*
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省发酵工程与生物制药重点试验室,贵州贵阳550025)
微波辅助提取葛根黄酮的工艺研究
王端1,2,周鸿翔1,2,田娅玲1,2,柳荫1,2,陈龙1,2,吴凤智1,2,邱树毅1,2*
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省发酵工程与生物制药重点试验室,贵州贵阳550025)
以葛根为原料,乙醇为溶剂,采用微波辅助提取葛根总黄酮。考察了溶剂体积分数、固液比、提取时间、微波功率以及提取次数对提取液葛根总黄酮含量的影响。并在单因素试验的基础上,进行4因素3水平的中心组合试验,通过响应面分析优化确定葛根总黄酮的提取工艺。结果表明,在乙醇体积分数56%、固液比1∶25、提取时间31s、微波功率539W、提取次数为2次的条件下总黄酮含量最高,模型预测值可达7.26mg/g,实际验证值为7.32mg/g。
微波辅助提取;葛根;黄酮;响应面;优化试验
葛根为豆科多年生落叶藤本植物野葛或粉葛的块根或块状茎,素有“亚洲人参”的美誉,性凉、味甘、辛,具有清热解毒、解表利便之功效[1-2]。我国卫生部2002年正式公布葛根为“药食同源植物”,并为中国药典所收载[3],其药用价值在李时珍《本草纲目》中已有所记载。葛根中有效成分主要是黄酮类物质,包括葛根素、葛根苷元、葛根苷等,具有降低血管阻力、增加脑流量、改善脑及冠脉循环、增强机体免疫能力等功效,同时具有明显的抗自由基作用以及用于酒精中毒导致肝损伤的治疗等功能[4-5]。
目前葛根黄酮作为许多解酒药物和保健食品的主要功能成分越来越受到普遍重视,而高品质葛根黄酮的获得主要依赖于对传统提取方法的改良和工艺条件的优化。近年来,微波辅助萃取技术在天然产物有效成分的提取方面得到广泛应用,利用微波对细胞的破壁和加热作用,可加速细胞内有效成分的快速溶出[6]。与传统方法相比,微波具有穿透力强、选择性高、加热效率高、提取时间较短等特点[7]。本试验采用微波辅助提取法,研究相关因素对葛根黄酮提取率的影响,用响应面设计筛选出最佳的提取工艺参数,从而为以黄酮为原料的药物和保健品的生产提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
葛根块状根:市售,粉碎后过80目筛,密封冷冻保存。
葛根素标准品:中国药品生物制品检定所;无水乙醇、体积分数为95%乙醇(分析纯):成都金山化学试剂有限公司。
1.2 仪器与设备
MJ-60BE01B高速万能粉碎机:广东美的精品电器制造有限公司;MM721NH1-PW微波炉:广东美的微波电器制造有限公司;80-2电动离心机:常州澳华仪器有限公司;UV-2550紫外可见分光光度计:苏州仪器有限责任公司;FA2004N电子精密天平:上海菁海仪器有限公司。
1.3 试验方法
1.3.1 葛根黄酮的提取工艺流程
葛根→粉碎→过80目筛→乙醇浸提→提取液4 000r/min离心20min→分离取上清液→波长250nm处测定吸光度值→计算总黄酮含量
1.3.2 提取液中总黄酮含量的测定
(1)葛根素标准曲线的绘制[8]
准确称取于120℃干燥至质量恒定的葛根素标准品5.00mg于10mL小烧杯中,加入适量的体积分数95%乙醇充分溶解,然后转移至25mL容量瓶中,加体积分数95%乙醇定容,充分摇匀即得0.20mg/mL的葛根素标准溶液。依次吸取上述标液2mL、4mL、6mL、8mL、10mL分别置5个10mL容量瓶中,加体积分数95%乙醇补足至1.0mL,再加蒸馏水稀释定容。同时以体积分数95%乙醇1.0mL,用蒸馏水稀释至10mL作为空白对照,用紫外可见分光光度计在波长250nm处分别测定其吸光度值。以葛根素浓度(C)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线。
(2)总黄酮含量的测定
将过滤后的葛根提取上清液定容至100mL,准确吸取4mL溶液于10mL容量瓶中,用体积分数95%乙醇定容;吸取1mL溶液置于10mL容量瓶中,加蒸馏水稀释定容;同样以体积分数95%乙醇1mL,用蒸馏水稀释至10mL,作为空白对照,用紫外可见分光光度计在波长250nm处测定吸光度值,然后由标准曲线计算出待测葛根样品的总黄酮含量。总黄酮含量定义为提取每克葛根粗粉所提取到的总黄酮质量数,mg。
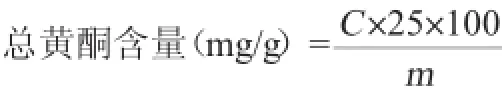
式中:C为总黄酮质量浓度,mg/mL;25为每毫升黄酮提取液的稀释倍数;100为过滤后所得上清液的定容体积,mL;m为葛根粗粉的质量,g。
1.3.3 单因素试验
选取不同的乙醇体积分数、固液比、微波时间、微波功率和提取次数,按葛根黄酮提取方法进行单因素试验,考察各单因素对黄酮提取率的影响。
1.3.4 中心组合试验
以单因素试验结果为依据,设计乙醇体积分数、固液比、提取时间、微波功率的4因素3水平的中心组合试验。以黄酮含量为响应值,采用响应面分析法确定提取最佳工艺条件。中心组合试验因素水平编码表如表1所示。

表1 响应面试验因素水平编码Table 1 Factors and levels of response surface methodology
2 结果与分析
2.1 葛根素标准曲线的绘制
以葛根素标准品浓度为横坐标,测得的吸光度值为纵坐标,绘制的葛根素标准曲线如图1所示。所得线性回归方程和相关系数分别为y=76.414x+0.013 5,相关系数R2= 0.999 6;式中y为吸光度值,x为总黄酮质量浓度,mg/mL。结果表明,在葛根素质量浓度为0.004~0.020mg/mL范围内,线性关系良好。
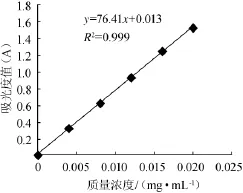
图1 葛根素标准曲线Fig.1 Standard curve of puerarin
2.2 单因素试验结果
2.2.1 乙醇体积分数对总黄酮含量的影响
称取2g经干燥粉碎至80目的葛根粗粉于平底烧瓶中,按照料液比为1∶20的比例加入体积分数为40%、50%、60%、70%、80%的乙醇40mL,在微波功率为385W,时间为40s的条件下进行微波提取,结果如图2所示。
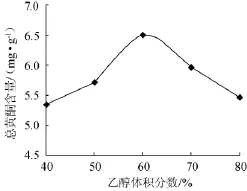
图2 乙醇体积分数对总黄酮含量的影响Fig.2 Effect of ethanol volume fraction on total flavonoids content
从图2可以看出,随着乙醇体积分数的增加,提取液总黄酮含量先增后减,且在体积分数为60%时,总黄酮含量达到最大。这是因为乙醇对黄酮的溶解度比水大,对细胞的破坏作用比水强[9],乙醇体积分数过高或过低均不利于总黄酮的提取;此外,随乙醇体积分数的增大,部分脂溶性黄酮一并提取,但当乙醇体积分数较大时,水溶性黄酮的溶解度降低,不利于提取,总黄酮含量下降[10]。所以提取的最佳乙醇体积分数为60%。
2.2.2 固液比对总黄酮含量的影响
称取2g经干燥粉碎至80目的葛根粗粉于平底烧瓶中,按固液比为1∶10、1∶15、1∶20、1∶25、1∶30的比例加入体积分数为60%的乙醇,在微波功率为385W,时间为40s的条件下进行微波提取,结果如图3所示。
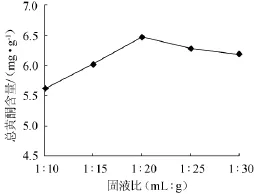
图3 固液比对总黄酮含量的影响Fig.3 Effect of solid-liquid ratio on total flavonoids content
从图3可以看出,随着液体量的增加,总黄酮含量呈现先增大后缓慢减小的趋势,固液比为1∶20时,黄酮含量达到最大。这是因为当液体量在一定范围内时,黄酮含量的高低与黄酮向溶剂中扩散有关,固液比较小,两相界面间的浓度差小,不利于黄酮的扩散;但当固液比较大时,黄酮质量浓度下降,已浸出的黄酮不利于未浸出的黄酮的协同浸提,因而总黄酮含量反而降低[9]。因此,微波提取的最佳固液比为1∶20。
2.2.3 微波时间对总黄酮含量的影响
称取2g经干燥粉碎至80目的葛根粗粉于平底烧瓶中,按料液比为1∶20的比例加入体积分数为60%的乙醇40mL,在微波功率为385W,作用时间分别为20s、30s、40s、50s、60s的条件下进行微波提取,结果如图4所示。

图4 提取时间对总黄酮含量的影响Fig.4 Effect of extraction time on total flavonoids content
从图4可以看出,总黄酮含量随着提取时间的延长先缓慢增大后迅速降低,40s时达到最大。这是因为微波的作用机制是微波直接作用于分子,使分子的热运动加剧,从而引起温度升高,一定时间之后可以使细胞破裂完全,使细胞内的有效成分更快的分离浸提出来[11];但长时间处理可能导致葛根中的黄酮类物质结构遭到破坏从而使黄酮含量下降。因此,微波提取的最佳时间为40s。
2.2.4 微波功率对总黄酮含量的影响
称取2g经干燥粉碎至80目的葛根粗粉于平底烧瓶中,按料液比为1∶20的比例加入体积分数为60%的乙醇40mL,提取时间为40s,在微波功率分别为119W、231W、385W、539W、700W的条件下进行微波提取,结果如图5所示。
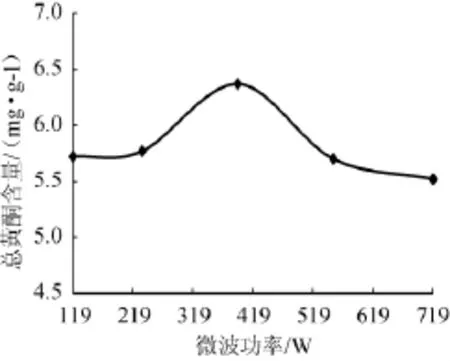
图5 微波功率对总黄酮含量的影响Fig.5 Effect of microwave power on total flavonoids content
从图5可以看出,随着微波功率的增加,黄酮含量先增后减,且在385W时达到最大。这是因为随着微波功率的增加,加热速率增大,分子运动速度加快,黄酮类物质的含量增大;但微波功率过大时,一方面强热效应破坏了溶液中已有的黄酮成分;另一方面微波功率过大导致的高温使蛋白质凝固,黄酮成分不易破壁溶出[12-13]。因此,微波萃取的最佳功率为385W。
2.2.5 提取次数对总黄酮含量的影响
称取2g经干燥粉碎至80目的葛根粗粉于平底烧瓶中,按料液比为1∶20的比例加入体积分数为60%的乙醇40mL,在微波功率为385W,时间为40s的条件下分别提取1、2、3、4、5次,结果如图6所示。

图6 提取次数对总黄酮含量的影响Fig.6 Effect of extraction times on total flavonoids content
从图6可以看出,总黄酮含量随着提取次数的增加而增大,但在提取2次之后升高幅度基本趋于稳定。因此,为节约成本和简化试验,将微波提取的次数选定为2次。
2.3 响应面试验结果与分析
2.3.1 试验结果与方差分析
根据Box-Behnken的中心组合试验设计原理[14-15],综合单因素影响试验结果,选取乙醇体积分数(A)、固液比(B)、提取时间(C)、微波功率(D)4个因素为自变量,以总黄酮含量(Y)为目标函数,采用4因素3水平的响应面分析方法进行试验设计,其试验设计及结果如表2所示。采用Design Expert统计软件对试验结果进行响应面回归分析,回归方程的方差显著性检验分析结果如表3所示。
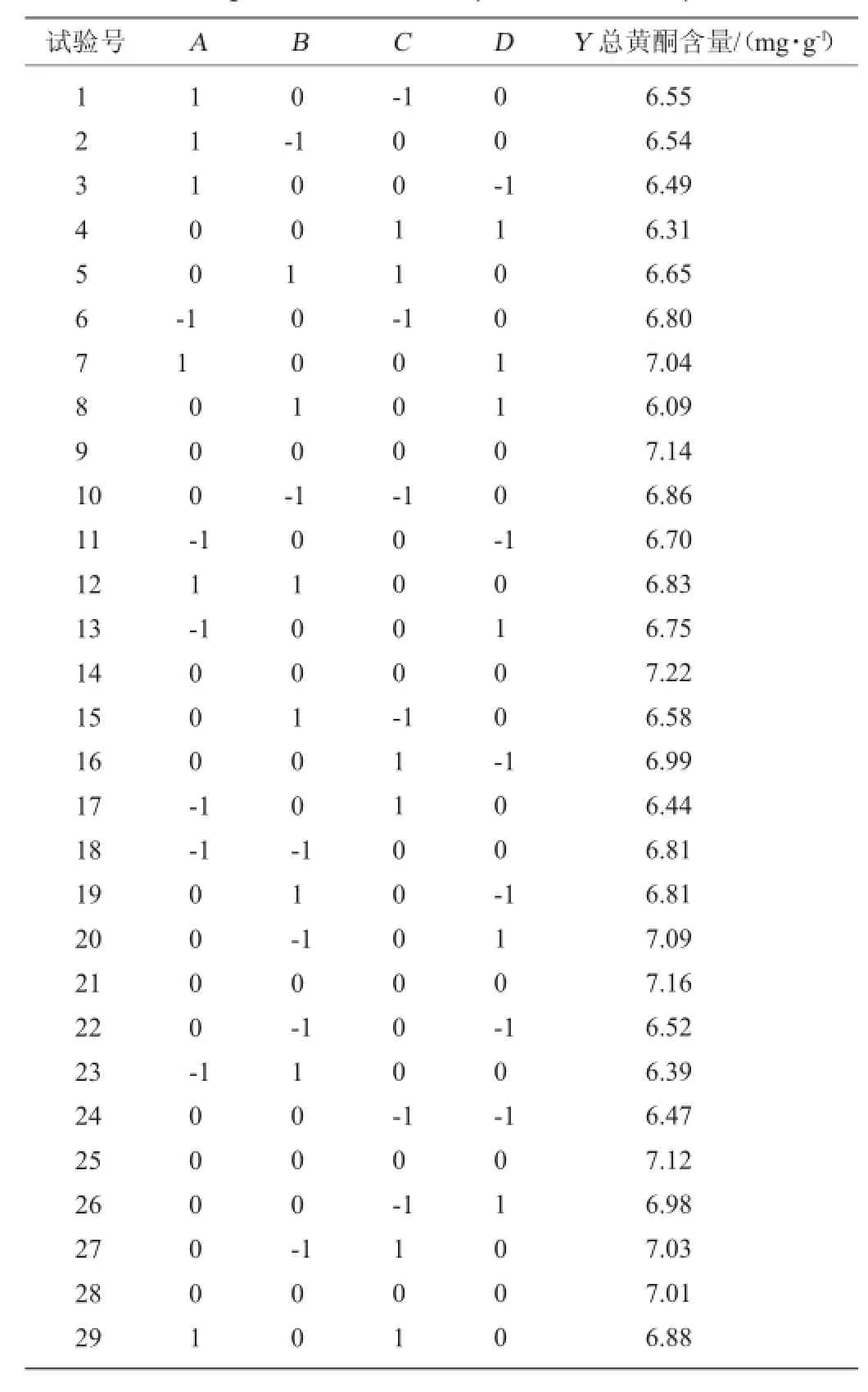
表2 响应面试验设计及结果Table 2 Design and results of response surface experimental
由表3可以看出,一次项中,各因素对总黄酮含量的影响由大到小依次为固液比>乙醇体积分数>微波功率>提取时间,其中固液比的影响极显著(P<0.01);二次项中A、B、C、D对总黄酮含量的影响都达到极显著水平(P<0.01);交互项中,AB、AC、BD、CD均对葛根总黄酮含量有显著的影响(P<0.05),而AD、BC之间的交互作用不显著。
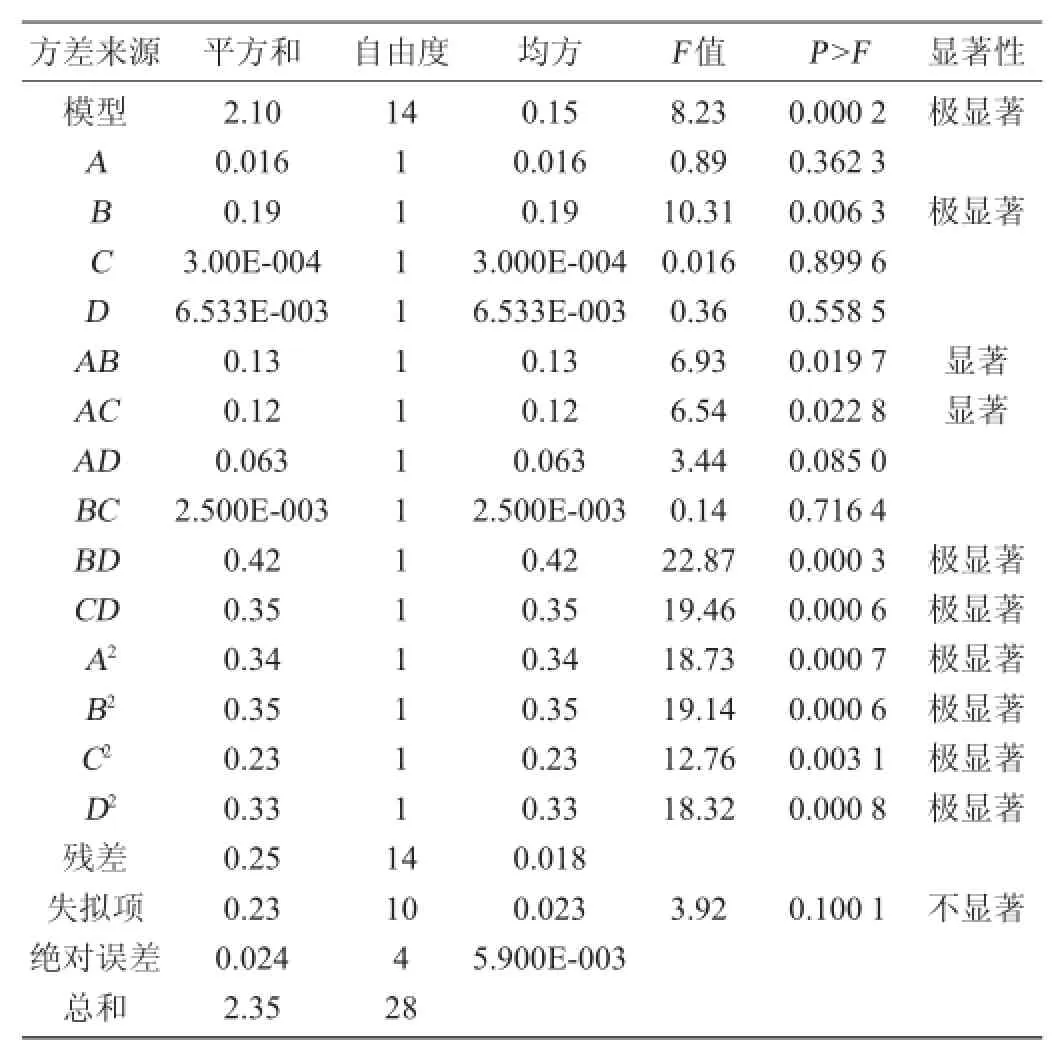
表3 回归方程方差分析Table 3 Variance analysis of regression equation
以A、B、C、D为自变量,葛根总黄酮含量Y(mg/g)为响应值,建立二次响应面回归模型,经Design-Expert 7.0软件对表3试验数据进行多元回归拟合后,得回归方程:

从表4可知,以总黄酮含量为响应值时,模型P=0.000 2< 0.01,表明该二次方程模型显著。同时失拟项P=0.100 1< 0.05,表示响应面试验结果和数学模型拟合良好,即可以使用该数学模型推测试验结果。
2.3.2 响应面分析
根据回归模型作出相应的响应面和等高线见图7~图12,比较2组图的响应面最高点和等高线可知,在所选范围内存在极值,即响应面最高点,同时也是等高线最小椭圆的中心点。
由图7可知,乙醇体积分数和固液比对总黄酮含量有交互影响,随着乙醇体积分数的增加、固液比的增大,总黄酮含量先增后减。当乙醇体积分数约为60%、固液比约为1∶20时,响应值可达到较高值。
由图8可看出,乙醇体积分数和提取时间对总黄酮含量的交互影响与图8相比较,对响应值交互影响的范围相对比较窄。在乙醇体积分数约为60%,提取时间约为40s时总黄酮含量可达最佳。
由图9可看出,随着乙醇体积分数的增加、微波功率的增大,总黄酮含量先增后减,但变化不很显著,且A、D对响应值交互影响的范围窄。在乙醇体积分数约为60%,微波功率约为385W时可达到响应值最高点。
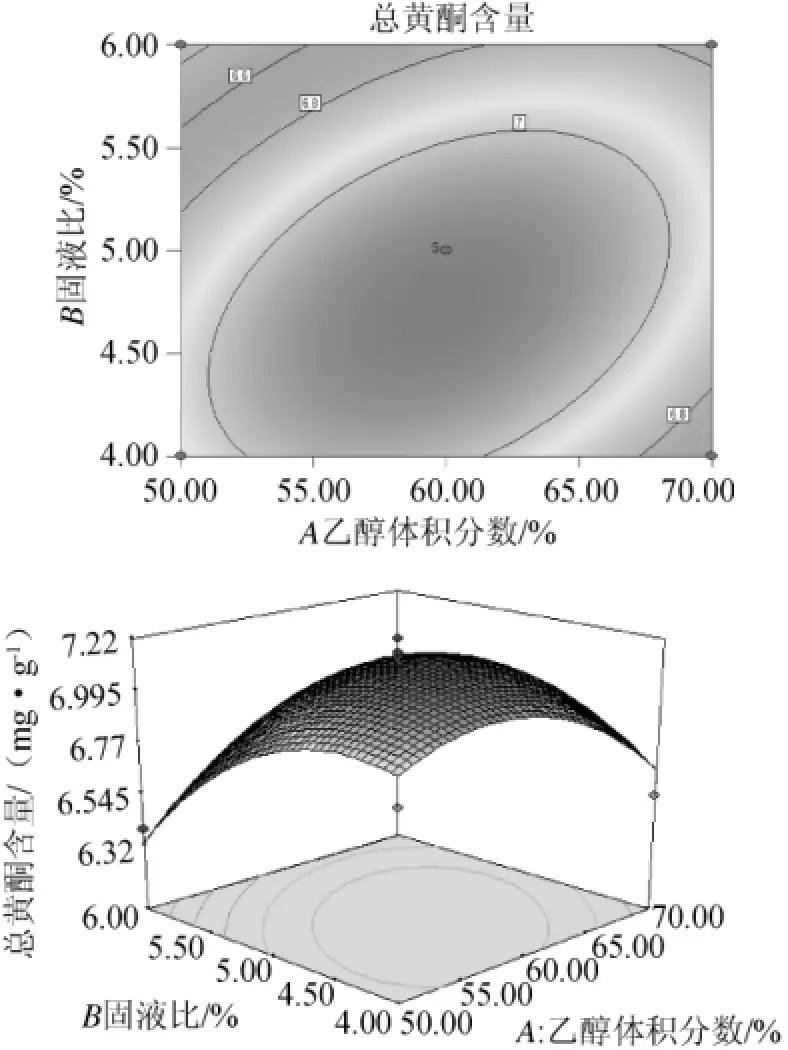
图7 乙醇体积分数和固液比对黄酮提取率影响的相应曲面及等高线Fig.7 Response surface plot and contour line of interaction between ethanol volume fraction and solid to liquid ratio on flavonoid extraction ratio
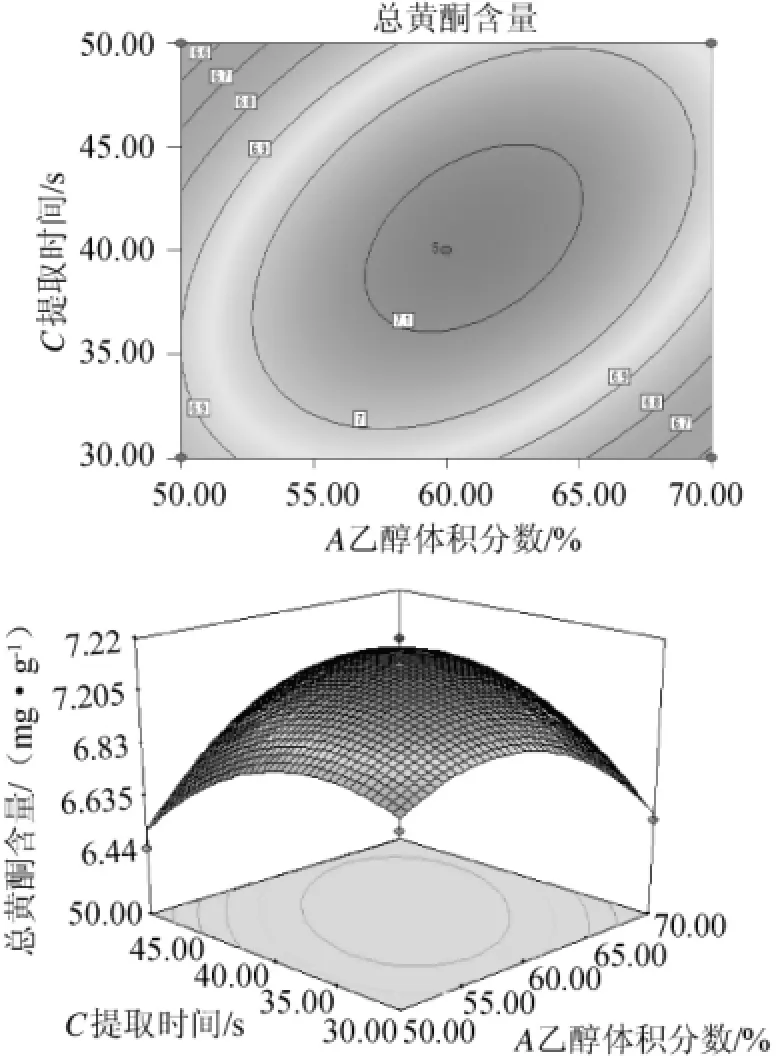
图8 乙醇体积分数和提取时间对黄酮提取率影响的相应曲面及等高线Fig.8 Response surface plot and contour line of interaction between ethanol volume fraction and extraction time on flavonoid extraction ratio
由图10可看出,随着固液比的增加,提取时间的延长,总黄酮含量先增后减,但变化不太明显。因此,从成本考虑溶剂加入量要适宜。
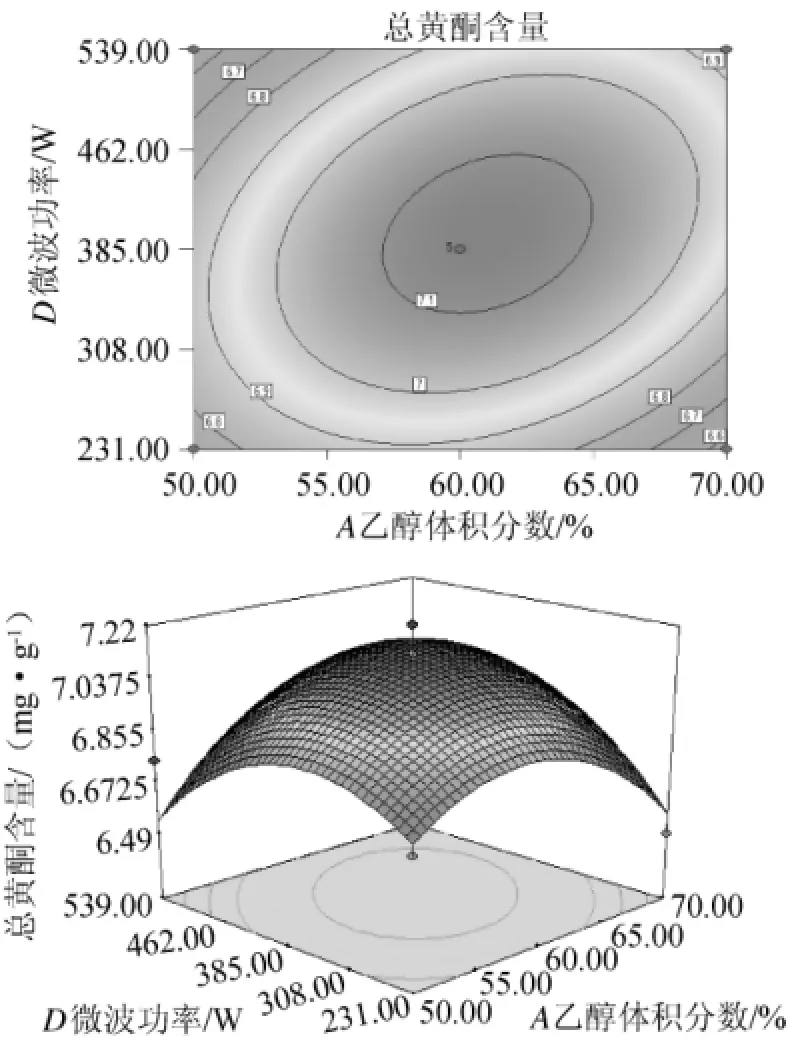
图9 微波功率和乙醇体积分数对黄酮提取率影响的相应曲面及等高线Fig.9 Response surface plot and contour line of interaction between microwave power and ethanol volume fraction on flavonoid extraction ratio
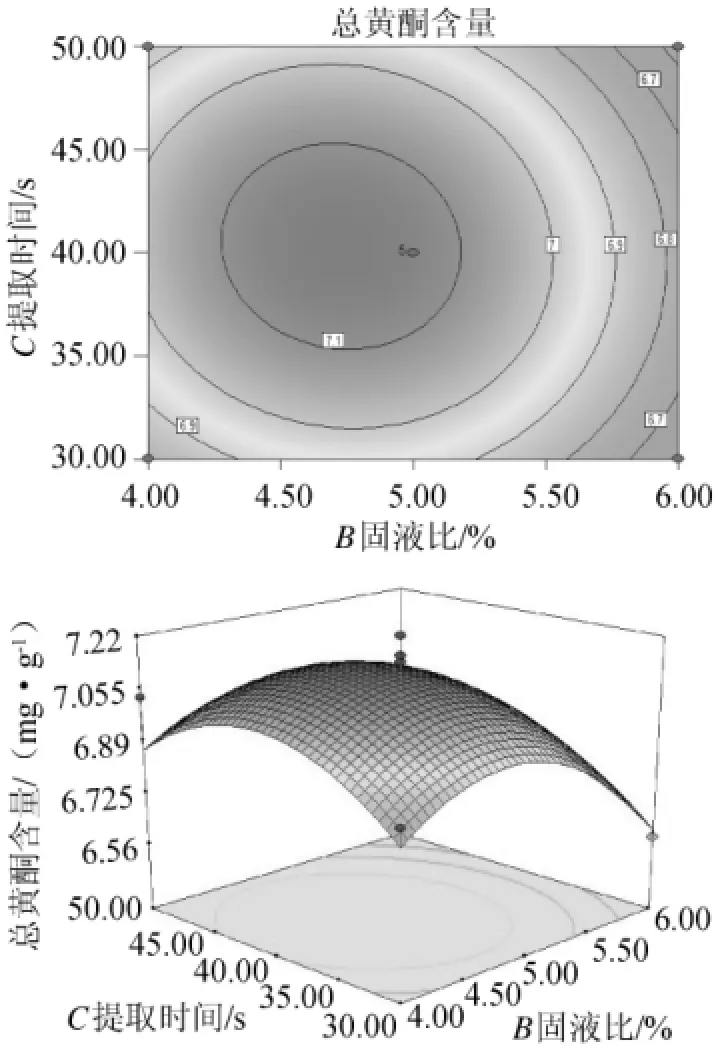
图10 提取时间和固液比对黄酮提取率影响的相应曲面及等高线Fig.10 Response surface plot and contour line of interaction between extraction time and solid to liquid ratio on flavonoid extraction ratio
由图11可看出,固液比和微波功率对总黄酮含量的交互影响显著。微波功率对响应值的影响明显强于固液比,固液比在1∶15~1∶25的范围内,总黄酮含量随微波功率的增大而增大。但在1∶20~1∶25的范围内,增加幅度较大。经分析,固液比约为1∶20~1∶25、微波功率约为385~539W时响应值可到达较高值。
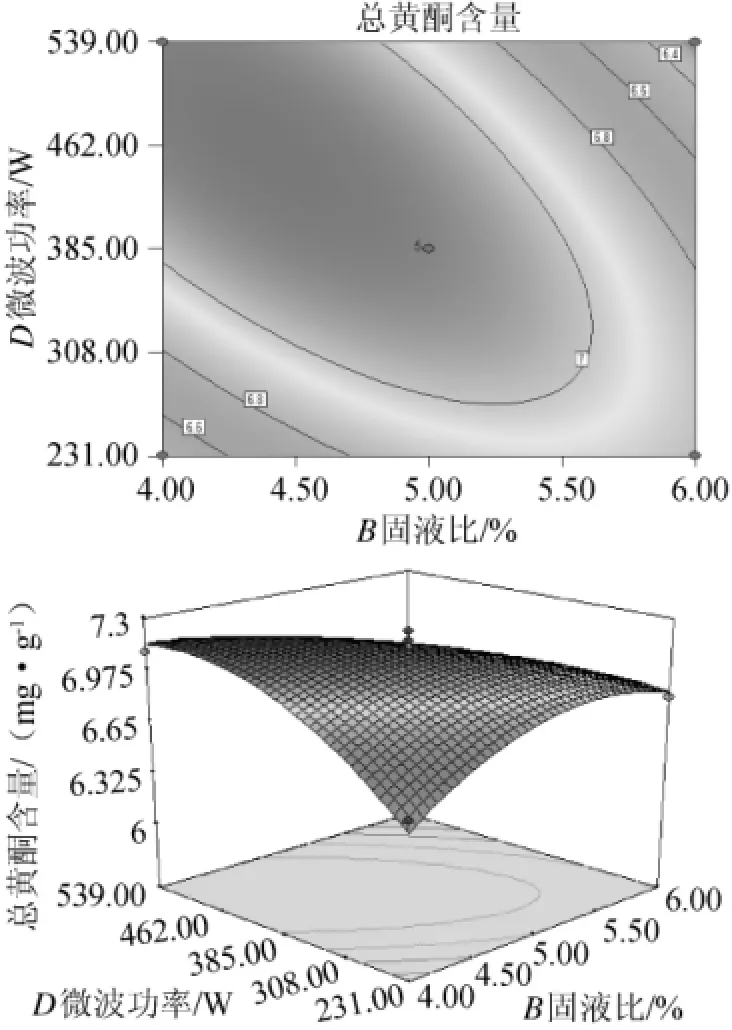
图11 微波功率和固液比对黄酮提取率影响的相应曲面及等高线Fig.11 Response surface plot and contour line of interaction between microwave power and solid to liquid ratio on flavonoid extraction ratio
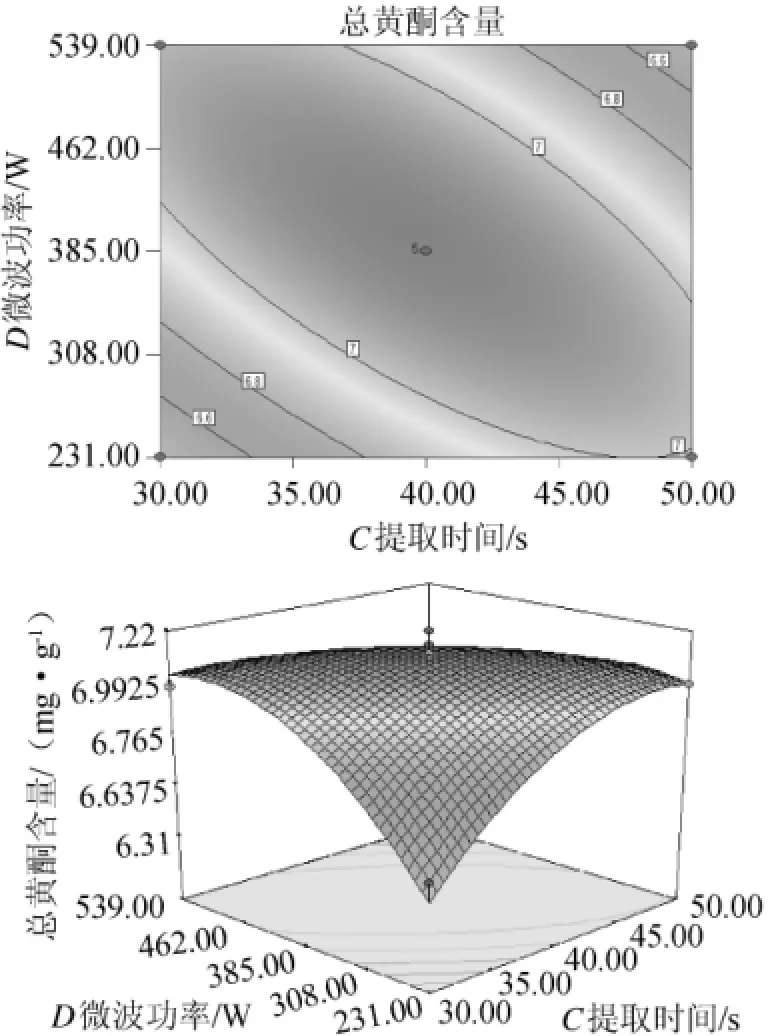
图12 微波功率和提取时间对黄酮提取率影响的相应曲面及等高线Fig.12 Response surface plot and contour line of interaction between microwave power and extraction time on flavonoid extraction ratio
由图12可知,提取时间短、微波功率低时,总黄酮含量低;但提取时间过长、微波功率过高时也会导致总黄酮含量下降,这可能是因为提取时间过长、微波功率过高会导致温度过高从而使黄酮分解。提取时间约为30~50s,微波功率约为385W可达到响应值最高点。
2.4 提取工艺的优化与验证结果
采用Design-Expert7.0软件优化的提取工艺条件为乙醇体积分数56.36%,固液比1∶25,提取时间31.27s,微波功率539W,总黄酮含量预测值为7.26mg/g。与实际最优工艺条件相比,提取时间31.27s相对40s有所降低,而微波功率539W相对385W明显提高。考虑到实际工作的便利,将提取工艺修正为乙醇体积分数56%,固液比1∶25,提取时间31s,微波功率539W,采用修正后的工艺条件进行3次重复验证试验,实际测得总黄酮含量为7.32mg/g,比预测值提高了0.83%,说明响应面法对黄酮提取量的优化具有实际的应用价值。
3 结论
本研究以葛根为原料,以葛根总黄酮的含量为指标,在单因素试验的基础上,利用响应面分析法建立了响应值与各因素之间的数学模型。最终确定了微波法提取葛根黄酮的最佳工艺条件:乙醇体积分数56%、固液比1∶25、提取时间31s、微波功率539W,在此优化条件下测得葛根总黄酮含量为7.32mg/g,比预测值提高了0.83%,表明响应面设计在葛根黄酮提取工艺中可行,结果可靠。
[1]程建明,吴涓,覃夏婵,等.粉葛中总黄酮提取纯化方法研究[J].中成药,2007,29(11):1679-1680.
[2]任雪琴,陈新,吴兵,等.葛根黄酮的提取工艺及三波长——分光光度法测定其含量[J].武汉工业学院学报,2011,30(4):32-36.
[3]张喜梅,李琳,陈玲,等.葛根总黄酮提取工艺研究[J].现代食品科技,2008,24(1):42-45.
[4]公衍玲,黄山,于慧荣.葛根黄酮提取方法的比较研究及其工艺条件优化[J].青岛科技大学学报,2009,30(5):415-417.
[5]李岂凡,白兰莉,胥永,等.从葛根中提取和纯化药用成分-总黄酮[J].安徽农业科学,2007,35(27):8680-8681.
[6]苏敏,洪燕卿,唐良华.葛根黄酮的微波萃取条件优化[J].实验室科学,2011,14(4):91-94.
[7]麻明友,刘建本,吴显明,等.超声微波双辅助提取柑橘皮总黄酮的研究[J].食品科学,2010,31(20):266-269.
[8]李海涛.葛根有效成分的提取工艺及其解酒功效的研究[D].哈尔滨:东北农业大学硕士论文,2006.
[9]张吉祥,欧来良.枣核总黄酮的微波辅助提取工艺优化[J].食品科学,2012,33(16):45-49.
[10]朱远平.金柚皮总黄酮的微波辅助提取工艺研究[J].食品科学,2009,30(12):74-77.
[11]王青豪,方芳,张熊禄,等.微波辅助提取绞股蓝黄酮工艺研究[J].食品科学,2010,31(22):149-152.
[12]GANZLER K,SALGO A,VALKO K.Microwave extraction:A novel sample preparation method for chromatography[J].J Chromatogr A, 1986,371(1):299-306.
[13]PARE J R J,BELANGER J M R,STAFFORD S S,et al.Production technology of puerarin beverages:US,5002784[P].1991.
[14]戚向阳,姚叶斌.杨梅花色苷提取工艺条件的响应面分析及其抗氧化活性[J].果树学报,2009,26(2):226-230.
[15]LIQH,FUCL.Application of response surface methodologyfor extraction optimization of germinant pumpkin seeds protein[J].Food Chem, 2005,92(4):701-706.
Microwave-assisted extraction process of flavonoids fromRadix puerariae
WANG Duan1,2,ZHOU Hongxiang1,2,TIAN Yaling1,2,LIU Yin1,2,CHEN Long1,2,WU Fengzhi1,2,QIU Shuyi1,2*
(1.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China; 2.Guizhou Key Lab of Fermenting Engineering and Bio-pharmacy,Guiyang 550025,China)
The total flavonoids were extracted with ethanol as solvent fromRadix puerariaeby microwave-assisted extraction.The effects of ethanol volume fraction,solid to liquid ratio,extraction time,microwave power and extraction times on the flavonoid yield was investigated.On the basis of single factor experiments,a Box-Benhnken design involving four variables at three levels was employed,and the optimal values of these variables were determined by response surface analysis.The results showed that the optimum extraction conditions were as follows:ethanol volume fraction 56%,solid to liquid ratio 1∶25,extraction time 31 s,microwave power 539 W and extraction times 2.Under this condition,the actually total flavonoid content was the highest with effective value was 7.32 mg/g,while the predicted value of the maximal yield of flavonoids was 7.26 mg/g.
microwave-assisted extraction;Radix puerariae;flavonoids;responses surface methodology;optimization experiment
O658
A
0254-5071(2014)03-0081-06
10.3969/j.issn.0254-5071.2014.03.020
2014-01-20
贵州省农业攻关项目(黔科合NZ20133016)
王端(1992-),女,硕士研究生,研究方向为生物大分子。
*通讯作者:邱树毅(1963-),男,教授,博士,研究方向为食品生物技术。

