野生猕猴桃干酒酿造工艺研究
孙洪浩,朱正军,邓元海,张家庆,徐国俊,曹敬华,陈茂彬*
(1.湖北工业大学生物工程学院,工业发酵湖北省协同创新中心,发酵工程教育部重点实验室,湖北武汉430068;2.神农架绿源天然食品有限责任公司,湖北神农架442400)
野生猕猴桃干酒酿造工艺研究
孙洪浩1,朱正军1,邓元海2,张家庆1,徐国俊1,曹敬华1,陈茂彬1*
(1.湖北工业大学生物工程学院,工业发酵湖北省协同创新中心,发酵工程教育部重点实验室,湖北武汉430068;2.神农架绿源天然食品有限责任公司,湖北神农架442400)
以神农架野生猕猴桃为原料,研究猕猴桃干酒发酵工艺。通过单因素试验和响应面分析法,对发酵工艺进行优化。结果表明,猕猴桃干酒发酵最佳工艺参数为果胶酶用量80mg/L,SO2添加量为72mg/L,发酵基质初始pH3.5,活性干酵母接种量300mg/L,发酵温度25℃。该工艺酿造的野生猕猴桃干酒口感丰满,香气协调,维生素C含量高。
野生猕猴桃;干型果酒;发酵工艺
猕猴桃也称猕猴梨、藤梨、羊桃,原产于中国湖北宜昌市夷陵区雾渡河镇,以我国为中心在世界范围内分布广泛[1-2]。因其维生素C含量在水果中名列前茅,被誉为“水果之王”[3-4]。研究表明,猕猴桃具有稳定情绪、降胆固醇、帮助消化、防癌治癌的作用[5-6]。
野生猕猴桃是神农架特产,其营养丰富,口感酸甜,可作为酿造优质猕猴桃果酒的理想原料。目前,猕猴桃果酒的生产大多采用传统酿造工艺,其酿造出的果酒口感单薄,香气不协调,维生素C含量低[7]。
因此以神农架当地野生猕猴桃为原料,研究猕猴桃干酒的最佳发酵工艺,酿造出营养丰富、品质优异的猕猴桃果酒。一方面可以充分利用当地资源,提高猕猴桃产品附加值,增加农民收入;另一方面可以丰富我国果酒市场品种,满足不同人群的消费需求[8-10]。
1 材料与方法
1.1 材料与试剂
野生猕猴桃:湖北神农架;蔗糖:市售;EX果胶酶(20 000U/g)、PDM活性干酵母、THIAZOTE酵母营养剂:上海杰兔工贸有限公司;食品添加剂(KHCO3):郑州东晓科技有限公司;其余化学试剂均为分析纯。
1.2 仪器与设备
AR1140电子分析天平:奥克斯国际贸易有限公司;PHX智能生化恒温培养箱:宁波莱福科技有限公司;RHB-82手持糖度计:永州光学仪器厂;FE20pH计:梅特勒-托利多仪器有限公司;HH-S数显恒温水浴锅:金坛市医疗仪器厂;TGL-16C台式离心机:上海安亭科学仪器厂制造;722S型可见光分光光度计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 猕猴桃干酒发酵工艺流程

1.3.2 操作要点
分选、清洗:应选用成熟度高(质地较软)的果实为原料,同时要挑出腐烂果、畸形果,用清水洗净果实。
破碎、酶解:将原料破碎打浆后,立即加入二氧化硫和果胶酶(果胶酶使用前按果胶酶∶水=1∶10的比例,采用35℃的温水活化30min),混合均匀后,静置酶解8~10h。
成分调整:用蔗糖将发酵基质的可溶性固形含量调整至20%~21%,pH值一般控制在3.2~3.7,最好不要超过4.0。
活性干酵母活化:活性干酵母/蔗糖/纯水(温度35~40℃)=1∶1∶25,先用温水将白砂糖充分溶解,然后缓慢加入活性干酵母,边加边搅拌,以免酵母结块,搅拌均匀后,静置20~30min至大量发泡。
前发酵:待酵母成功接种后,加入200mg/L的酵母营养剂,前发酵的温度一般控制22~28℃,周期一般为8~10d。
后发酵:后发酵温度控制在15~20℃,时间为15~20d。当总糖含量≤4g/L时,标志后发酵结束。
降酸:选用食品添加剂KHCO3为降酸剂,1g/L的KHCO3可降1.14g/L的酸度[11](以酒石酸计)。
低温陈酿:密封低温陈酿,温度控制小于10℃,陈酿期一般要求大于半年。陈酿期间根据检测结果确定是否补加二氧化硫,控制总二氧化硫含量小于250mg/L。
1.3.3 指标测定
酒精度、总酸、二氧化硫的测定[12];总糖的测定:3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)比色法[13];可溶性固形物:折光计法;pH测定:采用pH计;维生素C含量的测定:2,6-二氯靛酚滴定法[14]。
1.3.4 猕猴桃干酒感官评定
对酿制的猕猴桃干酒进行感官评分(满分100分),请实验室10名成员按照表1的评分标准打分。
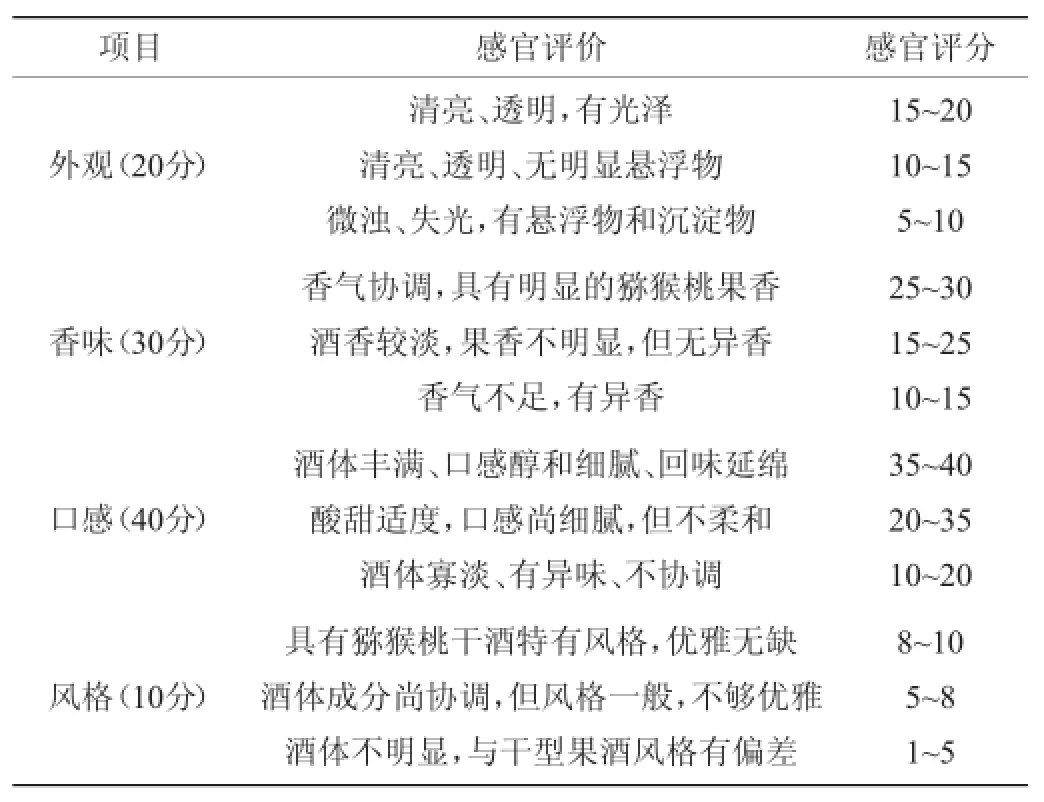
表1 猕猴桃干酒评分标准Table 1 Sensory evaluation standards of kiwi fruit wine
1.3.5 单因素试验
①果胶酶添加量:活性干酵母接种量0.2g/L,酵母营养剂添加量200mg/L前提下,调整发酵基质可溶性固形物含量21%(w/w),初始pH3.2,发酵温度为22℃,分别添加40mg/L、60mg/L、80mg/L、90mg/L、110mg/L、130mg/L的果胶酶。发酵10d后,测定发酵醪的酒精度与维生素C含量。
②SO2添加量:分别添加40mg/L、50mg/L、60mg/L、70mg/L、80mg/L、90mg/L的SO2,其他条件同①。发酵10d后,测定相应指标。
③初始pH:调整初始pH为2.6、2.8、3.2、3.5、3.8、4.0,其他条件同①。发酵10d后,测定相应指标。
④酵母接种量:分别加入0.15g/L、0.2g/L、0.25g/L、0.3g/L、0.35g/L、0.4g/L的活性干酵母,其他条件同①。发酵10d后,测定相应指标。
⑤发酵温度:控制发酵温度为20℃、22℃、25℃、28℃、30℃、32℃,其他条件同①。发酵10d后,测定相应指标。1.3.6 Box-Behnken响应面试验
鉴于单因素试验结果及分析,发酵基质初始pH值选为3.5,果胶酶用量80mg/L,酵母营养剂添加量200mg/L,运用Design-Expert 8.0.6软件响应面分析法,设计3因素3水平的Box-Behnken试验,考察SO2添加量、酵母接种量、发酵温度对酿造猕猴桃干酒感官评分的影响。因素水平见表2。
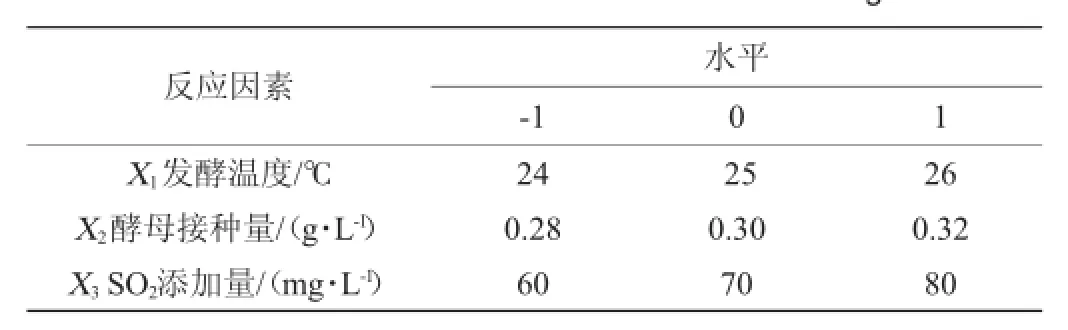
表2Box-Behnken试验因素水平Table 2 Factor and levels of Box-Behnken design
2 结果与分析
2.1 单因素试验
2.1.1 果胶酶用量对猕猴桃干酒发酵的影响
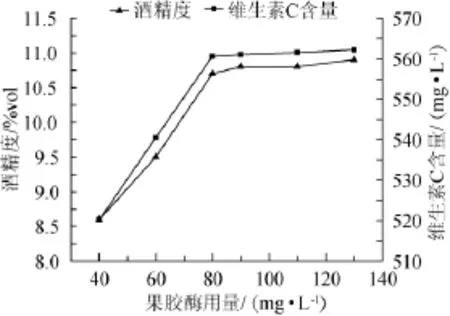
图1 果胶酶用量对猕猴桃干酒酒精度和维生素C含量影响Fig.1 Effect of pectinase on alcohol content and vitamin C content in kiwi fruit dry wine
添加果胶酶有利于果酒的澄清,而且可以使猕猴桃本身含有的色素、芳香物质更容易被提取。由图1可知,果胶酶添加量为40~80mg/L时,果酒酒精度和维生素C含量都显著升高。超过80mg/L后,继续增加果胶酶用量,果酒酒精度和维生素C含量只有小幅度增加。说明添加80mg/L的果胶酶即可将果渣中的果胶和纤维素充分分解,释放出糖、色素等物质,致使果酒的相关指标升高。考虑到实际生产成本,选择80mg/L的果胶酶用量即可。
2.1.2 SO2用量对猕猴桃干酒发酵的影响
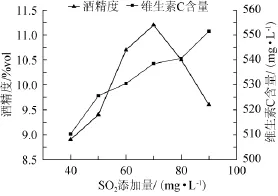
图2 SO2用量对猕猴桃干酒酒精度和维生素C含量的影响Fig.2 Effect of SO2amount on alcohol content and vitamin C content in kiwi fruit dry wine
在发酵过程中添加SO2主要是为了抑制杂菌的生长,防止果酒的氧化、变色。同时还可以减少维生素C等营养成分的损失。由图2可知,随着SO2用量的增加,酒精度先上升再下降,在70mg/L时,达到最大值。而维生素C的含量则随着SO2用量的增加而逐步增大。在实际生产中,SO2用量过低容易引起杂菌的污染,导致发酵不彻底,果酒酒精度低。而过高的SO2在杀死其他杂菌的同时,也抑制了酵母的正常繁殖与发酵作用,导致发酵后的残糖含量高。综合以上因素,选择SO2用量为70mg/L为最佳。
2.1.3 初始pH对猕猴桃干酒发酵的影响
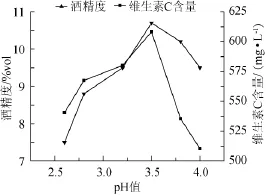
图3 pH对猕猴桃干酒酒精度和维生素C含量的影响Fig.3 Effect of pH value on alcohol content and vitamin C content in kiwi fruit dry wine
由图3可知,随着pH的升高,果酒酒精度先升高后降低,在pH值为3.5时,酒精度达到最大值。可能与酵母生长最适pH有关。在此pH条件下,酵母的生长代谢旺盛,发酵产酒精能力强。维生素C含量也是先升后降,在pH3.5左右达到最大值。可能是由于随着pH的升高反而加速维生素C的氧化。综合以上因素,发酵基质初始pH值3.5为最佳。
2.1.4 酵母接种量对猕猴桃干酒的影响

图4 酵母接种量对猕猴桃干酒酒精度和维生素C含量的影响Fig.4 Effect of yeast inoculums on alcohol content and vitamin C content in kiwi fruit dry wine
由图4可知,当酵母接种量达到0.3g/L时,果酒酒精度和维生素C含量基本达到最大值。继续增加酵母接种量,二者含量变化不大。可能是发酵基质中营养成分有限,增大酵母接种量对相应指标影响不大。而且过高的酵母接种量会使发酵过于剧烈,导致酒体口味不协调。综合以上因素,酵母接种量为0.3g/L为最佳。
2.1.5 发酵温度对猕猴桃干酒的影响
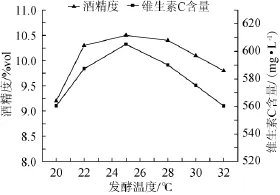
图5 发酵温度对猕猴桃干酒酒精度和维生素C含量的影响Fig.5 Effect of fermentation temperature on alcohol content and vitamin C content in kiwi fruit dry wine
由图5可知,当发酵温度控制在25℃时,酒精度和维生素C含量均达到最高。温度过低,发酵启动困难,酒精和维生素C含量低。温度过高,菌体生长过快,导致发酵基质中营养物质大多用于菌体生长,酒精转化率低。而且温度的升高也会促使维生素C的氧化,果酒中甲醇含量的增加[15],酿制的果酒色泽差,口感单薄。所以,将主发酵温度控制在25℃为最佳。
2.2 Box-Behnken响应面试验
利用Deign-Expert8.0.6软件可得到感官评分(Y)与影响发酵3因素发酵温度(X1)、酵母接种量(X2)、SO2添加量(X3)的回归方程:
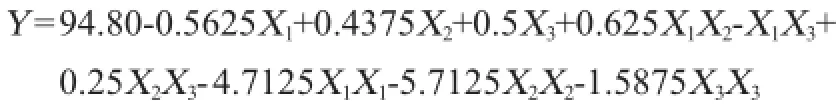
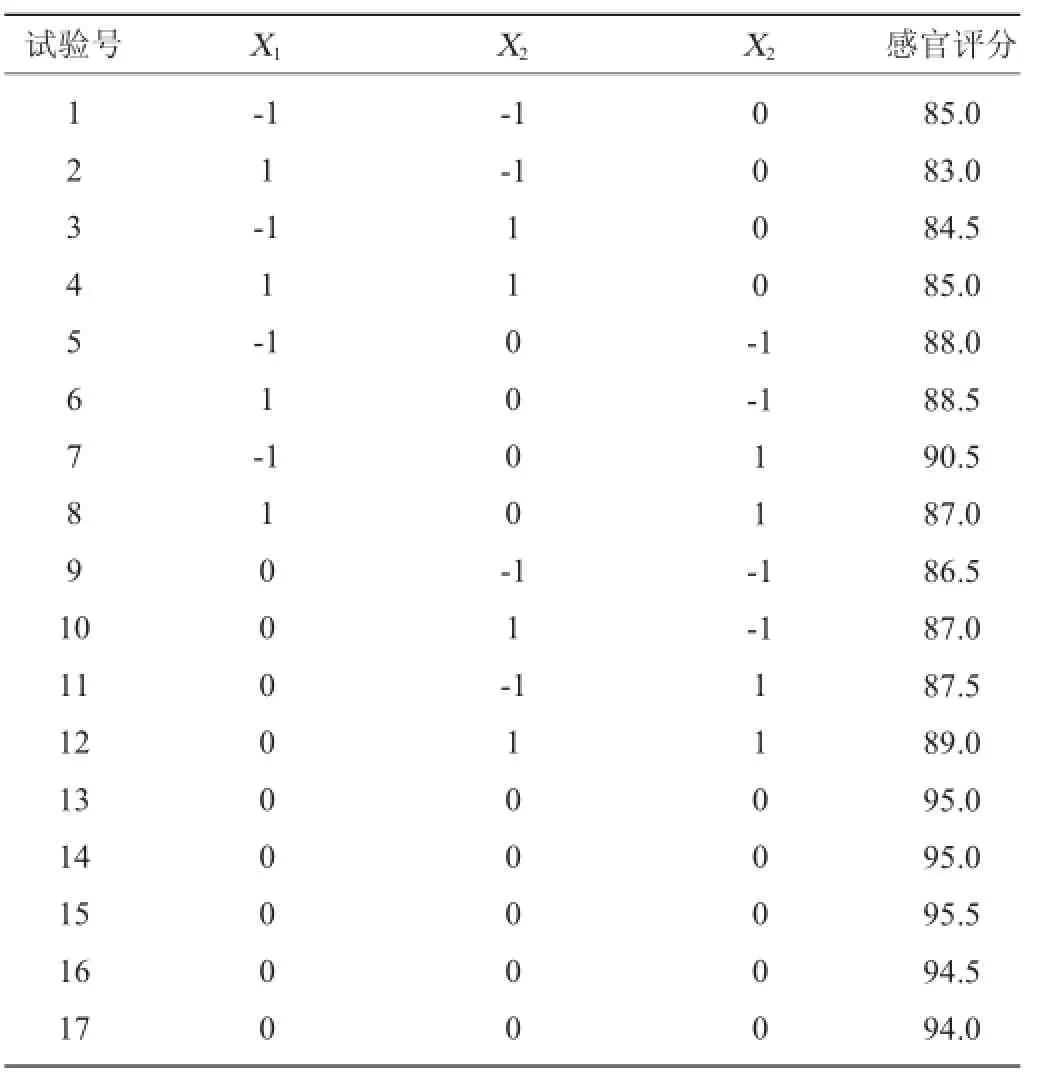
表3 Box-Behnken试验结果Table 3 Experimental result of Box-Behnken experiment
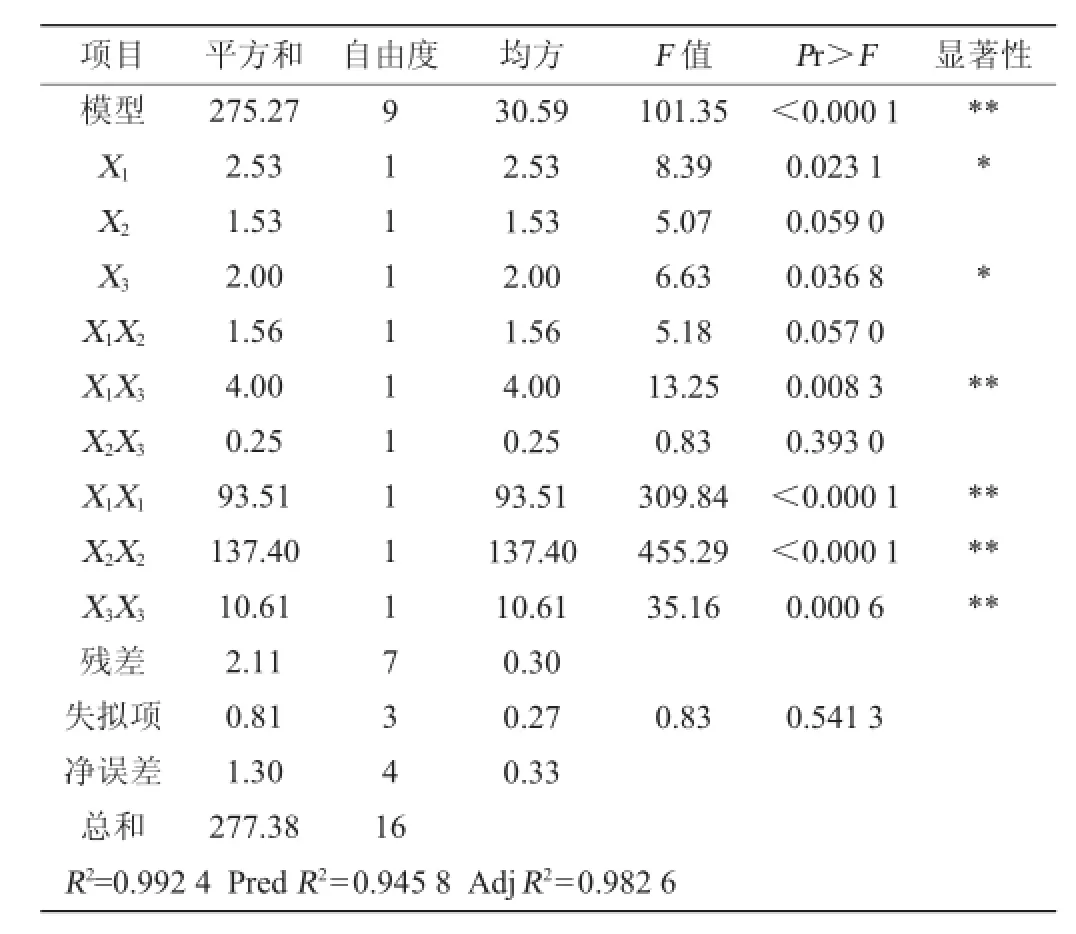
表4 回归模型方差分析Table 4 Variance analysis of regression model
由表3可知,模型失拟项P=0.5413>0.05,影响不显著,说明方程不失拟。回归模型(P<0.00010)影响极显著,R2为 0.992 4、预测PredR2为0.945 8与较正AdjR2十分接近,仅有0.01%不能由该模型来解释,精密度为28.6>4。综合以上分析,可知该模型能够很好的拟合试验结果。由分析方差分析表4可知,一次项中发酵温度和SO2添加量对发酵的影响显著,而酵母接种量对发酵影响不显著。二次项X1X3、X1X1、X2X2与X3X3影响极显著;模型交互项中,发酵温度和SO2交互项对发酵影响显著。根据3单因素显著性可知,各因素对感官评价影响的主次顺序为发酵温度>SO2浓度>接种量。借助Deign-Expert软件获得三维响应面曲线,见图6~图8。据模型分析,最优的猕猴桃干酒发酵条件为发酵温度24.92℃、SO2用量71.84mg/L、酵母接种量0.30g/L,感官评分最大预测值为94.85分。结合试验与生产的局限性,选择发酵温度为25℃、SO2用量72mg/L、酵母接种量0.3g/L为最佳。
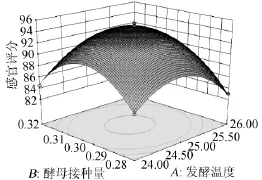
图6 发酵温度和酵母接种量对感官评分的相应曲面及等高线Fig.6 Response surface plot and contour line of interaction between fermentation temperature and yeast inoculums on sensory score

图7 酵母接种量和SO2用量对感官评分的相应曲面及等高线Fig.7 Response surface plot and contour line of interaction between yeast inoculums and SO2amount on sensory score
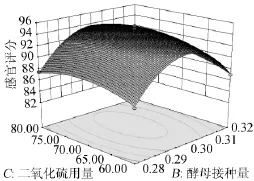
图8 发酵温度和SO2用量对感官评分的相应曲面及等高线Fig.8 Response surface plot and contour line of interaction between fermentation temperature and SO2amount on sensory score
2.3 响应面验证试验
在发酵温度25℃、酵母接种量0.3g/L、SO2用量72mg/L最适条件下进行验证试验,酿制果酒的感官评价分数为94分,与预测值拟合较好。
3 结论
利用神农架野生猕猴桃为原料,经过单因素试验与响应面优化分析得到野生猕猴桃干酒最佳发酵工艺为果胶酶用量为80mg/L,SO2添加量72mg/L,发酵基质初始pH值为3.5,活性干酵母接种量300mg/L,发酵温度25℃,发酵10d左右。在此工艺条件下,酿造出的果酒口感细腻、香气协调、酒体醇厚丰满、营养丰富、维生素C含量达620.4mg/L,酒精度为12%vol~13%vol,各项理化指标均符合国家标准。该研究对野生猕猴桃干酒的大规模生产有一定的指导意义。
[1]涂正顺,李华,李加兴,等.猕猴桃果酒陈酿期间香气成分的变化[J].西北农林科技大学学报:自然科学版,2005(11):57-61.
[2]徐清萍,朱广存.野生猕猴桃酒发酵工艺研究[J].酿酒技术,2010(10):79-81.
[3]张仲安.猕猴桃酒的酿造技术[J].四川农业科技,2007(10):58.
[4]谢彩云,范国华.猕猴桃开发研究进展[J].贵州农业科学,1996(6):61-62.
[5]楼丽君,吕定量,胡增仁,等.猕猴桃根抗肝癌的实验研究[J].中华中医药学刊,2009,27(7):1509-1511.
[6]HAFEZI F,RAD H E,NAGHIBZADEH B,et al.Actinidia deliciosa(kiwifruit),a new drug for enzymatic debridement of acute burn wounds[J]. Burns,2010,36(3):352-355.
[7]尚云青.新型营养猕猴桃果酒加工技术研究[J].食品科技,2002,28(2):53-54.
[8]李加兴,孙金玉,陈双平,等.猕猴桃综合加工利用[J].食品科学,2006,27(11):575-578.
[9]李加兴,陈双平,梁先长,等.猕猴桃干型果酒发酵工艺优化[J].食品科学,2010,31(22):504-506.
[10]周桃英,武秀琴,罗登宏,等.猕猴桃果酒酿造工艺研究[J].四川食品与发酵,2011(43):44-45.
[11]陈继峰,KREMER B.降酸方法对葡萄酒降酸效果的影响[J].中外葡萄与葡萄酒,2001(3):17-20
[12]中国食品发酵工业研究所,烟台张裕葡萄酿酒股份有限公司,中国长城葡萄酒有限公司.GB/T 15038—2006.葡萄酒、果酒通用分析方法国家标准[S].北京:中国标准出版社,2006.
[13]武平,赵文婧,徐晓娇,等.测定葡萄酒中总糖方法的探讨[J].中国酿造,2011,30(1):163-165.
[14]赵晓梅,江英,吴玉鹏,等.果蔬中VC含量测定方法的研究[J].食品科学,2006,27(3):197-199.
[15]颜雪辉,吕梅,史路路,等.柑橘酒酿造工艺研究[J].中国酿造,2013,32(11):98-101.
Fermentation technology of kiwi fruit dry wine
SUN Honghao1,ZHU Zhengjun1,DENG Yuanhai2,ZHANG Jiaqing1,XU Guojun1,CAO Jinghua1,CHEN Maobin1*
(1.Key Laboratory of Fermentation Engineering(Ministry of Education),Hubei Collaborative Innovation Center for Industrial Fermentation, College of Bioengineering,Hubei University of Technology,Hubei 430068,China;2.Shennongjia Luyuan Natural Food Co.,Ltd., Shennongjia,China)
Using wild kiwi fruit from Shennongjia as raw material,the fermentation technology of kiwifruit dry wine was studied.Through single factor experiment and response surface analysis,the optimal fermentation processing was optimized.Results indicated that the optimal fermentation parameters were as follows:pectinase 80 mg/L,SO2addition 72 mg/L,initial pH 3.5,active yeast inoculum 300 mg/L,fermentation temperature 25℃. The wine produced was relatively prominent,transparent with fresh kiwi fruit aroma and harmonious taste with high vitamin C content.
wild kiwi;dry fruit wine;fermentation technology
TS262.7
A
0254-5071(2014)03-0062-05
10.3969/j.issn.0254-5071.2014.03.016
2014-01-15
国科发农[2012]821号
孙洪浩(1989-),男,硕士研究生,研究方向为发酵工程。
*通讯作者:陈茂彬(1965-),男,教授,博士,研究方向为酿酒微生物与发酵工程。

