氯沙坦对血管性痴呆大鼠认知功能的改善及胆碱能系统活性的影响
陈江瑛等

[摘要] 目的 研究氯沙坦对血管性痴呆(VaD)大鼠认知功能的改善和胆碱能系统活性的影响。 方法 将40只雄性SD大鼠随机分成四组:假手术组,模型组,氯沙坦低剂量[2 mg/(kg·d)]组,氯沙坦高剂量[5 mg/(kg·d)]组,每组10只。用双侧颈总动脉永久性结扎法(2VO)制备VaD大鼠模型,造模前予灌胃治疗,Morris水迷宫测试治疗后VaD大鼠认知功能的改善情况,Tunel染色测定各组大鼠海马脑组织内细胞凋亡的变化。免疫组织化学方法检测Bc1-2、Bax蛋白表达,并测定乙酰胆碱转移酶(ChAT)活性。 结果 方差分析表明,潜伏期和跨越次数F值分别为33.23和25.20。氯沙坦灌胃治疗的VaD大鼠,与未予治疗的VaD大鼠组相比,治疗组大鼠找到平台的潜伏期缩短(P < 0.01),穿越平台次数增多(P < 0.01);氯沙坦高剂量组较氯沙坦低剂量组逃避潜伏期时间减少,穿越平台次数增多(P < 0.01)。方差分析表明,凋亡细胞、Bcl-2蛋白及Bax蛋白F值分别为155.58、215.79和428.95。与模型组相比,氯沙坦治疗组大鼠脑组织海马区凋亡细胞数明显减少,抗凋亡基因Bcl-2蛋白表达显著增加,凋亡基因Bax蛋白表达降低,差异有高度统计学意义(P < 0.01);氯沙坦高剂量组与氯沙坦低剂量组相比,Bcl-2蛋白表达增加,Bax蛋白表达下降,差异有高度统计学意义(P < 0.01)。方差分析表明,各组大鼠ChAT活力F值为13.61。氯沙坦治疗组脑组织ChAT活力明显升高,差异有高度统计学意义(P < 0.01);氯沙坦高剂量组与氯沙坦低剂量组相比,脑组织ChAT活力显著升高,差异有高度统计学意义(P < 0.01)。 结论 氯沙坦治疗可以明显改善VaD大鼠的认知功能,其机制与调节凋亡相关蛋白的表达、促进乙酰胆碱的合成相关。
[关键词] 氯沙坦;血管性痴呆;认知功能;细胞凋亡;乙酰胆碱转移酶
[中图分类号] R749.3 [文献标识码] A [文章编号] 1673-7210(2014)01(a)-0010-04
血管性痴呆(vascular dementia,VaD)是由一系列脑血管因素(缺血或出血或急慢性缺氧性脑血管病等)导致脑组织损害,引起以认知功能障碍为特征的综合征[1-2]。有研究表明,脑内具有独立的肾素-血管紧张素系统(RAS),而RAS除调节血压和水电解质平衡外,还参与学习、记忆等认知功能的调节。氯沙坦属血管紧张素1型受体(AT1受体)阻滞药,通过阻滞AT1受体对抗AngⅡ的作用。有研究显示氯沙坦可进入脑组织,拮抗脑局部AT1受体,下调脑局部RAS系统的作用而产生脑保护[3-4]。本研究采用VaD模型大鼠,观察氯沙坦对VaD大鼠认知功能的改善作用。
1 材料与方法
1.1 材料
1.1.1 动物 老龄健康雄性SD大鼠40只,月龄大于16个月,体重300~450 g,由中山大学北校区实验动物中心提供。
1.1.2 药物 氯沙坦(美国杭州默沙东公司生产,批号:H20030654)。
1.1.3 试剂 凋亡TUNEL试剂盒(美国ROSS公司),兔抗大鼠Bax多克隆抗体(美国Epitomics公司),兔抗大鼠BCl-2多克隆抗体(美国CST公司),乙酰胆碱转移酶(ChAT)测试盒(南京建成生物工程研究所)。
1.2 血管性痴呆大鼠模型的建立及分组处理
将雄性SD大鼠用10%水合氯醛(0.035 mL/10 g)腹腔注射麻醉后,分离双侧颈总动脉,并以“0”号丝线阻断血流20 min,可以观察到大鼠惊厥、呼吸深慢、心跳加快;同时在距鼠尾尖约1 cm处断尾,放血约0.3 mL。松开丝线扣恢复血流10 min后,再次阻断血流20 min,如此重复3次,第3次血流再灌注后观察30 min,如大鼠呼吸、心跳平稳,即可缝合皮肤,放回笼中正常饲养。其中假手术组仅分离双侧颈总动脉,套丝扣;但不阻断血流,尾部不放血,观察时间、饲养条件与模型组相同。
造模前大鼠随机分成四组,每组各10只:假手术组,模型组,氯沙坦低剂量[2 mg/(kg·d)]组,氯沙坦高剂量[5 mg/(kg·d)]组。手术当天提前2 h灌胃,直至术后15 d。在灌胃后30 d,分别对上述各组大鼠进行水迷宫试验,观察各组大鼠学习和记忆成绩。术中假手术组大鼠无死亡,其余各组各有1只大鼠死亡。
1.3 Morris水迷宫测试
1.3.1 定位航行试验 水温控制在25℃左右,每日上下午各4次,将大鼠面向池壁分四个象限放入水中,记录其在2 min内寻找到平台的时间(逃避潜伏期)。如果大鼠在2 min内未找到平台,则用手牵引其至平台上,让大鼠停留20 s,再放回笼中,其潜伏期算120 s。历时5 d。
1.3.2 空间探索试验 第6天撤除平台,将大鼠任选1个入水点放入,记录其2 min内跨越原平台位置的次数。
1.4 免疫组织化学法检测Bcl-2、Bax阳性细胞的表达
各组大鼠在行为测试完毕后以10%水合氯醛麻醉,立即开胸暴露心脏,左心室迅速插管至主动脉,同时剪开右心耳,灌注生理盐水100 mL,再灌注4%的多聚甲醛250 mL,速度先快后慢,至颈部非常僵硬为满意,迅速取脑并分离左侧海马区组织,4%多聚甲醛中浸置4~6 h,经乙醇常规脱水、二甲苯透明后,浸蜡包埋,5 μm厚切片,行免疫组化染色,严格按照说明操作。
1.5 氯沙坦对乙酰胆碱转移酶活力的影响
将上述各动物实验,选取6只不同剂量组的大鼠断头处死,制成10%的匀浆,采用相关试剂盒测定脑组织中ChAT的活力。
1.6 统计学方法
应用SPSS 17.0统计软件,计量资料数据以均数±标准差(x±s)表示,多组间的比较采用方差分析,两两比较采用q检验,以P < 0.05为差异有统计学意义。
2 结果
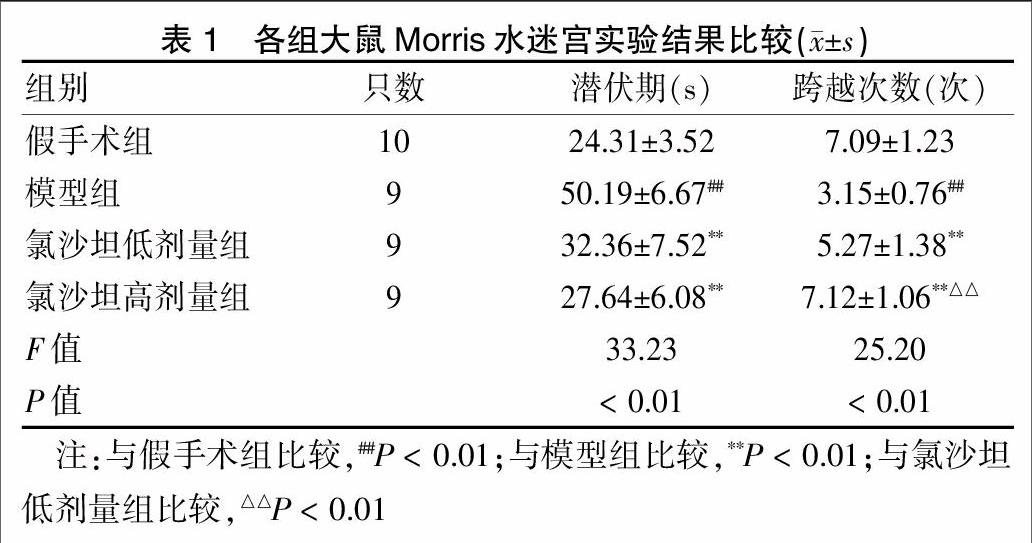
2.1 各组大鼠Morris水迷宫实验结果比较
模型组所用逃避潜伏期时间明显长于假手术组、氯沙坦高剂量组及氯沙坦低剂量组,差异均有高度统计学意义(P < 0.01)。空间探索试验结果显示,氯沙坦高剂量组、低剂量组出现穿越平台次数均高于模型组,差异有高度统计学意义(P < 0.01)。氯沙坦高剂量组出现穿越平台次数高于氯沙坦低剂量组,差异有高度统计学意义(P < 0.01)。见表1。
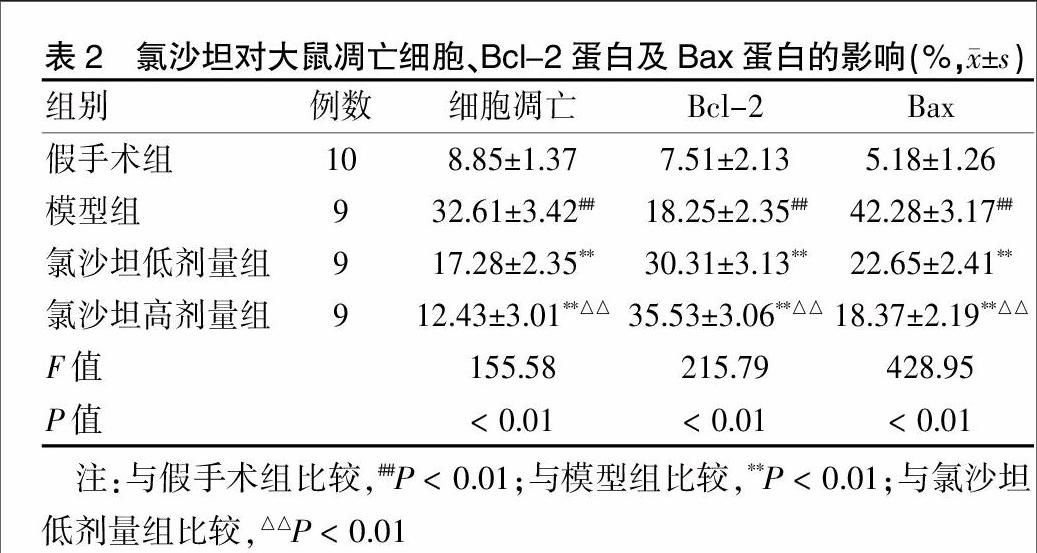
2.2 氯沙坦对大鼠凋亡细胞、Bcl-2蛋白及Bax蛋白的影响
与假手术组比较,模型组凋亡基因Bax蛋白表达显著增加(P < 0.01),抗凋亡基因Bcl-2蛋白表达显著下降(P < 0.01)。与模型组比较,氯沙坦低剂量组、氯沙坦高剂量组抗凋亡基因Bcl-2蛋白表达显著增加(P < 0.01),凋亡基因Bax蛋白表达降低(P < 0.01)。说明氯沙坦可能通过影响凋亡相关蛋白的表达而发挥神经保护作用。氯沙坦高剂量组与低剂量组比较,Bcl-2蛋白表达增加,Bax蛋白表达下降,差异有高度统计学意义(P < 0.01)。见表2。
2.3 氯沙坦对大鼠脑组织中胆碱乙酰转移酶活力的影响
与假手术组比较,模型组脑组织ChAT活力显著降低(P < 0.01),氯沙坦低、高剂量组脑组织ChAT活力明显升高,差异有高度统计学意义(P < 0.01)。氯沙坦高剂量组与低剂量组比较,ChAT活力差异无统计学意义(P > 0.05)。见表3。
3 讨论
中枢胆碱能机制和缺血后迟发性神经元死亡(DND)引起的炎症反应、细胞凋亡是近年研究较为重视VaD的发生机制[5]。中枢胆碱能通路是构成学习记忆的主要通路,乙酰胆碱(ACh)是其中的重要神经递质,其浓度升高有利于学习记忆能力的恢复,降低则促进痴呆的发生[6]。脑缺血时胆碱能神经元退变,分解ACh增强,导致ACh浓度降低从而促进痴呆的发生。ChAT活性被视为胆碱能神经元最具体的指标,ChAT活性降低的程度以及由此产生的ACh水平下降的严重程度与认知能力下降密切相关,与年龄相关的认知功能障碍在动物大脑中表现出ChAT活性显著降低[7]。海马CA1区对脑缺血有选择易损性,海马神经元的凋亡丢失和缺血坏死影响了神经元突触的可塑性,影响了海马对信息的处理和传递,引起脑缺血后记忆认知功能损害。
近年的研究证实[8-10],应用血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ1型受体(AT1R)阻断剂减少AngⅡ的生成或阻断其受体信号通路,能明显改善脑血流量和认知功能。Rozzini等[11]研究证实,卡托普利可以改善缺血性脑梗死患者的生活质量,提高其认知功能。推测其机制可能与卡托普利通过抑制脑源性AngⅡ的生成,间接提高脑组织ACh的浓度,从而改善认知功能有关。Moretti等[12]研究发现,脑室内注入烟碱类胆碱能受体拮抗剂美加明可破坏雄性SD大鼠的空间学习能力, 再注AngⅣ可使其受损的空间学习能力恢复正常。说明AngⅣ对学习记忆的修复作用与脑中的胆碱能系统相关。
在本实验中,采用氯沙坦对血管性痴呆大鼠进行治疗,可明显改善大鼠搜索平台的潜伏期和跨越平台的次数,改善大鼠学习记忆功能。在实验中,VaD模型组大鼠CA1区Bax高表达,Bcl-2低表达,凋亡细胞增多,证实了长期低灌注可使海马神经元凋亡,影响认知和记忆。氯沙坦低剂量组和高剂量组与模型组相比,均有Bcl-2的高表达,Bax的低表达,凋亡细胞也明显减少。说明氯沙坦能抑制海马神经元细胞的凋亡,达到保护神经元,改善VD大鼠学习记忆能力的效果,其机制与调节凋亡相关蛋白的表达相关。同时,氯沙坦可以有效提高ChAT活性,明显改善模型小鼠学习记忆能力,提示氯沙坦可促进ACh的合成,增加ACh与M受体的结合,这可能也是氯沙坦增强模型小鼠学习记忆功能的机制之一。
[参考文献]
[1] 王昌铭,姚永杰,向静,等.人脐血单核细胞颈内动脉输注对血管性痴呆大鼠学习记忆的作用及在脑内的迁移分化[J].中国行为医学科学,2007,16(6):493-496.
[2] 陈江瑛,闫振文,张付生,等.瘦素对对血管性痴呆大鼠认知功能的改善保护作用[J].中华行为医学和脑科学杂志,2010,19(7):621-623.
[3] Mogi M,Horiuchi M. Effects of angiotensin Ⅱ receptor blockers on dementia [J]. Hypertens Res,2009,32(9):738-740.
[4] Albiston AL,Fernando RN,Yeatman HR,et al. Gene knockout of insulin-regulated aminopeptidase:loss of the specific binding site for angiotensin Ⅳ and age-related deficit in spatial memory [J]. Neurobiol Learn Mem,2010,93(1):19-30.
[5] Nishio K,Ihara M,Yamasaki N,et al. A mouse model characterizing features of vascular dementia with hippocampal atrophy [J]. Stroke,2010,41(6):1278-1284.
[6] Yoshizaki K,Adachi K,Kataoka S,et al. Chronic cerebral hypoperfusion induced by right unilateral common carotid artery occlusion causes delayed white matter lesions and cognitive impairment in adult mice [J]. Exp Neurol,2008,210(2):585-591.
[7] 文春晓.神经递质在学习记忆中的作用[J].武警医学院学报,2009,18(1):65-67.
[8] Washida K,Ihara M,Nishio K,et al. Nonhypotensive dose of telmisartan attenuates cognitive impairment partially due to peroxisome proliferator-activated receptor-gamma activation in mice with chronic cerebral hypoperfusion [J]. Stroke,2010,41(8):1798-1806.
[9] Wright JW,Harding JW. The brain RAS and Alzheimer's disease [J]. Exp Neurol,2010,223(2):326-333.
[10] Yannick M,Catherine,Llorens-Cortes,et al. The role of the brain renin-angiotensin system in hypertension:implications for new treatment [J]. Progress in Neurobiology,2011, 95(2):89-103.
[11] Rozzini L,Chilovi BV,Bertoletti E,et al. Angiotensin converting enzyme(ACE)inhibitors modulate the rate of progression of amnestic mild cognitive impairment [J]. Internat J Geriat Psychiat,2006,21(6):550-555.
[12] Moretti A,Gorini A,Villa RF. Villa Pharmacotherapy and Prevention of Vascular Dementia [J]. CNS & Neurological Disorders-Drug Targets,2011,10(3):370-390.
(收稿日期:2013-10-28 本文编辑:张瑜杰)

