一种检测沙丁胺醇的高灵敏复合纳米免疫电化学传感器的研制
吴 珺,张 洁,,邵科峰,陈昌云,王传现,赵 波,
(1.南京师范大学化学与材料科学学院,江苏 南京 210023;2.上海出入境检验检疫局,上海 200135)
沙丁胺醇又名1-(4-羟基-3-羟甲基苯基)-2-(叔丁氨基)乙醇,其结构式见图1。沙丁胺醇是β-激动剂系列的一种,对治疗哮喘有一定的作用。沙丁胺醇也可以促进动物生长的速率,同时能增加瘦肉的产量[1-3],因此被不法分子添加到动物的饲料中。但是人类在食用含沙丁胺醇的肉制品时,沙丁胺醇会在人体内富集。沙丁胺醇会产生肌肉颤抖、心悸、头痛、肌肉疼痛、恶心、呕吐、发烧等副作用[4-6]。基于以上原因,中国和许多欧洲国家都已经明令禁止使用沙丁胺醇等β-激动剂系列[7]。
目前,食品中β-激动剂的检测方法主要有液相色谱-质谱联用法、气相色谱-质谱联用法以及酶联免疫法[8-17],这些方法都具有前处理复杂,价格昂贵以及携带不方便等缺点。免疫生物传感器是利用生物活性物质的专一识别功能,有选择地检测待测物。以灵敏度高、选择性好、分离过程和检测技术合为一体、不需要样品预处理或简单处理便能直接应用于复杂样品的检测等特点而受到广泛重视,成为临床、生物医药、环境化学以及食品安全分析中一种有力的分析手段。纳米材料因其具有独特的电子特性和表面微结构,较大的比表面积、较高的表面活性、强吸附力、较高催化效率以及良好的生物相容性等优异特性[18-19],可在增加生物分子(酶、抗原或抗体等)[20-23]的吸附量和稳定性的同时提高生物分子的催化活性,很好地促进生物电活性分子的电子传递,使传感器或纳米免疫分析的响应灵敏度大大提高,成为现代化学分析的重要发展方向之一。
纳米金具有大的比表面积,优异的光学性能以及良好的生物兼容性而被广泛用于电化学传感器[24-26],并且其具有良好的导电性,能有效提高电子的传输。石墨烯作为一种具有二维结构的新型碳基材料,因其具有更大的比表面积及高电子传导能力、原料易得且价格便宜等优点,已成为继碳纳米管后新一代的理想电极修饰材料。本实验将纳米技术和免疫分析方法有机结合,研究开发了一种高灵敏、高选择性、低成本、快速现场的新型多残留复合纳米免疫分析检测技术。本实验旨在发展β-激动剂类兽类药物残留技术的创新提供参考,为我国β-激动剂类兽残检测和监管作出贡献,同时也可为其他农兽残检测提供一种先进的通用技术,具有很大的社会效益和应用价值。
图1 沙丁胺醇结构Fig.1 Molecular structure of salbutamol
1 材料与方法
1.1 材料与试剂
沙丁胺醇 美国Sigma-Aldrich公司;沙丁胺醇抗体深圳华英生物技术有限公司;牛血清白蛋白(bovine serum albumin,BSA) 北京元亨圣马生物技术研究所;氯金酸 南京化学试剂有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4)由0.1 mol/L的Na2HPO4和0.1 mol/L的NaH2PO4溶液按一定比例配得;提取液是乙腈与丙酮以4∶1的体积比配得。其他试剂均为分析纯,实验用水均为二次蒸馏水。
1.2 仪器与设备
CHI852C电化学工作站、三电极体系(工作电极为玻碳电极,对电极为铂电极,参比电极为Ag/AgCl电极) 上海辰华仪器有限公司;PHS-25型pH计 上海今迈仪器仪表有限公司;UV1700PC紫外-可见分光光度计 上海凤凰光学科仪有限公司;FA1004分析天平 上海良平仪器仪表有限公司;JSM-7600F高分辨热场发射扫描电子显微镜 日本电子株式会社。
1.3 方法
1.3.1 石墨烯悬浊液的制备
1.3.1.1 氧化石墨烯制备
将50 mL浓H2SO4、10 g K2S2O8、10 g P2O5混合,将12 g石墨粉加入到上述混合液中,反应6 h。加入2 L水,过夜。将460 mL浓H2SO4冰箱冰冻处理备用,将氧化的石墨粉加入到浓H2SO4中搅拌。温度控制在10 ℃以下,缓慢加入60 g KMnO4,混合物在35 ℃反应2 h,缓慢加入920 mL去离子水,保持50 ℃以下,搅拌反应2 h。加入2.8 L水以及50 mL 30% H2O2,搅拌反应1 d。使用5 L 10%的HCl溶液冲洗,离心。然后再用5 L水洗,至溶液呈中性。
1.3.1.2 石墨烯的制备
称取上述氧化石墨0.05 g,加入到100 mL pH 11的NaOH溶液中;150 W超声90 min制备氧化石墨烯分散液;在4 000 r/min离心3 min除去极少量未剥离的氧化石墨;向离心后的氧化石墨烯分散液中加入0.1 mL水合肼,在90 ℃搅拌反应2 h,得到石墨烯分散液。
1.3.1.3 石墨烯悬浊液的制备
称取10 mg的石墨烯于10 mL离心管中,加入4 mL的二次蒸馏水,超声使其分散均匀,制得石墨烯悬浊液,放入4 ℃的冰箱内备用。
1.3.2 电极的制备
将玻碳电极GCE(Φ=3 mm)在1.0 μm和0.3 μm Al2O3抛光粉上抛光成镜面,并分别在二次蒸馏水、乙醇与二次蒸馏水混合液、二次蒸馏水中清洗干净,室温晾干,备用。
1.3.3 紫外-可见光谱的测定
1.3.3.1 标准溶液的配制
准确称取0.005 g沙丁胺醇,溶于10 mL无水乙醇中,配得0.5 g/L的沙丁胺醇溶液。用无水乙醇对上述标准液进行稀释,得到0.01 g/L的沙丁胺醇溶液。以无水乙醇为参比液,对0.01 g/L的沙丁胺醇标准液进行全波长扫描。
1.3.3.2 石墨烯-沙丁胺醇复合物以及石墨烯悬浮液的制备
先将石英片清洗干净,晾干,然后取制备好的石墨烯悬浊液300 μL和150 μL的质量浓度为0.1 g/L的沙丁胺醇混合后滴加到石英片上,并在40 ℃烘干。待烘干后用5%的牛血清白蛋白封闭活性位点。最后用磷酸缓冲溶液冲洗,室温晾干。
同样样取300 μL的石墨烯滴加到石英片上,其他步骤同上。
将前面得到的固体刮下,置于10 mL的离心管中,加入9 mL的去离子水,超声使其均匀分散。
1.3.3.3 紫外-可见光谱的测定
以去离子水为参比液,对上述得到的两种分散液进行全波长扫描。
1.3.4 电化学表征
将清洗干净备用的玻碳电极沉积纳米金,在100 mg/L的HAuCl4溶液中在-0.2 V电势下恒电位60 s,取4 μL石墨烯悬浊液和2 μL 0.1 g/L的沙丁胺醇溶液的混合液滴涂于镀金后的玻碳电极上,室温晾干。最后用质量分数为5%的牛血清白蛋白封闭活性位点。
利用循环伏安法(cyclic voltammetry,CV)研究了不同修饰电极的电化学行为,电位范围为-0.2~0.8 V,扫描速率为100 mV/s;运用差分脉冲伏安法(differential pulse voltammetry,DPV)对孵育时间、抗体用量进行了优化,电位扫描范围在-0.2~0.5 V,脉冲幅度为50 mV,脉冲宽度为50 ms,并在优化实验条件下运用DPV进行线性范围测定、样品回收率测定。所有实验均在室温条件下进行。实验原理见图2。

图2 纳米金-石墨烯复合物修饰电极的免疫传感器检测沙丁胺醇的原理Fig.2 Principle of the modified immunosensor for salbutamol detection
1.3.5 样品的前处理
称取(1±0.005 0) g实际样品(牛肉、猪肉、鸭肉和猪肝)于10 mL的样品管中,加入沙丁胺醇标准液和3 mL乙腈-丙酮提取液(V(乙腈)∶V(丙酮)=4∶1),混合物超声振荡30 min,于2 000 r/min离心10 min,将上清液转移至氮吹管中,残渣用3 mL的相同提取液重复提取1 次,上清液合并在氮吹管中。提取物在氮吹条件下浓缩蒸发,浓缩物加入1 mL的pH 7.4磷酸缓冲溶液溶解后用于电化学分析。
2 结果与分析
2.1 紫外光谱
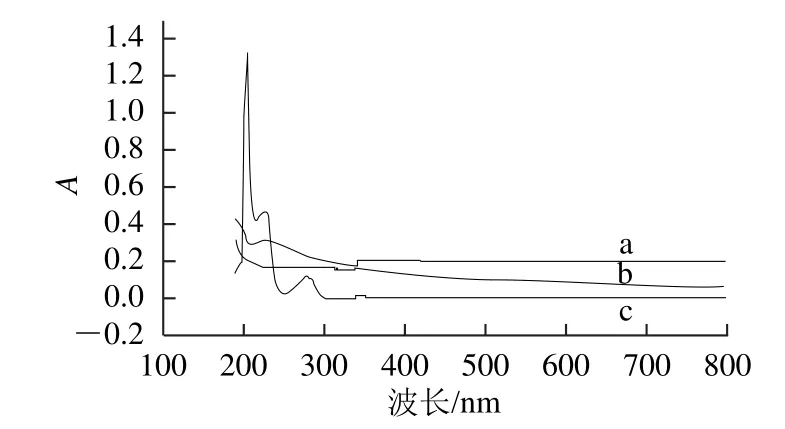
图3 电极表面修饰材料紫外-可见光谱Fig.3 Ultraviolet-visible spectra of surface-modifying materials
取0.01 g/L的沙丁胺醇标准液,以无水乙醇为参比液,进行全波长扫描,得到其在226 nm波长处有吸收峰,吸光度为0.469。见图3曲线a。以去离子水为参比液,对石墨烯及石墨烯-沙丁胺醇的分散液进行全波长扫描,图3曲线b、c,可以知道,石墨烯在226.5 nm波长处没有吸收峰,而石墨烯-沙丁胺醇的混合液在226.5 nm波长处有紫外吸收峰(峰值为0.310),因此石墨烯-沙丁胺醇混合液表现出沙丁胺醇的性质。
2.2 纳米金和石墨烯的扫描电镜分析

图4 扫描电镜图Fig.4 SEM images
从图4A可以看出,纳米金均匀的分散在电极表面,尺寸在50~400 nm之间。从图4B可以看出,石墨烯呈很薄的片状。石墨烯由一层密集的、包裹在蜂巢晶体点阵上的碳原子组成,是世界上最薄的二维材料,其厚度仅为0.335 nm。
2.3 修饰电极的电化学行为

图5 不同修饰电极的CV曲线图Fig.5 CV curves of different modified electrodes
将清洗干净的玻碳电极在2 mmol/L的K3[Fe(CN)6]的PBS溶液中扫描循环伏安法,电位范围为-0.2~0.8 V,扫描速率为100 mV/s,图5曲线a,裸电极具有一堆明显的可逆的氧化还原峰。再将修饰上石墨烯的玻碳电极以相同参数扫描循环伏安法,由于石墨烯具有优异的电化学活性,大的比表面积,突出的导热性能,增强电子的传递,因此峰值会增大(曲线b)。当电极上修饰了纳米金-石墨烯-沙丁胺醇后,峰电流明显增大,如曲线c所示,这是由于纳米金颗粒具有良好的生物相容性,高的表面积和导电性,进一步增强了电子的传递。最后将纳米金-石墨烯-沙丁胺醇修饰电极在含量为50 μL的沙丁胺醇单克隆抗体中孵育40 min,由于电极上修饰的沙丁胺醇半抗原和抗体结合,阻碍了电极传递,见曲线d,说明沙丁胺醇半抗原已经被固定在电极上。
2.4 实验条件的优化
2.4.1 反应时间
不同检测条件的影响,如免疫反应的时间对免疫的影响,分别取0、5、10、15、20、25、30、35 min,利用差分脉冲伏安法(电位扫描范围-0.2~0.5 V,脉冲幅度50 mV,脉冲宽度50 ms)得时间与孵育电流之间的关系,图6,其中0~35 min之内,电流值在逐渐减小,说明抗体和沙丁胺醇特异性结合,30~35 min之间电流值达到过饱和状态,说明抗体已经和沙丁胺醇充分特异性结合,继续增加孵育时间对DPV峰电流响应没有明显的影响。因此选择30 min为后续实验的最优时间。

图6 孵育时间对差分脉冲伏安法电流值的影响Fig.6 Relationship between incubation time and differential pulse voltammetry current
2.4.2 抗体量

图7 抗体量对差分脉冲伏安法电流值的影响Fig.7 Relationship between antibody volume and differential pulse voltammetry current
在上述最优时间为30 min条件下,通过改变沙丁胺醇单克隆抗体的体积量,利用差分脉冲伏安法(电位扫描范围-0.2~0.5 V、脉冲幅度50 mV、脉冲宽度50 ms)得抗体量与孵育电流之间的关系,见图7,其中在0~7 μL之间,电流值逐渐降低,这是由于沙丁胺醇和抗体特异性结合,7~9 μL,电流值基本不变化,说明抗体已经基本和沙丁胺醇完全特异性结合,抗体量基本达到饱和状态,因此以后的实验中取7 μL为后续实验的最佳抗体量。
2.5 线性范围和检测限
规定纳米金-石墨烯-沙丁胺醇修饰电极在只含7 μL抗体的PBS缓冲溶液中孵育后的响应电流为I0,在含有一定量游离的沙丁胺醇的孵育液孵育后的响应电流为Ix,响应电流的增加ΔI=Ix-I0。在最优化的条件下,测定了沙丁胺醇质量浓度和响应电流增加值ΔI的线性关系,见图8,随着溶液中游离的沙丁胺醇质量浓度增加,抗体与电极上修饰的沙丁胺醇结合量越小,导致Ix减小,因此响应电流的增加量越大。结果表明,ΔI与沙丁胺醇质量浓度在1×10-6~5×10-3g/L范围内呈良好的线性关系,线性回归方程为Y=0.767 75+0.002 04X(r=0.972 12),检测限为2×10-7g/L。
2.6 修饰电极的重复和稳定性

图9 修饰电极的重复性Fig.9 Stability of the modified electrode
对沙丁胺醇免疫传感器的重复性进行了研究,将纳米金-石墨烯-沙丁胺醇修饰电极重复11 次差分脉冲伏安法扫描,其峰电流变化相对标准偏差小于10%,见图9,说明实验重复性较好。
对免疫传感器的稳定性,将纳米金-石墨烯-沙丁胺醇修饰电极存放在PBS中,每天进行氧化还原标记的差分脉冲伏安法扫描,结果显示峰电流在8 d内降低值小于10%,见图10,说明制备的电极稳定性较好。

图10 修饰电极的稳定性Fig.10 Repeatability of the modified electrode
2.7 对实际样品的分析
对4 种加入不同量沙丁胺醇标准液的实际样品(牛肉、猪肉、鸭肉和猪肝)进行实验所述的前处理,进而进行测定,对每个添加量测定3 次,根据标准曲线,沙丁胺醇的回收率统计结果见表1。分析上述回收率总结得到,牛肉的回收率为92.4%,鸭肉的回收率为91.2%,猪肉的回收率为94.9%,猪肝的回收率为102.2%,其中猪肝的回收率最高。这是由于猪肝是食物排毒代谢的重要器官,沙丁胺醇易于在肝脏内聚集,所以具有很高的回收率。由此也可以知道,肝脏中积累有害物质的量会比其他部位要多。

表1 实际样品(牛肉、猪肉、鸭肉和猪肝)加标处理测试沙丁胺醇实验结果Table 1 Recoveries of salbutamol from spiked real samples of beef,pork, duck and pork liver
3 结 论
本实验构建了一种新型的符合纳米材料的高灵敏的电化学免疫传感器,结合了纳米金具有独特的电学以及良好的生物兼容性,很大的比表面积和很高的催化性能等性质以及石墨烯优异的导电性和较大的比表面积,制得了纳米金-石墨烯复合的纳米免疫传感器。将这种纳米免疫传感器应用到对沙丁胺醇的检测中,实验表明其在1×10-6~5×10-3g/L范围内呈良好的线性关系,并且具有超高的灵敏度,即检测限为2×10-7g/L,同时对牛肉、猪肉、鸭肉和猪肝等实际样品进行了加标回收的实验,也取得了满意结果。实验也表明,本实验制备的纳米免疫传感器实现了对沙丁胺醇的检测,同时对实际样品也有很高的回收率。
[1]GABIOLA C, CALONGE M A G, PORTILLO M P, et al.Validation of a method for the determination of salbutamol in animal urine by gas chromatography-mass spectrometry and its application to treated lamb samples[J].Journel of Microcolumn Separations, 1996, 8: 361-364.
[2]ZHANG Yantu, ZHANG Zhujun, SUN Yonghua, et al.Development of an analytical method for the determination ofβ2-agonist residues in animal tissues by high-performance liquid chromatography with on-line electrogenerated [Cu(HIO6)2]5-luminol chemiluminescence detection[J].Journel of Agriculture and Food Chemistry, 2007, 55(13):4949-4956.
[3]WANG Huan, ZHANG Yong, LI He, et al.A silver-palladium alloy nanoparticle-based electrochemical biosensor for simultaneous detection of ractopamine, clenbuterol and salbutamol[J].Biosensors and Bioelectronics, 2013, 49: 14-19.
[4]VANOOSTHUYZE K E I, ARTSC J M, PETEGHEM C H V.Development of a fast and simple method for determination ofβ-agonists in urine by extraction on empore membranes and detection by a test strip immunoassay[J].Journal of Agriculture and Food Chemistry, 1997, 45: 3129-3137.
[5]SHELVER W L, SMITH D J.Determination of ractopamine in cattle and sheeo urine samples using an optical biosensor analysis:comparative study with HPLC and ELISA[J].Journal of Agricultural and Food Chemistry, 2003, 51(13): 3721-3751.
[6]BRAMBILLA G, CENCI T, FRANCONI F, et al.A Loizzo Clinical and pharmacological profile in a clenbuterol epidemic poisoning of contaminated beef meat in Italy[J].Toxicology Letters, 2000, 114: 47-53.
[7]HU Lei, ZUO Peng, YE Bangce.Multicomponent meso fl uidic system for the detection of veterinary drug residues based on competitive immunoassay[J].Analytical Biochemistry, 2010, 405(1): 89-95.
[8]SHISHANI E, CHAI S, JAMOKHA S, et al.Determination of ractopamine in animal tissues by liquid chromatography- fl uorescence and liquid chromatography/tandem mass spectrometry[J].Analytical Chimmica Acta, 2003, 483(1/2): 137-145.
[9]LI Cun, WU Yinliang, YANG Ting, et al.Simultaneous determination of clenbuterol, salbutamol and ractopamine in milk by reversedphase liquid chromatography tandem mass spectrometry with isotope dilution[J].Journal of Chromatography A, 2010, 1217(50): 7873-7877.
[10]WANG Lian, LI Yuanqian, ZHOU Yunke, et al.Determination of four beta(2)- agonists in meat, liver and kidney by GC-MS with dual internal standards[J].Chromatographia, 2010, 71(7/8): 737-739.
[11]SHELVER W L, SMITH D J.Application of a monoclonal antibodybased enzyme-linkd immunosorbent assay for the dermination of ractopamine in incurred samples from food animals[J].Journal of Agricultural and Food Chemistry, 2002, 50(10): 2742-2747.
[12]HE Limin, SU Yijuan, ZENG Zhenling, et al.Determination of ractopamine and clenbuterol in feeds by gas chromatography-mass spectrometry[J].Animal Feed Science and Technology, 2007, 132:316-323.
[13]FREDY M T, SALVADOR V L, ARTURO E M, et al.Application of high-performance liquid chromatographye-UV detection to quantification of clenbuterol in bovine liver samples[J].Journal of Food and Drug Analysis, 2013, 21: 414-420.
[14]BAZYLAK G, NAGELS L J.Simultaneous high-throughput determination of clenbuterol, ambroxol and bromhexine in pharmaceutical formulations by HPLC with potentiometric detection[J].Journal of Pharmaceutical and Biomedical Analysis,2003, 32(4/5): 887-903.
[15]BLANCA J, MUNOZ P, MORGADO M, et al.Determination of clenbuterol, ractopamine and zilpaterol in liver and urine by liquid chromatography tandem mass spectrometry[J].Analytica Chimica Acta, 2005, 529: 199-205.
[16]SHEU S Y, LEI Y C, TAI Y T, et al.Screening of salbutamol residues in swine meat and animal feed by an enzyme immunoassay in Taiwan[J].Analytica Chimica Acta, 2009, 654(2): 148-153.
[17]ZHANG Yan, GAO Xiang, GAO Aihua.A biotin-streptavidin amplified enzyme-linked immunosorbent assay with improved sensitivity for rapid detection of ractopamine in muscular tissue[J].Food Analytical Methods, 2012, 5(5): 1214-1220.
[18]陈钰, 刘仲明, 王捷.纳米材料在生物传感器中的应用[J].医疗卫生装备, 2009, 30(6): 31-33.
[19]蒋文, 袁若.纳米材料在电化学生物传感器及生物电分析领域中的应用[J].分析测试学报, 2011, 30(11): 1200-1206.
[20]WU Hai, FAN Suhua, ZHANG Wenbao.Amperometric immunosensor based on covalent immobilization of new methylene blue and penicillin polyclonal antibody for determination of penicillin G in milk[J].Analytical Methods, 2014, 6(2): 497-502.
[21]ZHU Ying, CAO Yaoyao, SUN Xia.Amperometric immunosensor for carbofuran detection based on MWCNTs/GS-PEI-Au and AuNPsantibody conjugatensors[J].Sensors, 2013, 13(4): 5286-5301.
[22]LI Shengxi, ZHANG Jiong, DENG Wangping.A highly sensitive amperometric immunosensor for clenbuterol detection in livestock urine[J].Electroanalysis, 2013, 25(4): 867-873.
[23]ZHANG Lingyan, LIU Yanjun.The signal-enhanced labelfree immunosensor based on assembly of prussian blue-SiO2nanocomposite for amperometric measurement of neuron-specific enolase[J].Analytica Chimica Acta, 2014, 806: 204-209.
[24]AMBROSI A, CASTAÑEDA M T, KILLARD A J, et al.Doublecodi fied gold nanolabels for enhanced immunoanalysis[J].Analytical Chemistry, 2007, 79(14): 5232-5240.
[25]ZHANG Jingjing, CHENG Fangfang, ZHENG Tingting, et al.Design and implementation of electrochemical cytosensor for evaluation of cell surface carbohydrate and glycoprotein[J].Analytical Chemistry,2010, 82(9): 3547-3555.
[26]DAS J, AZIZ M A, YANG H.A nanocatalyst-based assay for proteins:DNA-free ultrasensitive electrochemical detection using catalytic reduction ofp-nitrophenol by gold-nanoparticle labels[J].Journal of the American Chemical Society, 2006, 128(50): 16022-16023.

