线纹香茶菜地下部分化学成分研究
孙俊哲,程 霞,赵明早,姜 北
(大理学院药学与化学学院,云南大理 671000)
线纹香茶菜地下部分化学成分研究
孙俊哲,程 霞,赵明早,姜 北*
(大理学院药学与化学学院,云南大理 671000)
目的:研究线纹香茶菜地下块状根茎的化学成分。方法:用70%丙酮冷浸提取,相关部位的主要成分通过硅胶柱层析分离纯化,依据现代波谱技术及与标准品对照的方式进行结构鉴定。结果:由乙酸乙酯部位分离得到6个化合物,分别鉴定为β-谷甾醇(1),3β-乙酰基齐墩果酸(2),3β-乙酰基乌苏酸(3),油酸(4),花柏酚(5),山楂酸(6)。结论:上述成分均为首次从该植物地下块状根茎中分离,其中2~6为首次由该植物中获得。
线纹香茶菜;地下块状根茎;萜类化合物
香茶菜属(Isodon或Rabdosia)系唇形科,全球约有150种,主产东亚,少数种产非洲东部、马来西亚延至大洋洲。我国有香茶菜属植物90种,21个变种,分布面几乎遍及全国,但以西南诸省区种类最多〔1〕。香茶菜属植物在国内多作药用,具有抗菌消炎、清热解毒、活血破瘀等功效,并用于治疗各种肝炎和抗肿瘤。目前有关该属植物的研究工作正蓬勃发展,现已在该属植物中发现二萜类化合物600余种,其中多具抗菌、抗肿瘤、降血压等活性,应用前景广阔〔2〕。
线纹香茶菜〔Isodon lophanthoides(Buch.-Ham. ex D.Don)H.Hara〕主要分布于西南地区及广西等地,民间以全草入药,可治疗急性黄疸性肝炎、急性胆囊炎、咽喉炎、妇科病、瘤型麻风,也可解草乌中毒〔1〕。前人已对该植物进行了系统的研究,从中分离得到包括松香烷二萜、三萜、甾体以及木脂素类在内的近20个成分〔3-5〕。然而迄今为止所有研究工作都集中在植物的茎叶部位,有关该植物地下部分的研究从未见有报道。与多数香茶菜属植物不同,线纹香茶菜具有块状根茎,文献资料显示同属植物类似的地下部分多具药用价值〔1,6〕,因而有必要对线纹香茶菜块状根茎进行系统研究,以全面系统地了解该植物地下部分的化学成分,为开发利用植物资源奠定基础。为此,我们对采自云南大理地区的线纹香茶菜地下块状根茎进行了初步研究,从中分离得到6个化合物,分别为β-谷甾醇(1),3β-乙酰基齐墩果酸(2),3β-乙酰基乌苏酸(3),油酸(4),花柏酚(5),山楂酸(6)。本文将相关研究工作报道如下。
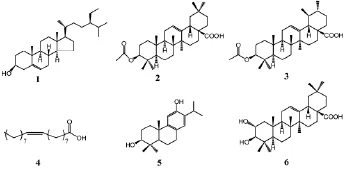
图1 化合物1~6的结构式
1 材料与方法
1.1 材料与仪器 本实验所用线纹香茶菜〔Isodon lophanthoides(Buch.-Ham.ex D.Don)H.Hara〕地下块状根茎2010年10月采自云南省大理市下关南郊大风坝,由中科院昆明植物研究所向春雷博士鉴定,植物标本(编号20101003-1b)存放于大理学院药学与化学学院姜北教授实验室。
柱色谱硅胶材料、薄层色谱硅胶G和GF254均为青岛海洋化工厂产品;凝胶(Sephadex LH-20)为瑞典Amersham Biosciences公司生产;显色方法为碘缸熏蒸显色和5%硫酸甲醇溶液浸渍后加热显色。
1H与13C NMR由大理学院分析测试中心Bruker AM-400核磁共振波谱仪测定,四甲基硅烷(TMS)为内标。
1.2 提取分离 干燥的线纹香茶菜块状根茎(13.5 kg)粉碎后用70%丙酮冷浸提取4次,提取液合并后蒸至近干,之后依次用乙酸乙酯、正丁醇萃取分配;乙酸乙酯部分蒸干得浸膏183.6 g,加入200 g左右粗硅胶(80~100目)混合拌样,之后用(200~300目)硅胶柱层析,氯仿-丙酮梯度洗脱(1∶0至0∶1),合并相同流分得13个组分。
B组分(氯仿/丙酮=9∶1):有大量晶体析出,重结晶后得到化合物1。母液经硅胶柱层析(石油醚/乙酸乙酯),相应流分采用重结晶等方法最终得到化合物2。
C组分(氯仿/丙酮=9∶1):经反复硅胶柱层析(石油醚/丙酮,纯氯仿)、Sephadex LH-20(氯仿-甲醇= 1∶1)层析,得到化合物3。
D组分(氯仿/丙酮=8∶2):反复硅胶柱层析,石油醚/乙酸乙酯、纯氯仿等溶剂洗脱,得到化合物4、5。
F组分(氯仿/丙酮=7∶3):经硅胶柱层析(氯仿/丙酮),Sephadex LH-20(氯仿-甲醇=1∶1)层析,得到化合物6。
2 实验结果
化合物1:C29H50O,无色针晶(丙酮)。硅胶薄层板上分别用3种不同溶剂系统展开时与β-谷甾醇标准品对照Rf值及显色一致,故确定该化合物为β-谷甾醇。
化合物2:C32H50O4,白色针晶(氯仿)。1H NMR(400 MHz,CDCl3)δ:5.27(1H,brs,H-12),4.51(1H,t,J=8.2 Hz,H-3),2.84(1H,dd,J=13.7,4.0 Hz,H-18),2.06(3H,s,Me-C=O),1.14(3H,s,Me-27),0.96(3H,s,Me-25),0.94(3H,s,Me-30),0.92(3H,s,Me-29),0.88(3H,s,Me-24),0.87(3H,s,Me-23),0.76(3H,s,Me-26);13C NMR(100 MHz,CDCl3)δ:38.0(t,C-1),23.5(t,C-2),80.9(d,C-3),37.7(s,C-4),55.2(d,C-5),18.1(t,C-6),32.4(t,C-7),39.2(s,C-8),47.5(d,C-9),37.0(s,C-10),22.8(t,C-11),122.5(d,C-12),143.6(s,C-13),41.5(s,C-14),27.6(t,C-15),23.4(t,C-16),45.8(s,C-17),40.8(d,C-18),46.5(t,C-19),30.6(s,C-20),33.8(t,C-21),32.4(t,C-22),28.0(q,C-23),16.6(q,C-24),15.4(q,C-25),17.2(q,C-26),25.9(q,C-27),184.7(s,C-28),23.6(q,C-29),33.1(q,C-30),171.1(s,C=O acetate),21.3(q,CH3-acetate)。上述波谱数据与文献报道波谱数据〔7〕基本一致,故确定该化合物为3β-乙酰基齐墩果酸。
化合物3:C32H50O4,无色方晶(石油醚-氯仿)。1H NMR(400 MHz,CDCl3)δ:5.23(1H,t,J=3.3 Hz,H-12),4.50(1H,m,H-3),2.18(1H,d,J=11.2 Hz,H-18),2.05(3H,s,OAc),1.07(3H,s,Me-27),0.96(3H,s,Me-26),0.96(3H,d,J=6.8 Hz,Me-30),0.87(3H,s,Me-23),0.85(3H,d,J=5.5 Hz,Me-29),0.85(3H,s,Me-25),0.76(3H,s,Me-24);13C NMR(100 MHz,CDCl3)δ:36.9(t,C-1),23.6(t,C-2),80.9(d,C-3),38.2(s,C-4),55.3(d,C-5),18.1(t,C-6),32.8(t,C-7),39.4(s,C-8),47.9(d,C-9),36.7(s,C-10),23.3(t,C-11),125.7(d,C-12),137.9(s,C-13),41.9(s,C-14),28.1(t,C-15),24.0(t,C-16),47.4(s,C-17),52.5(d,C-18),39.0(d,C-19),38.8(d,C-20),30.6(t,C-21),37.7(t,C-22),28.1(q,C-23),15.6(q,C-24),16.7(q,C-25),17.0(q,C-26),23.6(q,C-27),183.6(s,C-28),17.1(q,C-29),21.2(q,C-30),21.9(q,CH3-acetate),171.3(s,C=Oacetate)。上述波谱数据与文献报道波谱数据〔8〕基本一致,故确定该化合物为3β-乙酰基乌苏酸。
化合物4:C18H34O2,白色油脂状固体。硅胶薄层层析板上分别用3种不同溶剂系统展开时与油酸标准品对照Rf值一致,故确定该化合物为油酸。
化合物5:C20H30O2,无色晶体(氯仿)。1H NMR(400 MHz,CDCl3)δ:7.05(1H,s,H-14),6.46(1H,s,H-11),3.55(1H,dd,J=11.7,4.4 Hz,H-3),3.24(1H,m,H-15),2.75(2H,m,H-7),2.33(1H,d,J=13.0 Hz,H-1b),1.86(1H,m,H-2b),1.81(1H,d,J=3.4 Hz,H-5),1.76(2H,m,H-6),1.46(1H,m,H-1a),1.24(1H,dd,J=12.2,2.2 Hz,H-2a)1.24(3H,d,J=6.8 Hz,Me-16),1.21(3H,d,J=6.8 Hz,Me-17),1.18(3H,s,Me-18),1.06(3H,s,Me-19),0.88(3H,s,Me-20);13C NMR(100 MHz,CDCl3)δ:37.2(t,C-1),28.1(t,C-2),77.6(d,C-3),38.8(s,C-4),50.5(d,C-5),18.8(t,C-6),30.3(t,C-7),132.0(s,C-8),140.7(s,C-9),37.1(s,C-10),114.3(d,C-11),151.8(s,C-12),132.8(s,C-13),122.0(d,C-14),27.0(d,C-15),22.3(q,C-16),22.1(q,C-17),15.2(q,C-18),27.9(q,C-19),24.7(q,C-20)。以上波谱数据与文献报道数据〔9〕基本一致,故确定该化合物为花柏酚。
化合物6:C30H48O4,白色无定型粉末(石油醚-乙酸乙酯)。1H NMR(400 MHz,CDCl3)δ:5.22(1H,brs,H-12),3.56(1H,brt,J=9.0 Hz,H-2b),3.30(1H,brs,H-3a),2.89(1H,brd,J=12.5 Hz,H-18b),1.19,1.03,1.01,0.95,0.93,0.82和0.81(各3H,s,7×Me);13C NMR(100 MHz,CDCl3)δ:46.7(t,C-1),68.0(d,C-2),83.1(d,C-3),39.3(s,C-4),55.2(d,C-5),18.2(t,C-6),32.6(t,C-7),38.9(s,C-8),41.3(d,C-9),38.0(s,C-10),22.8(t,C-11),122.0(d,C-12),144.1(s,C-13),41.6(s,C-14),27.5(t,C-15),23.3(t,C-16),46.0(s,C-17),47.6(d,C-18),45.9(t,C-19),30.4(s,C-20),33.5(t,C-21),32.4(t,C-22),28.3(q,C-23),16.8(q,C-24),16.2(q,C-25),16.5(q,C-26),25.4(q,C-27),178.0(s,C-28),32.5(q,C-29),23.0(q,C-30)。上述实验结果与文献报道波谱数据〔10〕基本一致,故确定该化合物为山楂酸。
3 讨论
本研究从乙酸乙酯部位分离得到了3种不同类型的化学成分(萜类、甾体、脂肪酸),均系首次由该植物地下部分中分离得到,其中2~6为首次从该植物中分离得到。据报道化合物2对一些肿瘤细胞有良好的抑制作用〔11〕,化合物6具有抗肿瘤及抗艾滋病的药理作用〔12〕。本研究可为该植物地下部分的深入研究提供方向。
香茶菜属植物富含二萜类化合物,本研究分离二萜成分相对较少,是否说明其地下部分二萜类物质较少,尚有待进一步证明。
〔1〕《中国植物志》编辑委员会.中国植物志:66卷〔M〕.北京:科学出版社,1977:479-532.
〔2〕王勤,周至品,李爱媛.香茶菜属植物药理活性研究进展〔J〕.现代医药卫生,2008,24(3):362-363.
〔3〕罗迎春,李齐激,杨元凤.紫云产线纹香茶菜化学成分的研究〔J〕.安徽农业科学,2012,40(22):11224-11235.
〔4〕王兆全,许风呜,董华章.线纹香茶菜酸的化学结构〔J〕.天然产物研究与开发,1995,7(4):24-28.
〔5〕底雪梅,闫福林.毛叶香茶菜化学成分研究〔J〕.安徽医药,2013,17(9):1470-1472.
〔6〕国家中医药管理局《中华本草》编委会.中华本草:19卷〔M〕.上海:上海科学技术出版社,1999:140-159.
〔7〕常军民,热娜·斯木,诸年生.新疆鼠尾草的化学成分研究〔J〕.天然产物研究与开发,2001,13(1):27-29.
〔8〕王福东,丁兰,汪汉卿,等.蓝萼香茶菜三萜成分的研究〔J〕.中国中药杂志,2005,30(24):1929.
〔9〕曹聪梅,董玫,王伟,等.日本榧树果实的化学成分研究〔J〕.天然产物研究与开发,2009,21(5):737-739.
〔10〕吴月霞,叶凡,张伟,等.尾叶香茶菜茎的化学成分〔J〕.中国中药杂志,2011,36(11):1772-1775.
〔11〕徐哲.皂角刺抗肿瘤活性成分的分离鉴定与活性测定〔J〕.沈阳药科大学学报,2008,25(2):108-111.
〔12〕柳军,于东升,尚靖,等.山楂酸、科罗索酸及其衍生物抑制HL-60细胞增殖和诱导其分化的研究〔J〕.实用癌症杂志,2012,27(1):9-11.
*通信作者:姜北,教授,博士.
(责任编辑 李 杨)
Chemical Constituents from Underground Part of Isodon lophanthoides
SUN Junzhe,CHENG Xia,ZHAO Mingzao,JIANG Bei*
(College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China)
Objective:To explore the chemical constituents of tuber of Isodon lophanthoides.Methods:Compounds were separated and purified by silica gel column chromatography and their structures were elucidated on the basis of spectral analysis and chemical evidences.Results:Six constituents were isolated from ethyl acetate fraction of the extract and identified as β-sitosterol(1),3β-O-acetyloleanolic acid(2),3β-O-acetylursolic acid(3),oleic acid(4),hinokiol(5),and 2-hydroxyloleanolic acid(6).Conclusion:Compounds 1-6 are isolated from the underground part of I.lophanthoides for the first time,while 2-6 are firstly obtained from this plant as well.
Isodon lophanthoides;tuber;constituents
R284
A
1672-2345(2014)04-0001-03
10.3969/j.issn.1672-2345.2014.04.001
国家自然科学基金资助项目(81060259);云南省百名海外高层次人才引进计划基金资助项目(云组通〔2011〕123号)
2013-12-13
2014-01-08
孙俊哲,硕士研究生,主要从事药物化学研究.

