荧光碳量子点的合成与生物成像应用及生物安全性研究进展
刘佳蕙, 黄旭泽, 董益阳
(北京市生物加工过程重点实验室, 北京化工大学生命科学与技术学院, 北京 100871)
荧光碳量子点的合成与生物成像应用及生物安全性研究进展
刘佳蕙, 黄旭泽, 董益阳
(北京市生物加工过程重点实验室, 北京化工大学生命科学与技术学院, 北京 100871)
荧光探针在生命科学领域被广泛应用于生物成像领域.随着纳米技术的迅速发展, 一些新类型的纳米荧光探针应运而生.荧光碳量子点(carbon dots)以其良好的生物相容性、优异的的抗光漂白能力、长荧光寿命和宽荧光光谱区域,在生物成像方面有广泛的应用前景.重点关注近年来碳量子点在合成、生物成像以及生物安全性方面的进展, 对开发成更安全和更灵敏的碳量子点探针进行了探讨.
碳量子点; 荧光探针; 生物成像
荧光标记是生命科学研究过程中不可缺少的技术.为了实现高效的荧光标记, 发展可靠的探针是尤为重要.探针的物理化学性质很大程度上决定着检测或成像方法的成功与否.最常用的传统荧光探针主要是有机染料[1],在生物成像中广泛应用.有机染料探针的优点是成本低, 易于获得, 使用简便.然而有机染料通常存在耐光性较差、生物相容性欠佳等缺点.近年来, 纳米技术的迅速发展带来了一系列新型荧光探针[2].其中研究最广泛的是半导体纳米晶体形成的量子点(quantum dots), 它具有优越的荧光特性, 如光漂白的高耐性、组成/尺寸可控制吸收和发射位臵、宽吸收谱和窄发射谱等.尽管如此, CdSe /ZnS量子点因为含有剧毒的Cd元素, 其生物安全性引发严重争议, 极大限制了其临床应用研究.寻求更安全的量子点替代品成为了纳米荧光探针研究中的难点.
第IV族纳米颗粒, 包括碳、硅、碳化硅等, 具有化学惰性和良好的生物相容性[11], 在生物成像领域引起广泛关注.研究发现, 碳纳米粒子表面钝化后会产生强荧光, 被称为碳量子点(carbon dots).碳量子点具有高抗光漂白性、长荧光寿命、宽荧光光谱区域和生物相容性[12-15].碳量子点的荧光量子产率可以媲美有机染料和半导体量子点.碳量子点经过进一步的修饰、改性, 可用于生物成像.
本文重点概述了碳量子点合成、生物成像和安全性研究的最新成果, 并对今后的研究方向进行了探讨.
1 碳量子点的合成
碳量子点的尺寸一般小于10 nm, 起始原料可以是不同来源的碳黑、不定型碳和含碳有机化合物等.碳量子点的合成方法大致分为两大类: 由上而下(将碳黑等宏观尺寸的碳变小)和由下而上(由有机含碳化合物合成纳米级碳点).前者是通过酸氧化和表面钝化碳颗粒来实现.经过这些处理, 碳黑表面性质以及颗粒的核心结构发生改变.后一种方法包括燃烧/加热法、电化学氧化法、激光照射法和微波法.通过上述途径得到产品均为混合物,因此需要通过进一步的分离来获得荧光性能更好的碳量子点.
1.1 由上而下制备碳量子点
由上到下合成碳量子点的方法中, 第一步一般是将碳黑或灰分等进行酸处理, 碳颗粒被分解成纳米级小颗粒.碳颗粒表面亲水性官能团增加, 水溶性得到改进, 并能在碳核区域中掺杂入氮和氧等元素.这两种结构上的改变对于荧光碳量子点至关重要[16-17].值得注意的是, 只进行酸氧化, 所得碳量子点的荧光强度通常都较低.已有报道的仅通过酸化得到的碳量子点的量子产率最多只能达到0.03.需要通过进一步表面钝化, 获得量子产率更高的碳量子点[16].
钝化可以大大提高碳量子点的荧光强度.多种不同来源的碳黑通过不同的表面钝化剂处理后都显示了荧光量子产率的显著增加[12,17-25].聚乙二醇(PEG)是在一种常用的钝化剂, 也是一种常用的生物相容性较高的高分子.根据具体流程的不同, PEG分散的碳量子点的量子产率在0.013到0.2之间变化[19-22,26].将乙二醇胺(PEGN)与酸处理后的碳量子点共价连接是一个经典的反应途径(图1a).具体方法是: 首先, 用硝酸水溶液回流碳黑12 h; 随后, 用亚硫酰氯回流6 h; 第三, 将处理后的碳粒子样品与PEGN混合在一起, 并加热至120 ℃反应72 h[18-20].经过钝化, 碳量子点的量子产率从无法检测提高到0.2左右[19-20].使用PEGN钝化后, 从碳水化合物脱水得到的碳量子点的量子产率也从0.01提高到0.13[17].这种钝化法同样适用于天然气煤烟[27]、油烟[21]和活性炭[22]等碳源制备碳量子点.
除了聚乙二醇, 还可以通过其它分子, 包括聚丙酰基亚乙基-共-乙亚胺(PPEI-EI)[19]、巯基乙酸[28]、乙二胺[17]和油胺[17]等, 钝化碳量子点, 增强荧光性.例如, PPEI-EI钝化的碳量子点的量子产率超过0.1[19].考虑到PEG的高生物相容性和PEG钝化碳量子点的高量子产率(尤其是经由色谱分离后), PEG钝化的碳量子点更适合于生物标记和生物成像应用.
发光机理上, 对于碳量子点是不是存在经典的带隙吸收还有所争议.主流的观点倾向于认为碳量子点上的荧光与碳核表面钝化及表面缺陷相关.表面钝化可以稳定表面能量陷阱, 使它们发光.由于能量陷阱受纳米粒子表面的量子限域作用, 更小的尺寸有利于荧光产生[18-19].已有研究也表明, 较小且钝化更好的碳量子点的量子产率高达0.78[29].
1.2 由下而上合成碳量子点
由下而上是一种更直接的制备碳量子点的方法.由小分子为起始原料, 构建具有表面缺陷、内部掺杂以及表面官能团的碳核.合成法通常被分为两类[15]: 碳量子点由一个较大的碳结构, 如石墨[30-31]或碳纳米管[32]通过电化学氧化法制备.第二种是由糖等含碳分子经过热解制备碳量子点[33-39].Bourlinos等人[33]将柠檬酸水合物溶于水并加入2-(2-氨基乙氧基)-乙醇溶液, 将溶液在65 ℃下蒸发至干, 所得糖浆在250 ℃下水热加热2 h, 得到碳量子点.通过直接合成得到的碳量子点的量子产率可以达到0.192.Bhunia等[36]利用碳化碳水化合物的方法合成了直径小于10 nm的憎水(蓝光)和亲水(绿光)碳量子点.憎水碳量子点为300 ℃下水热加热30 min获得; 亲水的碳量子点在较低温度下水热加热得到.亲水碳量子点可以通过调节pH来控制发射波长.如橙红色亲水碳量子点的量子产率为6% - 30%, 能够很好的在细胞内成像.此外, Wu等[37]尝试了从蜂蜜出发制备碳量子点.De等[38]报道了从香蕉汁制备量子点的方法.Krysmann等[39]由生物质为原料获得了碳量子点.
1.3 碳量子点的性质
碳量子点的尺寸范围通常为1-10 nm, 在水中分散性较高.碳量子点的量子产率在0-0.78之间变化.尽管碳量子点可以在不同的波长激发下发出不同颜色的光, 碳量子点最有效的发射是在绿光的范围内(图1b).碳量子点抗光漂白效果好, 即使在激光照射下也具有良好的稳定性.
将碳量子点分离可以收集得到荧光性能更好的碳量子点组分.多种分离技术已被应用, 如电泳、超滤、柱色谱法和高速离心法等.在去除无荧光或低荧光纳米颗粒后, 碳量子点的量子产率会大幅提高[18,40].更小尺寸和更窄粒径分布的碳量子点具有更高的量子产率[24,32,41].例如, 凝胶分离后, 较小尺寸的碳量子点的量子产率很容易高于0.55(图1c)[18].Ray等人报道, 尺寸越小, 光激发效率越好[16].另外, 荧光激发光谱峰位不同的碳量子点也被分离出来, 这为多色成像提供了可能[40,42-43].碳量子点具有不同发射波长的荧光这一现象被很多研究组报道, 但是其机制仍然是一个悬而未决的问题[40,42].

图1 碳量子点的制备与荧光性质.(A)PEG1500N钝化制备碳量子点的示意图; (B)水溶液中PPEI-EI 碳量子点的吸收和荧光发射光谱; (C)碳量子点在室内灯光(左)和暗场(右)的照片[18-19].Fig.1 Preparation and luminescence properties of carbon dots.(A) schematic illustration of PEG1500Npassivated carbon dots; (B) absorption and emission spectra of PPEI-EI passivated carbon dots; (C) photographs of carbon dots under room light (left) and dark field (right)[18-19].
2 光学成像应用
2.1 细胞成像
由于独特的荧光特性, 碳量子点在体外和体内成像都有着诱人的应用前景.碳量子点具有低细胞毒性和高生物标记潜力, 用碳量子点作为荧光探针的可行性已经在细胞和动物模型中证实[44,45].通过这些实验验证, 碳量子点显示出高荧光性能和生物相容性.在本节中, 我们总结碳量子点成像的例子, 对其优点和缺点进行讨论.
碳量子点能标记Caco-2细胞[19]和MCF-7细胞[23](图2).将细胞和PPEI- EI钝化的碳量子点共孵育, 通过单光子和双光子激发共焦显微镜均可以观察到细胞内碳量子点的分布[19,23].对于MCF-7细胞而言, 碳量子点能够标记细胞膜和细胞质, 但无法进入细胞核.在4 ℃低温下, 碳量子点无法被细胞摄入, 说明碳量子点的摄取是需要能量的[23].PEG1500N钝化的碳量子点可以用于标记大肠杆菌[19,24]、小鼠P19细胞[24]和COS-7细胞[22].此外, Ray等人的报道称, 非钝化的碳量子点能够标记Ehrich腹水癌细胞(EACS), 并在常规荧光显微镜下可以直接观察[16].之后大量文献都报道了碳量子点的细胞成像, 但是少有突破性的进展, 还局限在验证性试验上.
纵览碳量子点的细胞成像研究可以发现, 目前碳量子点的体外(细胞水平)成像还处于比较初级的水平.碳量子点作为荧光剂, 有足够的亮度可以被激光共聚焦显微镜或荧光显微镜观察[19,23].除了标记细胞以外的更进一步的生物应用还没有被充分开发出来.半导体量子点生物成像的快速发展值得碳量子点应用开发者借鉴.碳量子点的尺寸范围(<10 nm)接近常规半导体量子点(<20 nm), 荧光量子产率两者也相当.碳量子点高荧光量子产率和更小的尺寸相使得其在成像领域有巨大的潜力, 如生物体内部高清晰度的三维成像、荧光共振能量转移(FRET)为基础的研究等等[46].
2.2 活体成像
碳量子点的活体荧光成像研究较少, 主要受制于碳量子点发射波长集中在蓝绿光区.已有的研究结果显示,碳量子点同样适合于活体荧光成像.
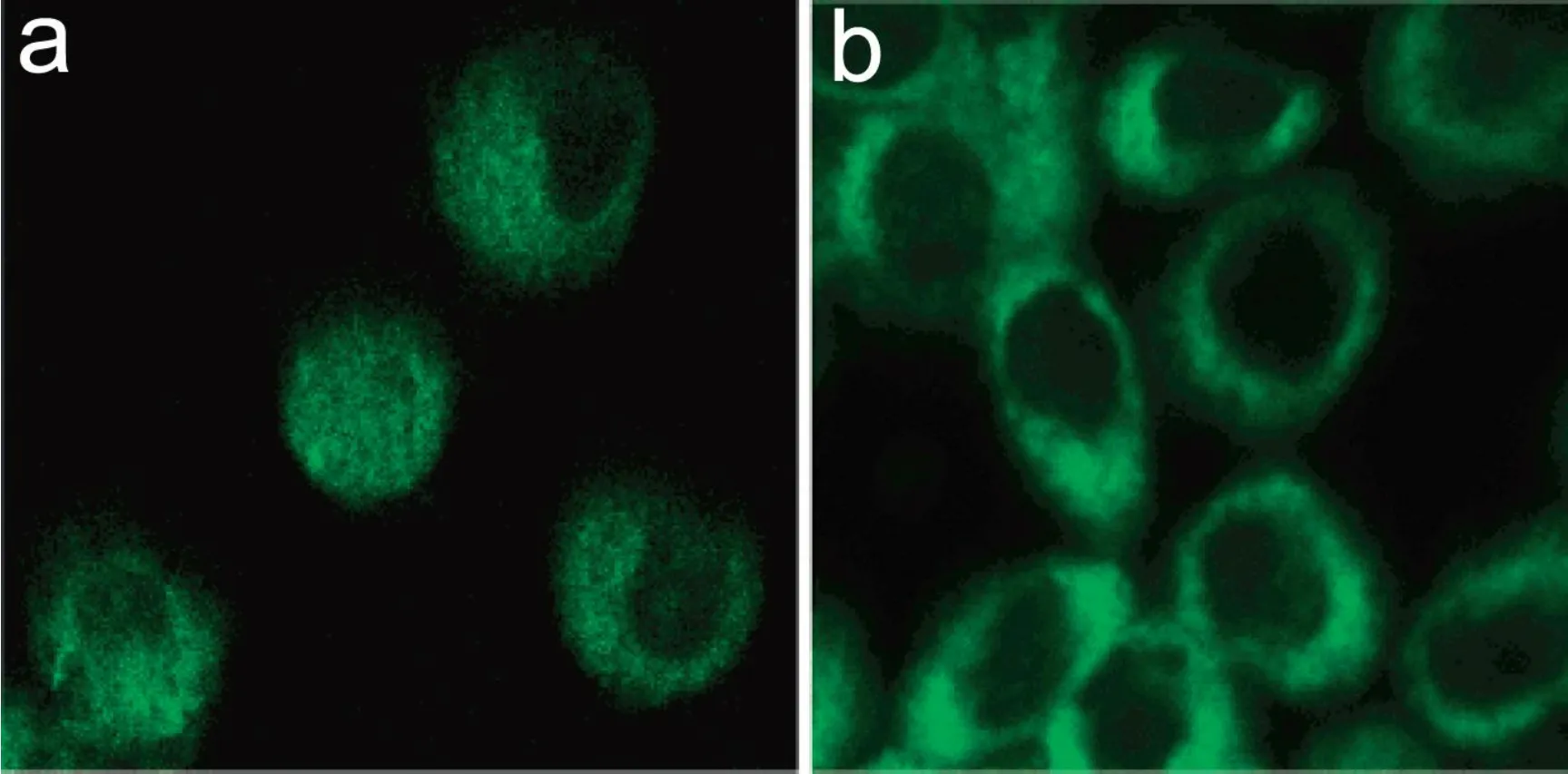
图2 碳量子点双光子成像MCF-7细胞[23]Fig.2 Two-photon fluorescence microscopy images of MCF-7 cells with internalized carbon dots[23]
经皮下、皮内或静脉(i.v.)注射, 碳量子点在体内保持强烈的荧光.碳量子点的荧光可穿透皮肤和组织进行成像[12,20].皮下注射后, 碳量子点溶液在小鼠体内形成亮斑, 并逐渐扩散到身体其他部位.皮内注射后, 碳量子点可以沿着淋巴管迁移到前哨淋巴结(图3).这一现象表明碳量子点可以用于前哨淋巴结成像, 特别是在肿瘤诊断和手术中有潜在的应用.
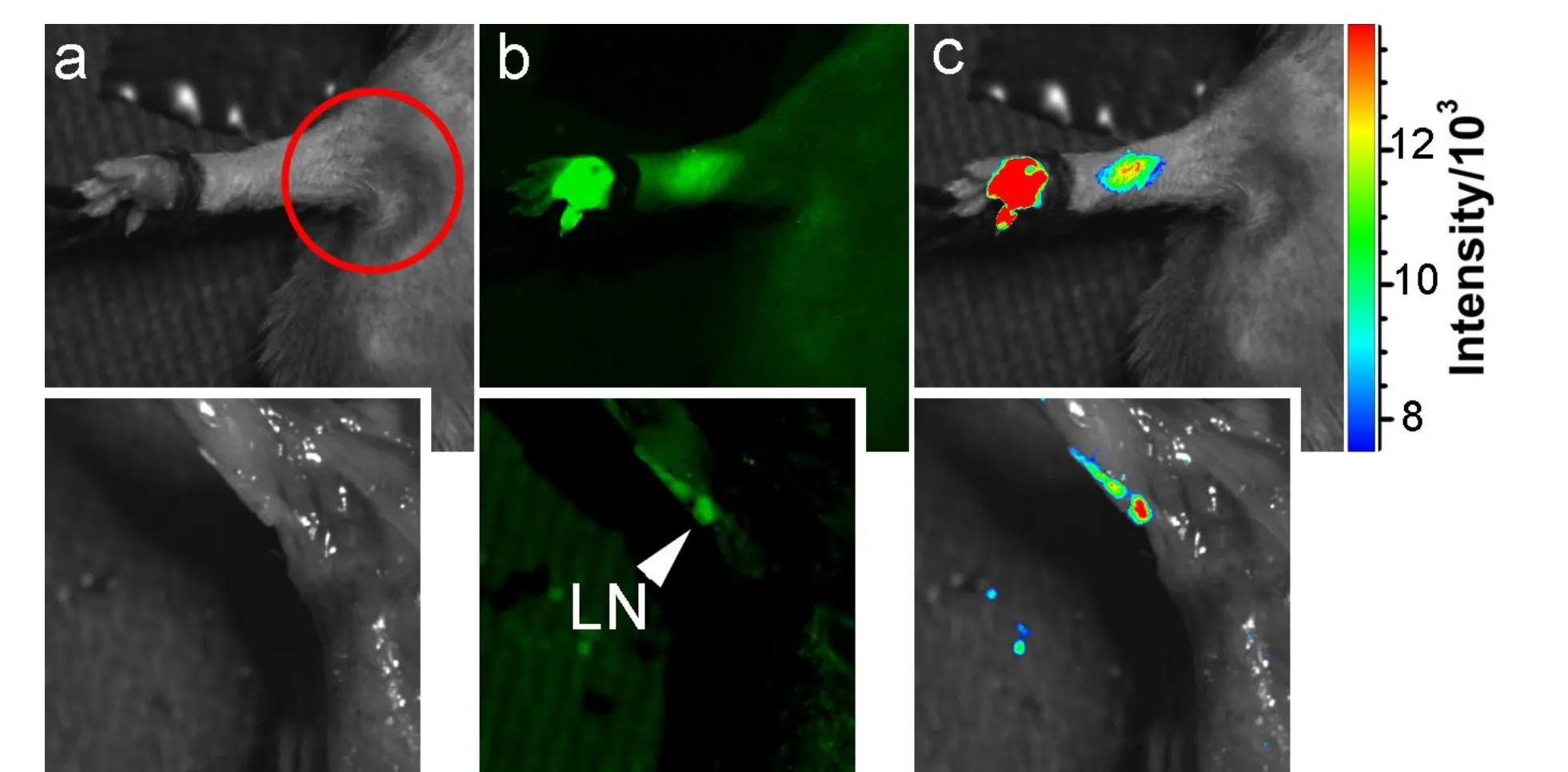
图3 碳量子点皮内注射后沿着淋巴管迁移[20]Fig.3 Migration of carbon dots along lymph vessels after intradermal injection[20]
静脉注射后, 碳量子点迅速在膀胱的富集.在静脉注射3 h后, 可在尿液中检测到明亮的荧光(图4).膀胱区域出现明显的亮斑, 而尿液的荧光强度更强.这表明碳量子点静脉注射后迅速从尿液排出体外.碳量子点也少量富集在肝脾中.双光子成像肝、脾的切片证实了这一想法[12,,20].
这些结果表明碳量子点可以用作体内荧光探针.由于在接近红外窗口附近的光最有利于生物成像, 目前发蓝绿色光的碳量子点还有待改进.这极大限制了碳量子点的深部组织成像, 需要发展能发射红光或近红外光的新型碳量子点.另一方面, 现有的活体成像结果还很简单, 没有真正发挥碳量子点的优势.今后的研究需要将碳量子点与生物活性分子等结合起来应用, 特别是发展基于碳量子点的诊断治疗体系具有重大科学价值和实际意义.
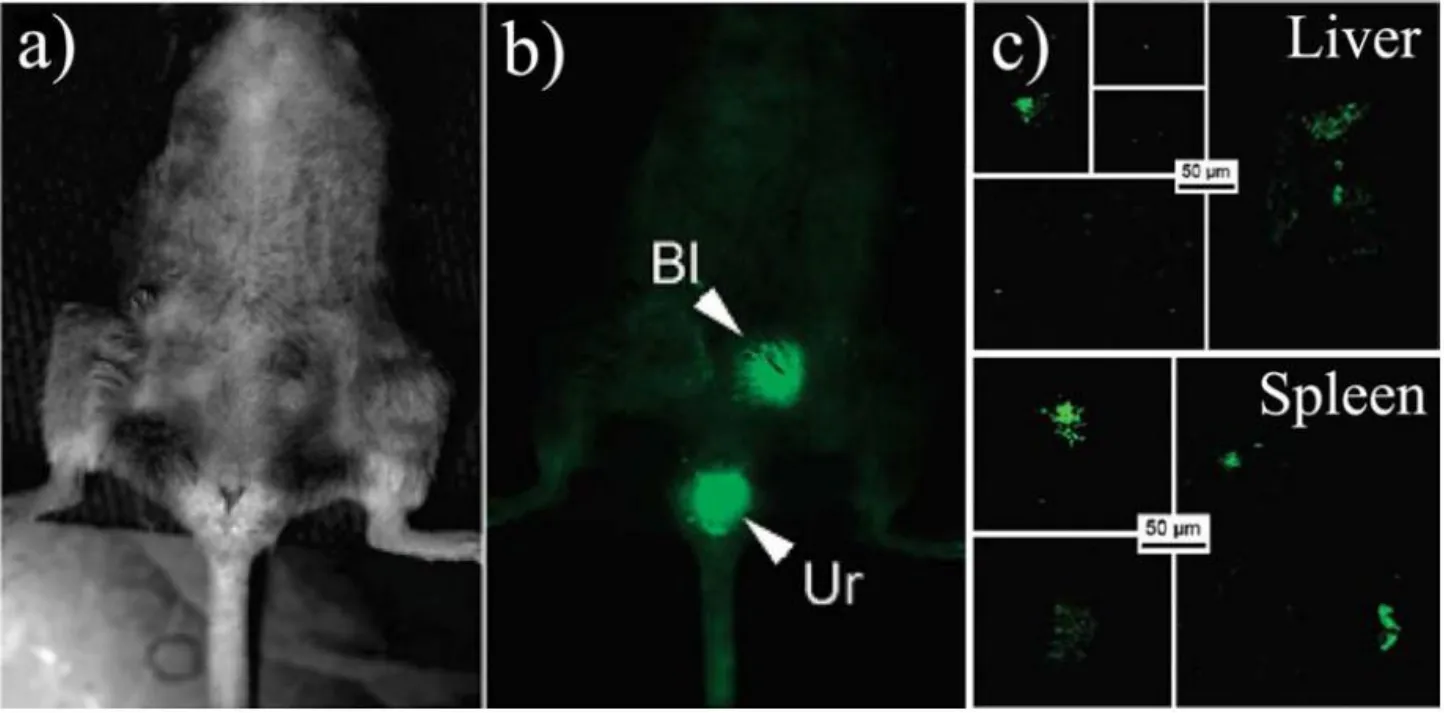
图4 碳量子点活体荧光成像.(A)明场; (B)暗场; (C)肝、脾切片的双光子荧光成像[12,20]Fig.4 In vivo imaging of carbon dots.(A) dark field; (B) bright field; (C) two-photon imaging of the sliced liver and spleen[12,20]
3 生物安全性
3.1 生物分布
碳量子点的生物安全性研究遵循吸收、分布、代谢和排泄及毒性(ADME/T)的范式.人们首先要关注的是碳量子点在体内的分布和代谢情况.
利用碳量子点的荧光性质可以在体内示踪, 对其在体内的分布进行定性研究.经皮下注射, 碳量子点会缓慢扩散, 并在注射24小时后变得无法观察[20].皮内注射的碳量子点可通过淋巴管沿上肢向上迁移, 并聚集在腋淋巴结.取出注射碳量子点 24小时后的小鼠的淋巴结, 荧光成像可以观察到强烈的荧光信号[20].静脉注射后,大部分碳量子点通过尿排泄出体外[20], 少量在肝脏和脾脏中聚集(图4c)[12,20].目前尚未有碳量子点在体内被代谢转化为其他化学成分的报道.
3.2 体外毒性
碳是组成生物体的几个基本元素之一.碳材料通常具有化学惰性的, 并且不会释放有毒元素[11,47].然而,纳米材料由于尺寸效应和界面效应而往往具有比传统材料更高的化学活性, 进而可能产生较高的生物毒性.例如, 富勒烯和碳纳米管的许多生物不良影响已被报道[48].因此, 为了保障碳量子点的安全应用, 必须对其的毒性和生物相容性进行评估.
在细胞水平, 碳量子点的毒性评估在许多研究小组开展.这些研究显示没有任何表面官能化的碳量子点通常具有低毒性.Ray等人发现在接触高达100 μg/ mL剂量的碳量子点后, HepG2细胞仍保持着80%左右的细胞活力[16].Zhao等人也报道了相似的结果.他们测试了4 mg/mL的碳量子点对人类肾脏293细胞的细胞活力影响, 发现碳量子点的安全性较高[28].此外, 剂量为0.4 mg/mL裸碳量子点对于MCF-7和人类大肠腺癌HT-29细胞均无显著毒性作用[49].
表面钝化的碳量子点的细胞毒性则与表面修饰基团密切相关.我们对不同钝化剂钝化的碳量子点的细胞毒性进行了比较.MTT和台盼蓝测定法被用来评价纳米材料细胞毒性.对于MCF-7和HT-29两种细胞系, 我们发现碳量子点裸核和PEGN钝化的C-Dos对细胞增殖、活力和死亡率影响均较低(图5)[12].由于自身毒性较高, PPEI-EI使得其钝化的碳量子点显示了较高的细胞毒性.值得提到的是, PPEI-EI钝化的碳量子点比PPEI-EI本身在同等浓度下具有更高的细胞毒性[49].我们推测, PPEI-EI的憎水部分与碳核表面由于疏水相互作用充分结合,而亲水部分, 尤其是具有生物活性的氨基部分, 则暴露在碳量子点的外表面, 加大了PPEI-EI的细胞毒性.
3.3 体内毒性
碳量子点的体内毒性研究的还较少.Yang等用CD-1小鼠为模型研究了碳量子点在体内的毒性.该研究中检测了两个重要的肝功能指标: 丙氨酸氨基转移酶(ALT)和AST; 三个肾功能指标: 尿酸, 血尿素氮和肌酐.在注射碳量子点后, Yang等监测了这些指标的变化情况, 并对肝、脾、肾等组织进行了病理组织学检查.结果都显示了碳量子点较好的生物相容性[12].这表明碳量子点对动物不产生明显的毒性.

图5 PEG钝化的碳量子点(黑色)与钝化剂PEG(白色)的细胞毒性对比[12]Fig.5 Cytotoxicity of PEG passivated carbon dots (black) and PEG (white)[12]
4 展望
当前研究最广泛的量子点主要是由有毒金属元素和非金属元素的化合物组成, 他们大部分具有较高的毒性和较高的生产成本.寻求生物相容性好的替代品是一个富有挑战性和实际应用价值的课题.荧光碳量子点由生物相容性优异的碳元素作为核心组件并具有良好的光学性能, 因而吸引了科学家极大的关注, .
高亮度和小尺寸是碳量子点最具吸引力的两个优点.碳量子点能够在进入细胞或动物体后仍保持荧光性能.碳量子点的平均尺寸小于10nm, 可用为荧光探针示踪生物大分子或生物反应过程.传统半导体量子点的生物应用研究值得碳量子点研究者参考.例如, 将半导体量子点通过共价交联或非共价吸附连接到生物分子, 如蛋白质和DNA上, 研究蛋白质的构形变化.将半导体量子点作为应用开发的参考, 碳量子点的生物医学应用可以少走很多弯路.此外, 碳量子点也可以发展处具有自身特点的生物医学应用, 例如利用碳本身的多色信号发展多通路检测等.
另一方面, 合成性能更优异的碳量子点也是研究的一个热点.目前, 碳量子点荧光光谱的发射区间还不是很理想.众所周知, 生物组织在近红外区域对光的吸收最小, 称为“近红外窗口”.现有的碳量子点主要是发出蓝色或绿色的光, 而这个波段的光在会被生物体部分吸收, 不适合于深层成像.已经分离出橙色荧光碳量子点, 尽管其量子产率还不够高, 仍然为研发长发射波长的碳量子点提供了思路.
综上所述, 一个理想的纳米荧光成像材料应该具备这些特点: 高亮度、小尺寸、红色或近红外红光发射光谱以及良好的生物相容性.碳量子点可能同时具备上述所有优点, 具有极大的前景.随着研究深入开展, 必将得到光学性能更优异的碳量子点, 进一步推动其生物成像应用.
[1]WEISSLEDER R, ROSS B D, REHEMTULLA A, et al.Molecular Imaging: Principles and Practice[M].People's Medical Publishing House, 2010.
[2]WALLING M A, NOVAK J A, SHEPARD J R E.Quantum dots for live cell and in vivo imaging[J].Int J Mol Sci, 2009, 10 (2): 441-491.
[3]SMITH A M, DAVE S, NIE S, et al.Multicolor quantum dots for molecular diagnostics of cancer[J].Expert Rev Mol Diagn, 2006, 6 (2): 231-244.
[4]GIEPMANS B N G, ADAMS S R, ELLISMAN M H, et al.The fluorescent toolbox for assessing protein location and function[J].Science, 2006, 312 (5771): 217-224.
[5]MICHALET X, PINAUD F F, BENTOLILA L A, et al.Quantum dots for live cells, in vivo imaging, and diagnostics[J].Science, 2005, 307(5709): 538-544.
[6]GILL R, ZAYATS M, WILLNER I.Semiconductor quantum dots for bioanalysis.Angew[J].Chem Int Edit, 2008, 47(40): 7602-7625.
[7]DERFUS A M, CHAN W C W, BHATIA S N.Probing the cytotoxicity of semiconductor quantum dots[J].Nano Lett, 2004, 4(1): 11-18.
[8]KIRCHNER C, LIEDL T, KUDERA S, et al.Cytotoxicity of collodal CdSe and CdSe/ZnS nanoparticles[J].Nano Lett, 2005, 5(2): 331-338.
[9]GEYS J, NEMMAR A, VERBEKEN E, et al.Acute toxicity and prothrombotic effects of quantum dots: Impact of surface charge[J].Environ Health Persp, 2008, 116 (12): 1607-1613.
[10]LIN P, CHEN J W, CHANG L W, et al.Computational and ultrastructural toxicology of a nanoparticle, Quantum Dot 705, in mice[J].Environ Sci Technol, 2008, 42(16): 6264-6270.
[11]FAN J Y, CHU P K.Group IV Nanoparticles: Synthesis, properties, and biological applications[J].Small, 2010, 6 (19): 2080-2098.
[12]YANG S T, WANG X, WANG H F, et al.Carbon dots as nontoxic and high-performance fluorescence imaging agents[J].J Phys Chem C, 2009, 113 (42): 18110-18114.
[13]YUAN Y, WANG X, JIA G, et al.Pulmonary toxicity and translocation of nanodiamonds in mice.Diam[J].Relat Mater, 2010, 19(4): 291-299.
[14]YUAN Y, CHEN, Y W, LIU J H, et al.Biodistribution and fate of nanodiamonds in vivo[J].Diam Relat Mater, 2009, 18(1): 95- 100.
[15]BAKER S N, BAKER G A.Luminescent carbon nanodots: Emergent nanolights[J].Angew Chem Int Edit, 2010, 49(38): 6726-6744.
[16]RAY S C, SAHA A, JANA N R, et al.Fluorescent carbon nanoparticles: Synthesis, characterization, and bioimaging application[J].J Phys Chem C, 2009, 113(43): 18546-18551.
[17]PENG H, TRAVAS-SEJDIC J.Simple aqueous solution route to luminescent carbogenic dots from carbohydrates[J].Chem Mater, 2009, 21(23): 5563-5565.
[18]WANG X, CAO L, YANG S T, et al.Bandgap-like strong fluorescence in functionalized carbon nanoparticles[J].Angew Chem Int Edit, 2010, 49(31): 5310-5314.
[19]SUN Y P, ZHOU B, LIN Y, et al.Quantum-sized carbon dots for bright and colorful photoluminescence[J].J Am Chem Soc, 2006, 128(24): 7756-7757.
[20]YANG S T, CAO L, LUO P G, et al.Carbon dots for optical imaging in vivo[J].J Am Chem Soc, 2009, 131(32): 11308-11309.
[21]MAO X J, ZHENG H Z, LONG Y J, et al.Study on the fluorescence characteristics of carbon dots[J].Spectrochim Acta A, 2010, 75 (2): 553-557.
[22]QIAO Z A, WANG Y F, GAO Y, et al.Commercially activated carbon as the source for producing multicolor photoluminescent carbon dots by chemical oxidation[J].Chem Commun, 2010, 46(46): 8812-8814.
[23]CAO L, WANG X, MEZIANI M J, et al.Carbon dots for multiphoton bioimaging[J].J Am Chem Soc, 2007, 129(37): 11318-11319.
[24]LIU R L, WU D Q, LIU S H, et al.An aqueous route to multicolor photoluminescent carbon dots using silca spheres as carriers[J].Angew Chem Int Edit, 2009, 48(25): 4598-4601.
[25]JIANG Q, ZHANG H Y, LIU Y.Synthesis of beta-cyclodextrinmodified carbon nanocrystals and their fluorescent behavior[J].Chinese Sci Bull, 2010, 55(25): 2835-2839.
[26]SUN W, DU Y X, WANG Y Q.Study on fluorescence properties of carbogenic nanoparticles and their application for the determination of ferrous succinate[J].J Lumin, 2010, 130(8): 1463-1469.
[27]TIAN L, GHOSH D, CHEN W, et al.Nanosized carbon particles from natural gas soot[J].Chem Mater, 2009, 21(13): 2803-2809.
[28]GONCALVES H, ESTEVES DA SILVA J C G.Fluorescent carbon dots capped with PEG(200) and mercaptosuccinic acid[J].J Fluroesc, 2010, 20(5): 1023-1028.
[29]ANILKUMAR P, WANG X, CAO L, et al.Toward quantitatively fluorescent carbon-based "quantum" dots[J].Nanoscale, 2011, 3(5): 2023-2027.
[30]ZHAO Q L, ZHANG Z L, HUANG B H, et al.Facile preparation of low cytotoxicity fluorescent carbon nanocrystals by electrooxidation of graphite[J].Chem Commun, 2008(41): 5116-5118.
[31]HU S L, NIU K Y, SUN J, et al.Onestep synthesis of fluorescent carbon nanoparticles by laser irradiation[J].J Mater Chem, 2009, 19(4): 484-488.
[32]ZHOU J G, BOOKER C, LI R Y, et al.An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs)[J].J Am Chem Soc, 2007, 129 (4): 744-745.
[33]BOURLINOS A B, STASSINOPOULOS A, ANGLOS, D, et al.Surface functionalized carbogenic quantum dots[J].Small, 2008, 4 (4): 455-458.
[34]LIU Y, LIU C Y, ZHANG Z Y.Synthesis and surface photochemistry of graphitized carbon quantum dots[J].J Colloid Interface Sci, 2011, 356(2): 416-421.
[35]ZHANG B, LIU C Y, LIU Y.A Novel One-step approach to synthesize fluorescent carbon nanoparticles[J].Eur J Inorg Chem, 2010, (28): 4411-4414.
[36]BHUNIA S K, SAHA A, MAITY A R, et al.Carbon nanoparticle-based fluorescent bioimaging probes[J].Sci Rep, 2013, 3: 1473.
[37]WU L, LUDERER M, YANG X, et al.Surface Passivation of Carbon Nanoparticles with Branched Macromolecules Influences Near Infrared Bioimaging[J].Theranostics, 2013, 3: 677-686.
[38]DE B, KARAK N.A green and facile approach for the synthesis of water soluble fluorescent carbon dots from banana juice[J].RSC Adv, 2013, 3: 8286-8290.
[39]KRYSMANN M J, KELARAKIS A, GIANNELIS EP.Photoluminescent carbogenic nanoparticles directly derived from crude biomass[J].Green Chem, 2012, 14: 3141-3145.
[40]LI H T, HE X D, KANG Z H, et al.Water-soluble fluorescent carbon quantum dots and photocatalyst design[J].Angew Chem Int Edit, 2010, 49(26): 4430-4434.
[41]ZHU H, WANG X L, LI Y L, et al.Microwave synthesis of fluorescent carbon nanoparticles with electrochemiluminescence properties[J].Chem Commun, 2009, (34): 5118-5120.
[42]LIU H P, YE T, MAO C D.Fluorescent carbon nanoparticles derived from candle soot.Angew[J].Chem Int Edit, 2007, 46 (34): 6473-6475.
[43]XU X Y, RAY R, GU Y L, et al.Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J].J Am Chem Soc, 2004, 126 (40): 12736-12737.
[44]LUO P J, YANG F, YANG S T, et al.Carbon-based quantum dots for fluorescence imaging of cells and tissues[J].RSC Adv, 2014, 4: 10791-10807.
[45]LUO P J, SAHU S, YANG S T, et al.Carbon “quantum” dots for optical imaging[J].J Mater Chem B, 2013, 1: 2116-2127.
[46]MEDINTZ I L, UYEDA H T, GOLDMAN E R, et al.Quantum dot bioconjugates for imaging, labelling and sensing[J].Nat Mater, 2005, 4(6): 435-446.
[47]LU FS, GU L R, MEZIANI M J, et al.Advances in bioapplications of carbon nanotubes[J].Adv Mater, 2009, 21(2): 139-152.
[48]LEWINSKI N, COLVIN V, DREZEK R.Cytotoxicity of nanoparticles[J].Small, 2008, 4(1): 26-49.
[49]LIU J H, ANILKUMAR P, CAO L, et al.Cytotoxicity evaluations of fluorescent carbon nanoparticles[J].Nano Life, 2010, 1(1&2): 153-161.
Fluorescent carbon dots for biological imaging: preparation, application, pharmacokinetics and toxicity
LIU Jia-hui, HUANG Xu-ze, DONG Yi-yang
(Beijing Key Laboratory of Bioprocess, School of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100871, P.R.C.)
Fluorescent probes are widely used in biological imaging. The rapid advancement of nanotechnology has brought some new types of fluorescent probes. Because of their innate biocompatibility, good resistance against photobleaching, long fluorescence lifetime and wide fluorescence spectral region, fluorescent carbon quantum dots (C-Dots) are gradually evolving into promising reagents for bioimaging. In this review, the recent achievements is summarized in fluorescent C-Dots with emphases on their preparation, properties, imaging application, pharmacokinetics and toxicity.Perspectives on further investigations and opportunities to develop C-Dots into the safer and more sensitive imaging probes are discussed.
carbon dot; fluorescent probe; pharmacokinetics
Q-33
A
1003-4271(2014)06-0818-08
10.3969/j.issn.1003-4271.2014.06.04
2014-10-09
刘佳蕙(1985-), 女, 汉族, 黑龙江海林人, 讲师, 博士, 研究方向: 荧光碳纳米材料的制备和应用研究.Email: jhliu@mail.buct.edu.cn
国家自然科学基金青年基金项目(No.21301015).

