平顶山、长白山、赛罕乌拉森林土壤微生物群落结构分析
姜懿珊,肖静,罗春玲,李军,张干
1. 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广东 广州 510640;
2. 山东省东营市农业局,山东 东营 257091;3. 中国科学院大学,北京 110049
平顶山、长白山、赛罕乌拉森林土壤微生物群落结构分析
姜懿珊1,3,肖静2,罗春玲1*,李军1,张干1
1. 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广东 广州 510640;
2. 山东省东营市农业局,山东 东营 257091;3. 中国科学院大学,北京 110049
土壤微生物是整个生态系统养分和能源循环的关键和动力。土壤的生物多样性比陆地上其他任何生态系统都要丰富,这种丰富的生物多样性导致了对其群落结构和生态功能难以预测。在一系列基于分子微生物学、生物地球化学和生理学的土壤微生物群落结构研究方法中,磷脂脂肪酸技术(PLFA)以磷脂作为分析成分,因其组成和含量在同一种微生物中通常相对稳定、可遗传,且具有仅在活体微生物中存在的特性,所以,PLFA技术可指示特定生物或生物种群的存在和状况,现已被广泛运用于土壤微生物群落结构分析中,监测微生物群落的动态变化。本研究选取了中国东北地区海拔高度达1000 m以上的典型森林生态系统:小兴安岭平顶山、吉林长白山、内蒙赛罕乌拉森林土壤为研究对象,采用PLFA方法,分析了土壤中微生物的生物量和细菌Bacteria、真菌Fungus、革兰氏阳性菌Gram+Bacteria和革兰氏阴性菌Gram-Bacteria 4种微生物群落结构。在此基础上使用相关分析、主成分分析等统计方法,揭示了土壤微生物群落结构与海拔高度、森林类型及其土壤理化因子的相互关系,为开展森林生态系统生物多样性与元素循环和气候变化的相关研究提供基础资料。研究得出以下结论:(1)对我国平顶山、长白山和赛罕乌拉背景森林中不同植被类型12个土壤样品的现场测定与采样分析,结果表明,土壤总有机碳(TOC)范围为3.15%~16.3%,pH值范围为3.5~4.8,碳氮比(C/N)为12.1~18.4,土壤含水率范围为13.3%~74.5%,采样时土壤温度为8.0~18.8 °C。(2)样品的PLFAs总含量代表了土壤微生物总生物量,范围为27.39~237.63 µg·g-1。赛罕乌拉土壤中微生物的生物量(PLFAs总量)最高;而平顶山土壤中的细菌含量、真菌含量和革兰氏阳性菌显著高于其余两座山。革兰氏阳性菌与阴性菌的比值在平顶山土壤中最大(4.19),明显高于长白山(3.14)和赛罕乌拉(2.39);而真菌与细菌比值却与之相反(平顶山0.55、长白山0.69、赛罕乌拉1.05)。(3)利用SPSS软件,对不同微生物群落与环境因子进行相关分析,结果表明:细菌的含量与纬度呈显著正相关,而和土壤C/N呈显著负相关(P<0.01);真菌群落总体上与土壤C/N呈现负相关性(P<0.05)。进一步对细菌群落和代表真菌群落的两个主要PLFAs成分(C18:1ω9、C18:2ω6, 9)与土壤碳氮比做相关分析发现:C18:1与土壤碳氮比呈现显著负相关(P<0.01),而C18:2ω6, 9与土壤碳氮比的相关关系并不明显。因此,我们认为单一种类PLFA作为生物标记物随土壤碳氮比变化的灵敏度更高。(4)主成分分析表明:土壤微生物多样性主要受纬度所导致植被类型差异的影响(P <0.01),且与土壤碳氮比呈负相关、土壤含水率呈正相关(P <0.05)。
磷脂脂肪酸;森林土壤;微生物群落结构;平顶山;长白山;赛罕乌拉
土壤微生物的生物量仅占土壤总有机碳的1%~3%,但这部分有机碳却影响着土壤中所有有机质的转化,是整个生态系统养分和能源循环的关键和动力(Laverie, 1998)。土壤的生物多样性比陆地上其他任何生态系统都要丰富,这种丰富的生物多样性导致了对其群落结构和生态功能难以预测(Fierer和Schimel, 2003)。土壤微生物通常与土壤矿物和有机质结合在一起,有多种赋存类型,且大部分微生物不能通过分离培养的方法获得(Joseph等, 2003),因此,传统的培养方法和显微技术(Alexander, 1977)难以精确定量的描述土壤微生物的群落结构(Torsvik等, 2002)。随着现代微生物研究技术的发展,一系列基于分子微生物学、生物地球化学和生理学的土壤微生物群落结构研究方法被广泛应用(刘开朗等, 2010; 吴才武等, 2011),包括基于群落水平的生理学谱图分析(CLPP)(吴则焰等, 2013)、基于PCR的核酸分析(Case等, 2007)和磷脂脂肪酸分析(刘微等, 2011)。
磷脂是所有生物活细胞重要的膜组分,在真核生物和细菌 Bacteria的细胞膜中分别占 50%和98%(Lechevalier等, 1988)。磷脂脂肪酸(PLFA)作为磷脂的构成成分,具有结构多样性和生物特异性的特点,其组成和含量在同一种微生物中通常相对稳定,并且可遗传。土壤中PLFA的存在及其丰度可指示特定生物或生物种群的存在和状况。由于磷脂在细胞死亡后迅速降解(厌氧条件下2 d,好氧情况下12~16 d),活体细胞外的磷脂含量通常很少(Paul, 2006),故可以指示土壤中的活体微生物。基于该特性,PLFA技术现已被广泛运用于土壤微生物群落结构分析中,监测微生物群落的动态变化(Balkwill等, 1988; Lalor等, 2007)。
本研究选取了中国东北地区海拔高度达 1000 m以上的典型森林生态系统:小兴安岭平顶山、吉林长白山、内蒙赛罕乌拉森林土壤为研究对象,采用PLFA分析方法,分析了土壤中微生物的生物量和细菌、真菌Fungus、革兰氏阳性菌Gram+Bacteria和革兰氏阴性菌Gram-Bacteria 4种微生物群落结构,旨在揭示土壤微生物群落结构与海拔高度、森林类型及其土壤理化因子的相互关系,为开展森林生态系统生物多样性与元素循环和气候变化的相关研究提供基础资料。
1 材料和方法
1.1 样品点概况
平顶山位于桃山林业局新兴林场与奋斗林场的顶界,主峰地理坐标东经128°28′,北纬46°38′,海拔 1429 m。属大陆性季风气候,四季气温变化较大,年平均气温1.1度,冰雪期一百八十多天。地带性植被类型为以红松Pinus koraiensis Sieb. et Zucc.为优势的针阔混交林,属于中国东北区长白植物区系小兴安岭亚区,山顶侧面植被不全,西北坡由乳白色大理岩构成,岩体裸露,山顶盛产偃松(孟庆光, 2011)。地带性土壤为暗棕壤,并且以山地暗棕壤为主,山间谷底、山间盆地及河谷阶地等部位分布有面积较广的白浆土、草甸白浆土、泥炭沼泽土和泥炭土,受气候和植被条件影响,该地区土壤母质风化作用较迅速,成土过程较强,土层较厚。
长白山位于吉林省东南部,地处东经 127°42′─128°16′,北纬41°41′─42°5′,海拔706~2261 m。气候属于受季风影响的温带大陆性山地气候,年平均温度3~7 ℃,年平均降水量700~1400 mm。长白山植被具有典型的垂直地带性,自下而上为阔叶红松林(1100 m以下)、云冷杉林Abies fabri (Mast.) Craib(1100~1700 m)、亚高山岳桦林Betula ermanii Cham.(1700~2000 m)、高山苔原Tundra(2000 m以上)(吴昊, 2012)。土壤海拔800~1200 m以下为山地暗棕壤,在山间盆地、河谷阶地发育有白浆土。向上顺次为山地漂灰土(1200~1900 m)、山地寒漠土(1900~2170 m)。
赛罕乌拉位于内蒙古自治区赤峰市巴林右旗北部,地理坐标东经118°18′─118°55′,北纬43°59′─44°27′,主峰海拔1940 m。气候属中温带半湿润温寒气候区,年均气温2 °C,年降水量400 mm。赛罕乌拉主峰有明显的植被垂直带谱。海拔由低至高分布规律是草原沟谷谷杂木林虎榛子 Ostryopsis davidiana Decaisne、杜鹃灌丛山杨 Rhododendron dumicola Tagg et Forrest 、 白 桦 林BetulaplatyphyllaSuk(阳坡为蒙古栎林 Quercus semecarpifolia Smith)云杉林Picea asperata Mast.华北落叶松林Larix principis-rupprechtii Mayr(岳桦林)亚高山草甸。海拔1940 m为高山林线(张书理等, 2008)。土壤主要以山地黑土、灰黑土、暗棕壤和暗栗钙土为主。(图1)
充分考虑海拔高度和森林植被带分布的变化,于2012年9月至2012年12月,在上述三座山共设置了12个采样点进行采样(表1)。采样点的海拔高度为565~2000 m,涉及的森林生态系统类型包括阔叶林、针叶林、针阔混交林、阔叶混交林、高山苔原等。每个采样点都采集了腐殖质层(O层)、淋溶层(A层)、沉积层(B层)和母质层(C层)森林土壤,其中淋溶层(A层)为微生物存最为活跃的土层(陈庆强等, 2005),用于本论文的研究。采集后的土壤密封保存并立即带回实验室,去除石砾、杂物和较粗的植物根系,于-20 °C冷冻保存。实验分析土壤以烘干法测定含水率后置于冷冻干燥机中,-50 °C冷冻干燥后,用玛瑙研磨至80目,储存于-20 °C待分析。
图1 平顶山、长白山、赛罕乌拉位置示意图Fig. 1 Locations of Pingding Mountain, Changbai Mountain and Saihanwula Mountain
1.2 土壤理化性质测定
每个采样点随机抽取3份土壤样品用于理化性质测定。土壤pH用pH计(上海雷磁PHSJ-4F型)和pH试纸分别测定后校正,溶剂为1 mol·L-1氯化钾溶液,水土比为2.5:1。土壤总有机碳和碳氮比用Elementar元素分析仪(Vario EL III)测定。土壤理化性质测定结果见表2。
1.3 土壤微生物PLFA提取
PLFA提取参照 Bligh-Dyer(1959)方法。用氯仿/甲醇/柠檬酸缓冲液(2:1:0.8)混合溶剂超声提取有机质(Frostegård and Bååth, 1996),将所得的有机质进行硅胶柱层析,分别用10 mL氯仿、20 mL丙酮和10 mL甲醇冲洗中性脂、糖脂和极性脂。其中,PLFA存在于极性脂中。PLFA的甲酯化使用温和碱性甲醇分解法(White等, 1979):将PLFA溶于0.2 mol·L-1氢氧化钾甲醇溶液中,37 °C恒温15 min后加入醋酸中和,用正己烷/氯仿(4:1)溶液萃取上层有机相。萃取所得磷脂脂肪酸甲酯(FAME)氮吹至干,加入内标十九酸甲酯(C19:0),-20 °C保存待分析。
1.4 表征土壤微生物的PLFAs
PLFA的定性分析根据色谱质谱联用仪(GC-MS)测定的总离子流图中FAME标样的保留时间(RRT’s)来进行。本研究使用了两种标样进行定性分析:一个是美国NU-CHEK公司生产的型号为GRS617的40种标准脂肪酸甲酯的混合样品;一个是美国 Sigma公司生产的型号为 BAME 47080-U的26种标准脂肪酸甲酯的混合样品。本研究中共指认了39种PLFAs用于分析。
微生物总生物量用PLFAs总含量(µg·g-1)来表征;微生物群落结构用目标微生物群落占总PLFAs百分比来表征,具体如下:细菌(B)生物量通过iC15:0,aC15:0,C15:0,iC16:0,C16:1ω9,C16:1ω7t,iC17:0,C18ω7和cycC19:0来表征;真菌(F)生物量通过亚油酸C18:2ω6和C18:1ω9的含量来表征(Dobbs, 1988);革兰氏阳性菌(G+)生物量通过 iC15:0,aC15:0,iC16:0,iC17:0的含量来表征;革兰氏阴性菌(G-)生物量则通过cycC17:0,C16:1ω7c,C14:0,C15:0,C17:0的含量来表征(Djukic等, 2010)。
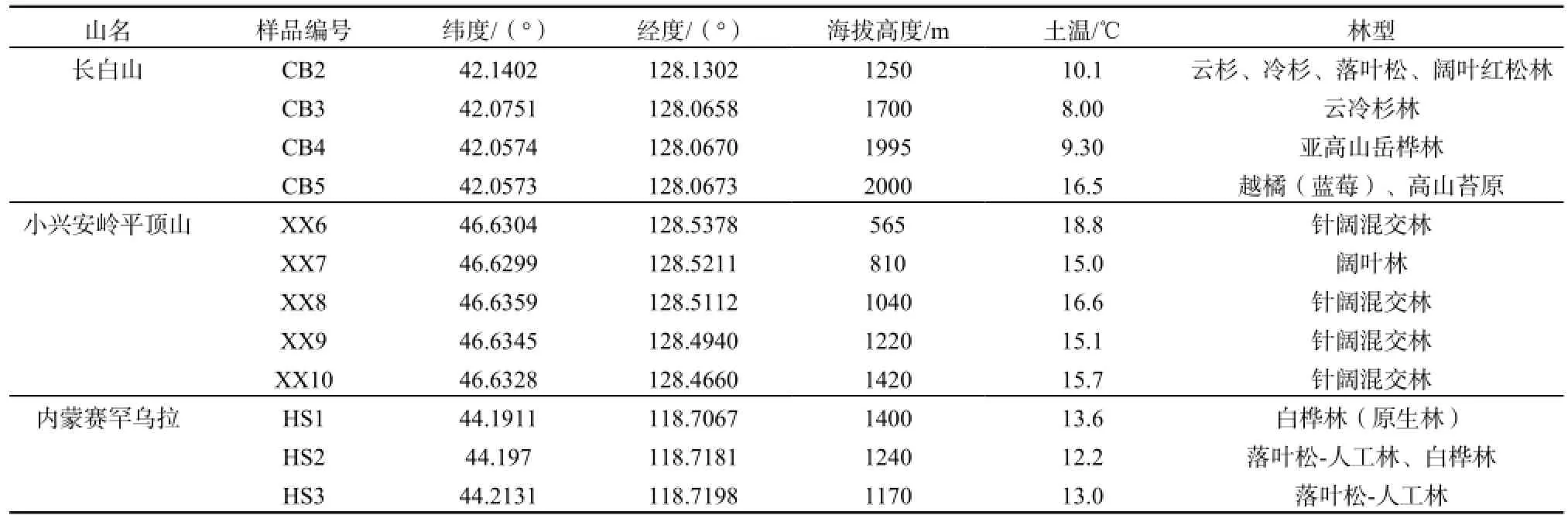
表1 采样点信息Table 1 Information on sampling sites
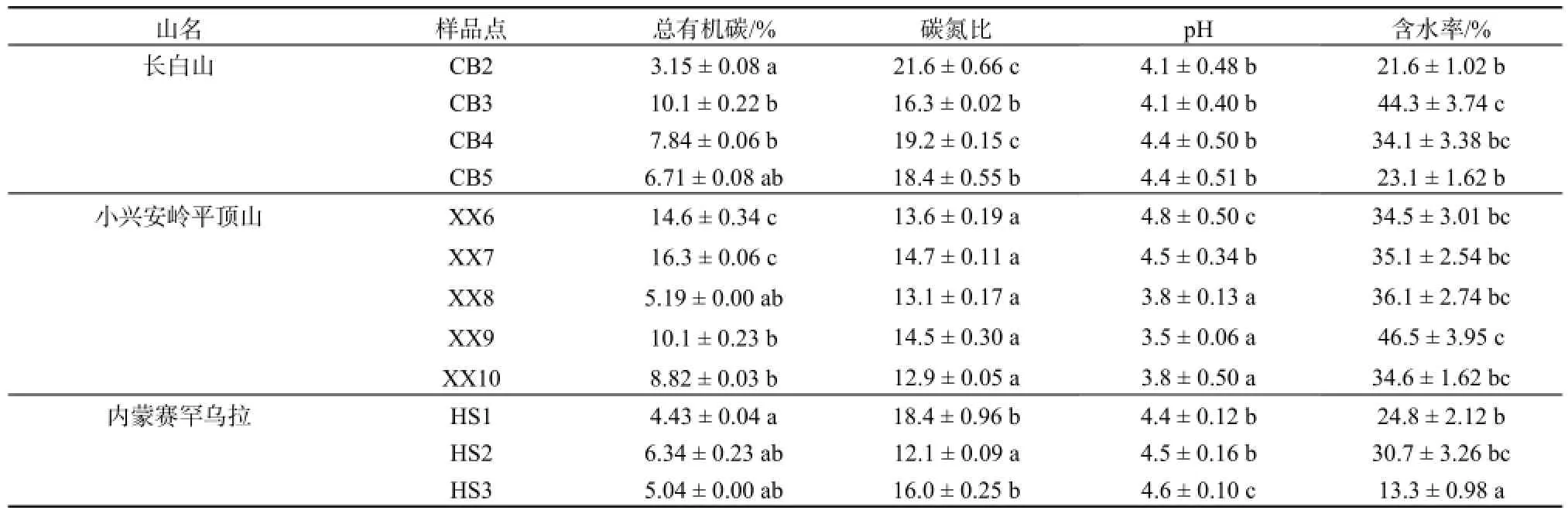
表2 土壤理化性质Table 2 Soil physicochemical properties. Different letters denote significant differences within columns (one-way ANOVA followed by Tukey’s multiple comparison test)
1.5 仪器分析
数据统计分析采用 SPSS19.0软件,测定结果以平均值表示。磷脂脂肪酸含量用Excel 2010软件作图。采用Pearson相关分析检测土壤中脂肪酸与环境变量的关系。土壤微生物群落结构用SPSS19.0的主成份分析法(Principal components analysis,PCA )进行分析和作图。
2 结果
2.1 土壤理化性质
总体来看,平顶山土壤的有机碳含量最高,尤其是低海拔地区,达到15%以上;其次是长白山,赛罕乌拉的有机碳含量最低。含水率分布与有机碳分布具有相似性。而长白山土壤的碳氮比为三座山中最高,均为15以上,平顶山最低,均为15以下。三座山土壤 pH变化范围不大,均为酸性土壤(pH=3.5~4.8)。这与长白山森林土壤(Zhang等, 2013)以及德国温带森林土壤(Borken等, 2002)的相关数据相近。
2.2 土壤微生物的生物量和群落组成
三座山中,赛罕乌拉森林土壤中的微生物生物量(PLFAs总含量)显著高于其余两座山,分别是平顶山的2倍和长白山的3倍(图2A)。
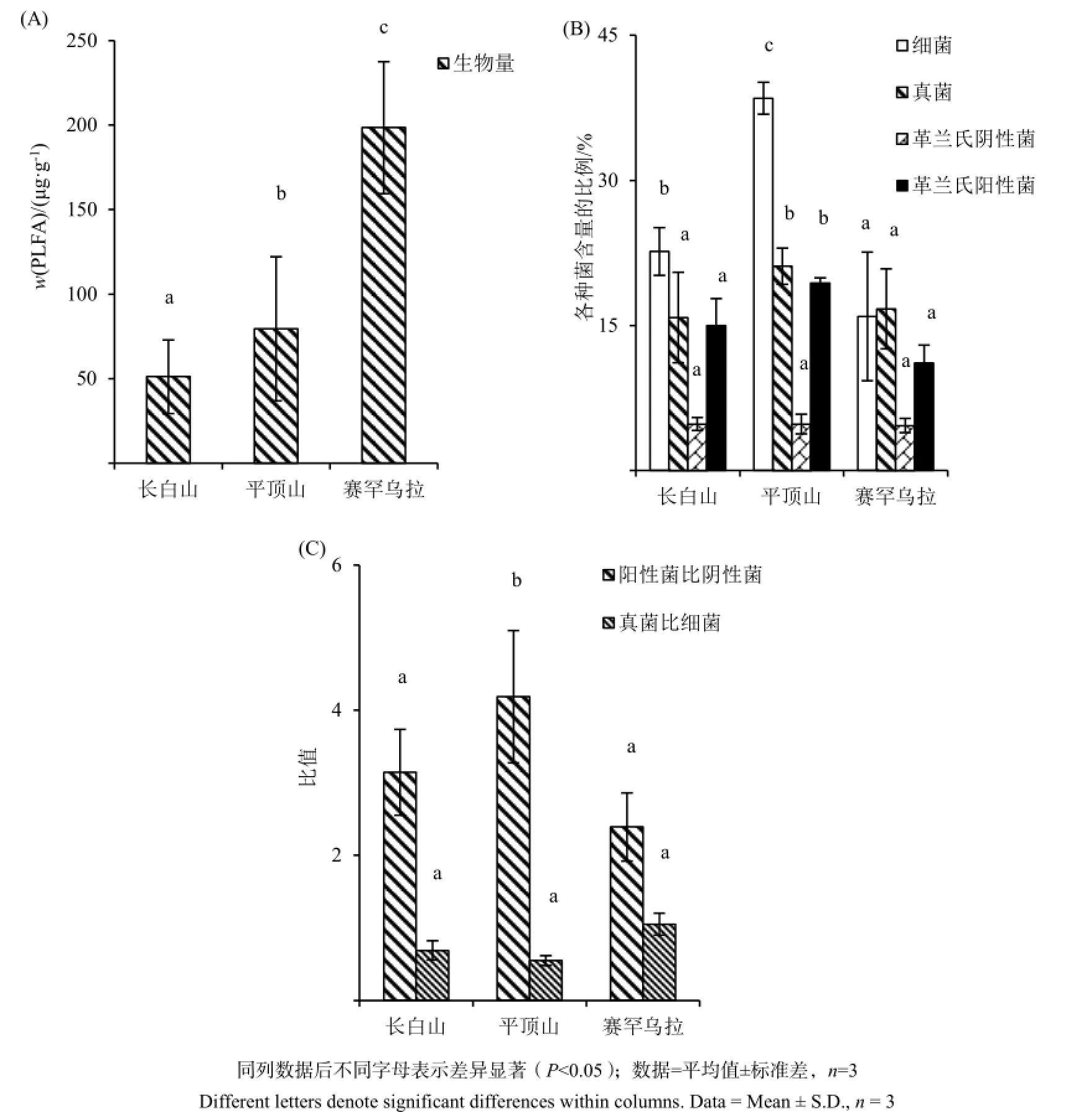
图2 背景森林土壤中PLFAs总量(A)、细菌、真菌、革兰氏阴性菌、革兰氏阳性菌和革兰氏阴性菌含量(B)和革兰氏阳性菌与革兰氏阴性菌、真菌与细菌比值(C)Fig. 2 Microbial biomass (A), bacteria, fungi, gram positive bacteria, gram negative bacteria (B) , ratios of gram positive bacteria to gram negative bacteria and fungi to bacteria (C) in background forest soils
位于高纬度的平顶山生物群落结构与长白山、赛罕乌拉有明显差异。总体来看,平顶山各微生物群落的含量百分比均高于其余两座山。尤其是细菌群落含量,是长白山细菌含量的将近1倍,高出赛罕乌拉细菌含量1倍有余。长白山和赛罕乌拉的真菌含量水平相同,均略低于平顶山的细菌含量。革兰氏阳性菌含量分布呈现递减趋势:平顶山>长白山>赛罕乌拉。革兰氏阴性菌群落含量没有在三座山中呈现出显著差别,且都处于较低水平。(图2B)
对表征微生物群落变化的两个指标(阳性菌比阴性菌,真菌比细菌)进行分析,发现两个指标分布截然相反。阳性菌与阴性菌的比值顺序为:平顶山>长白山>赛罕乌拉。而真菌与细菌的比值顺序为:赛罕乌拉>长白山>平顶山。(图2C)
2.3 土壤微生物丰富度与土壤理化性质相关分析
将三座山土壤微生物群落结构指标(真菌含量、细菌含量、革兰氏阳性菌含量、革兰氏阴性菌含量)与土壤理化性质做相关分析,结果表明:细菌的含量与纬度呈显著正相关,而和土壤碳氮比呈显著负相关(P<0.01),其余微生物含量与土壤理化性质未呈现显著相关性(表3)。真菌群落总体上与土壤碳氮比呈现负相关性(P<0.05)。进一步对细菌群落和代表真菌群落的两个主要PLFAs成分(C18:1ω9、C18:2ω6,9)与土壤碳氮比做相关分析发现,细菌群落整体与土壤碳氮比都呈现很好的负相关;C18:1与土壤碳氮比呈现显著负相关,而 C18:2ω6,9与土壤碳氮比的相关关系并不明显(图3)。因此,我们认为是C18:1ω9所代表的真菌群落与土壤碳氮比呈现的显著相关性导致了真菌群落整体与土壤碳氮比呈现出了相关性。单一种类PLFA作为生物标记物随土壤碳氮比变化的灵敏度更高。
2.4 土壤微生物多样性分析
对表征土壤微生物群落的典型 PLFAs进行主成分分析(PCA),发现前两个成分PC1、PC2分别解释了微生物群落结构总变异的31.9%和21.9%。三座山的不同样品点明显分布在 PC1主成分的两边。其中高纬度的平顶山样品点分布于PC1坐标轴右侧,相对低纬度的长白山和赛罕乌拉分布于PC1坐标轴左侧。不同林型的和海拔高度的样品点明显分布在PC2主成分的两边。海拔1000~1500 m地区样品点集中分布在 PC2主成分靠近坐标轴上下两侧,高海拔和低海拔地区样品倾向分布于PC2主成分坐标轴上下两端。针阔混交林样品点分布在PC2坐标轴靠近坐标轴上下两侧,单一类型林型(针叶林、阔叶林、苔原)分布于PC2主成分远离坐标轴上下两端。(图4,图5)PC1反映出纬度对微生物群落变化的作用,PC2反应出了海拔高度和林型对微生物群落变化的综合作用。

图3 背景森林土壤中细菌群落、C18∶2ω6,9和C18∶1ω9含量与土壤碳氮比(C/N)的关系Fig. 3 Correlation of bacterial community, C18:2ω6,9 and C18:1ω9 with the ratio of soil carbon to nitrogen in background forest soil
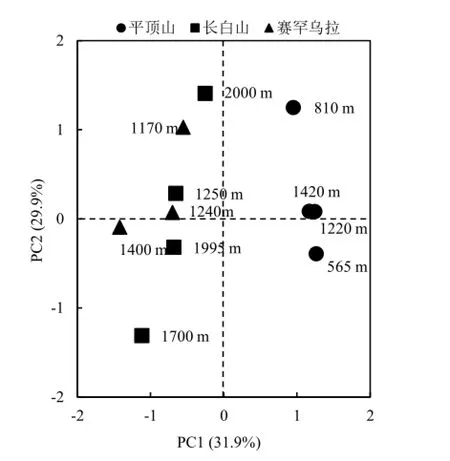
图4 森林土壤PLFAs主成分分析样品点分布Fig. 4 Principal component analysis (PCA) of the signature lipid biomarkers (PLFAs) used for examining the general soil microbial community composition in the three background forests
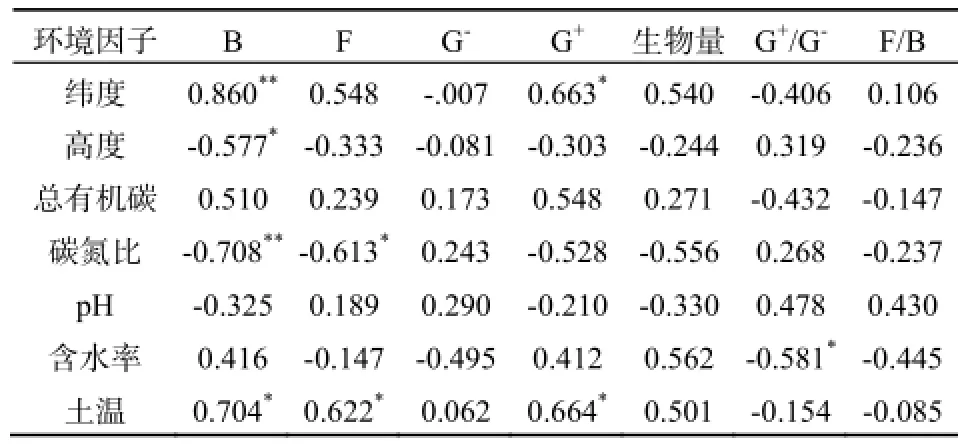
表3 土壤微生物群落与土壤理化性质的相关性Table 3 Pearson correlation between soil microbial communities and soil physicochemical properties
为进一步探讨土壤微生物多样性的变化,将表征PLFAs主要变化的主成分PC1、PC2与土壤理化性质进行了相关分析,结果表明:土壤微生物多样性主要受纬度差异控制(P<0.01),且与土壤碳氮比和含水率呈现相关关系(P<0.05)。(表4)
3 讨论
大量研究表明,植被类型,土壤类型及土壤管理措施是导致微生物群落变化的三大主要因素(王光华, 金剑, 徐美娜 and 刘晓冰, 2008)。本研究所选土壤主要来自远离人类活动的原始森林,人为干预较少,因此,微生物群落变化主要体现在植被类型和土壤自身理化性质的差异上。
植被类型对微生物群落影响的研究,目前大多集中在植物群落多样性、不同植物根际、或同一植物不同根区对根际土壤微生物群落的影响(Arab等, 2001; Kaiser等, 2001; Seldin, Rosado等, 1998; Smalla等, 2001; Zak, Holmes等, 2003)。本研究结果表明,不同林型的土壤细菌PLFAs含量均显著高于真菌PLFAs含量,说明细菌群落在中国北方森林生态系统中占主要地位。赛罕乌拉土壤中微生物的生物量显著高于平顶山和长白山,而微生物群落多样性却低于平顶山和长白山,这可能与赛罕乌拉低海拔地区大量人工林产生的干扰有关(王卫霞等, 2014)。植被类型的差异可反映在纬度差异上,本研究中只有细菌群落含量与纬度表现出了高度相关性,一定程度上表明采用指示单一种类微生物群落的PLFAs来表征植被类型的变化,可能比用表征多种微生物群落的PLFAs更灵敏。与此类似,之前就有研究发现,特定微生物群落结构的变化可以表征桉树植被种类变化(Cao等, 2010)。另外,也有研究发现,在土壤微生物总量变化不明显的情况下,真菌和细菌群落的变化却可以在一定程度上体现出土壤基质的变化(Bååth等, 1995; Pennanen等, 1999)。而在本研究中,PLFAs主成分与纬度存在明显的相关性,这表明背景森林土壤因纬度差异导致了植被类型的变化,进而引起微生物群落多样性的差异。从这个意义上讲,纬度的差异很可能是导致微生物群落差异的主要因素。
土壤类型是决定土壤微生物群落结构的另一主要因素。相关研究发现,土壤理化性质相似,土壤微生物群落结构也趋于相似(Chiarini等, 1998; Gelsomino等, 1999; Sessitsch等, 2001)。本研究中所涉及的土壤类型主要为暗棕壤、白浆土、黑土和山地灰黑土。在理化性质上,相比棕壤来说,淋溶层黑土的有机质含量更高,生物量也相对趋于丰富。此外,本研究表明,我国北方森林生态系统中,土壤细菌含量、真菌含量和PLFAs主成分与土壤的碳氮比均存在显著相关性。说明暗棕壤和黑土的碳氮比是控制微生物结构变化和土壤微生物多样的主要因素。这与Högberg等在温带森林系统(Högberg和 Myrold, 2007)和长白山森林土壤的研究(Zhang等, 2013)中得出的结论相似。此外,也有研究指出,除土壤碳氮比以外,土壤pH也是影响微生物多样性的主要因素(Zhang等, 2013)。然而,本研究并未发现土壤pH对微生物群落及微生物多样性有明显影响,这可能与本研究中所涉及的主要土壤类型(暗棕壤、黑土)的pH范围比较相近有关(均为酸性,pH=3.8~4.8)。而代表真菌群落的 PLFA(C18:1ω9)含量变化与土壤碳氮比的相关性比代表真菌群落整体含量的 PLFAs与暗棕壤和黑土的碳氮比的相关性更为显著。这说明在表征土壤类型的变化上,采用代表单一真菌的PLFA比采用代表多种真菌群落的PLFAs更灵敏。
4 结论
(1)平顶山、长白山和赛罕乌拉森林土壤总有机碳(TOC)、碳氮比(C/N)和含水率差异较大,土壤pH值差异较小(均为酸性)。

图5 森林土壤PLFAs对主成分贡献分布Fig. 5 PCA loading plot of the first two principal components of the PLFA data set showing the individual PLFAs
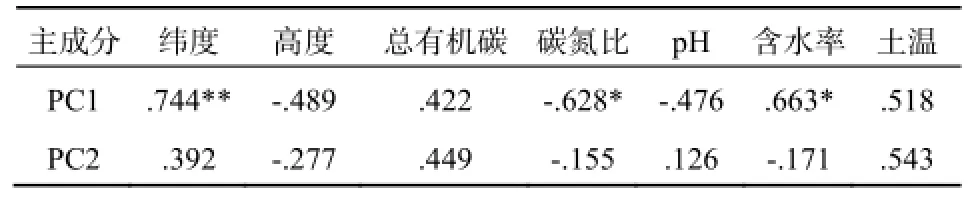
表4 土壤微生物PLFAs与土壤理化性质的相关性Table 4 Pearson correlation between soil microbial PLFAs and soil physicochemical properties
(2)赛罕乌拉土壤中微生物的生物量(PLFAs总量)最高;而平顶山土壤中的细菌含量、真菌含量和革兰氏阳性菌显著高于其余两座山。革兰氏阳性菌与阴性菌的比值在平顶山土壤中最大(4.19),明显高于长白山(3.14)和赛罕乌拉(2.39);而真菌与细菌比值却与之相反(平顶山0.55、长白山0.69、赛罕乌拉1.05)。
(3)土壤细菌的含量与纬度和土壤C/N呈显著负相关(P < 0.01)。C18:1ω9作为生物标记物比真菌整体更能体现土壤碳氮比变化,灵敏度更高。
(4)土壤微生物多样性主要受纬度所导致植被类型差异的影响(P < 0.01),且与土壤碳氮比呈负相关、土壤含水率呈正相关(P < 0.05)。
Å FROSTEGÅRD, E BÅÅTH. 1996. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils, 22(1-2): 59-65.
A GELSOMINO, A C KEIJZER-WOLTERS, G CACCO, et al. 1999. Assessment of bacterial community structure in soil by polymerase chain reaction and denaturing gradient gel electrophoresis[J]. Journal of Microbiological Methods, 38(1): 1-15.
A SESSITSCH, A WEILHARTER, M H GERZABEK, et al. 2001. Microbial population structures in soil particle size fractions of a long-term fertilizer field experiment[J]. Applied and Environmental Microbiology, 67(9): 4215-4224.
B LALOR, W COOKSON, D MURPHY. 2007. Comparison of two methods that assess soil community level physiological profiles in a forest ecosystem[J]. Soil Biology and Biochemistry, 39(2): 454-462.
B ZHANG, C LIANG, H HE, et al. 2013. Variations in soil microbial communities and residues along an altitude gradient on the northern slope of Changbai Mountain, China[J]. PloS one, 8(6): e66184.
D A LAVERIE. 1998. Motivations for ongoing participation in a fitness activity[J]. Leisure Sciences, 20(4): 277-302.
D L BALKWILL, F R LEACH, J T WILSON, et al. 1988. Equivalence of microbial biomass measures based on membrane lipid and cell wall components, adenosine triphosphate, and direct counts in subsurface aquifer sediments[J]. Microbial Ecology, 16(1): 73-84.
D R Zak, W E Holmes, D C White, et al. 2003. Plant diversity, soil microbial communities, and ecosystem function: are there any links?[J]. Ecology, 84(8): 2042-2050.
D WHITE, W DAVIS, J NICKELS, et al. 1979. Determination of the sedimentary microbial biomass by extractible lipid phosphate[J]. Oecologia, 40(1): 51-62.
E A PAUL. 2006. Soil microbiology, ecology and biochemistry[M]. Academic press.
E BÅÅTH, Å FROSTEGÅRD, T PENNANEN, et al. 1995. Microbial community structure and pH response in relation to soil organic matter quality in wood-ash fertilized, clear-cut or burned coniferous forest soils[J]. Soil Biology and Biochemistry, 27(2): 229-240.
F C DOBBS. 1988. Callianassa trilobata (Crustacea: Thalassinidea) influences abundance of meiofauna and biomass, composition, and physiologic state of microbial communities within its burrow[J]. Mar Ecol Prog Ser, 45: 69-79.
H ARAB, V VLICH, R SIKORA. 2001. The use of phospholipids fatty acids (PLFA) in the determination of rhizosphere specific microbial communities of two wheat cultivars[J]. Plant and Soil, 228: 291-297.
H LECHEVALIER, M LECHEVALIER. 1988. Chemotaxonomic use of lipids—an overview[J]. Microbial lipids, 1:869-902.
I DJUKIC, F ZEHETNER, A MENTLER, et al. 2010. Microbial community composition and activity in different Alpine vegetation zones[J]. Soil Biology and Biochemistry, 42(2): 155-161.
K SMALLA, G WIELAND, A BUCHNER, et al. 2001. Bulk and rhizosphere soil bacterial communities studied by denaturing gradient gel electrophoresis: plant-dependent enrichment and seasonal shifts revealed[J]. Applied and environmental microbiology, 67(10): 4742-4751.
L CHIARINI, A BEVIVINO, C DALMASTRI, et al. 1998. Influence of plant development, cultivar and soil type on microbial colonization of maize roots[J]. Applied Soil Ecology, 8(1): 11-18.
L SELDIN, A S ROSADO, D W DA CRUZ, et al. 1998. Comparison of Paenibacillus azotofixans strains isolated from rhizoplane, rhizosphere, and non-root-associated soil from maize planted in two different Brazilian soils[J]. Applied and environmental microbiology, 64(10): 3860-3868.
M ALEXANDER. 1977. Introduction to soil microbiology[M]. John Wiley & Sons.
M N HÖGBERG, P HÖGBERG, D D MYROLD. 2007. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three?[J]. Oecologia, 150(4): 590-601.
N FIERER, J P SCHIMEL. 2003. A proposed mechanism for the pulse in carbon dioxide production commonly observed following the rapid rewetting of a dry soil[J]. Soil Science Society of America Journal, 67(3): 798-805.
O KAISER, A PÜHLER, W SELBITSCHKA. 2001. Phylogenetic analysis of microbial diversity in the rhizoplane of oilseed rape (Brassica napus cv. Westar) employing cultivation-dependent and cultivation-independent approaches[J]. Microbial ecology, 42(2): 136-149.
R J CASE, Y BOUCHER, I DAHLLÖF, et al. 2007. Use of 16S rRNA and rpoB genes as molecular markers for microbial ecology studies[J]. Applied and environmental microbiology, 73(1): 278-288.
S J JOSEPH, P HUGENHOLTZ, P SANGWAN, et al. 2003. Laboratory cultivation of widespread and previously uncultured soil bacteria[J]. Applied and Environmental Microbiology, 69(12): 7210-7215.
T PENNANEN, J LISKI, E BÅÅTH, et al. 1999. Structure of the microbial communities in coniferous forest soils in relation to site fertility and stand development stage[J]. Microbial Ecology, 38(2): 168-179.
V TORSVIK, L ØVREÅS,T F THINGSTAD. 2002. Prokaryotic diversity--magnitude, dynamics, and controlling factors[J]. Science, 296(5570): 1064-1066.
W BORKEN, A MUHS, F BEESE. 2002. Changes in microbial and soil properties following compost treatment of degraded temperate forest soils[J]. Soil Biology and biochemistry, 34(3): 403-412.
Y CAO, S FU, X ZOU, et al. 2010. Soil microbial community composition under Eucalyptus plantations of different age in subtropical China[J]. European Journal of Soil Biology, 46(2): 128-135.
陈庆强, 沈承德, 孙彦敏, 等. 2005. 鼎湖山土壤有机质深度分布的剖面演化机制[J]. 土壤学报, 42(1): 1-8.
刘开朗, 王加启, 卜登攀, 等. 2010. 环境微生物群落结构与功能多样性研究方法[J]. 生态学报, 30(4): 1074-1080.
刘微, 王树涛, 陈英旭, 等. 2011. 转Bt基因水稻根际土壤微生物多样性的磷脂脂肪酸(PLFAs)表征[J]. 应用生态学报, 22(3): 727-733.
孟庆光. 2011. 小兴安岭南坡地形— —土壤— —植被的空间分布关系[J]. 林业勘查设计, 1: 029.
王光华, 金剑, 徐美娜, 等. 2006. 植物, 土壤及土壤管理对土壤微生物群落结构的影响[J]. 生态学杂志, 25(5): 550-556.
王卫霞, 罗达, 史作民, 等. 2014. 岷江干旱河谷造林对土壤微生物群落结构的影响[J]. 生态学报, 34(4): 890-898.
吴才武, 赵兰坡. 2011. 土壤微生物多样性的研究方法[J]. 中国农学通报, 27(11): 231-235.
吴昊. 2012. 长白山区不同森林群落中土壤微生物群落组成及其与土壤养分的关系[D]. 东北师范大学.
吴则焰, 林文雄, 陈志芳, 等. 2013. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化[J]. 植物生态学报, 37(5): 397-406.
张书理, 雍伟义, 杨永昕, 等. 2008. 赛罕乌拉自然保护区植被分类研究[J]. 内蒙古大学学报: 自然科学版, 39(1): 74-79.
The Microbial Community of Three Mountains Pingding, Changbai and Saihanwula Based on the Analysis of Phospholipid Fatty Acids(PLFAs)
JIANG Yishan1,3, XIAO Jing2, LUO Chunling1*, LI Jun1, ZHANG Gan1
1. State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China;
2. Dongying Agricultural Bureau, Dongying, Shandong Province, 257091, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China
Soil microbes is the key and motivation of nutrient and energy cycling in terrestrial ecosystem. It is hard to evaluate the community structure and ecological functions of soil ecosystem for its abundant diversity. Phospholipid fatty acid (PLFA), a relatively stable and heritable biomarker of live microorganism, which can be used to indicate the exist and situation of specific organism or population, has been widely used in elucidating the dynamic change of microbial community in soil. The present study evaluated soil microbial biomass, Bacteria, Fungus, Gram+Bacteria and Gram-Bacteria composition in typical forest soils of Chinese northeast area (including Pingding Mountain, Changbai Mountain and Saihanwula Mountain) with the analysis of phospholipid fatty acid (PLFA). Furthermore, we investigated how the forest soil microbial absolute content and distribution change with various environmental factors. The major conclusions are as follows: (1)A total of 12 soil samples of different vegetation types from Pingding Mountain, Changbai Mountain and Saihanwula Mountain background forests were analyzed for PLFAs, C/N, TOC, and pH, following the field test of their environmental factors such as soil temperature and moisture. The results showed that the total organic carbon (TOC) ranged from 3.15%~16.3%, the carbon to nitrogen ratio (C/N) ranged from 12.1~18.4, the pH value ranged from 3.5~4.8, the moisture content ranged from 13.3%~74.5% and the soil temperature while sampling was 8.0~18.8 °C, respectively. (2)The total PLFAs content represents the biomass of soil microbes, which was in the range of 27.39~237.63 µg·g-1. Soil microbial biomass in Saihanwula Moutain was highest among the three mountains, while the contents of bacteria, fungi and G+-bacteria in Pingding Moutain were significantly higher than the other two mountains. The ratio of G+-bacteria to G--bacteria (G+/G-) in Pingding Mountain (4.19) was also higher than Changbai Mountain (3.14) and Sahanwula Mountain (2.39). On the contrary, the ratio of fungi to bacteria (F/B) was totally different from G+/G-with Saihanwula Moutain (1.05) being the highest, followed by Changbai Mountain (0.69) and Pingding Mountain (0.55). (3)We examined the correlation between different microbial communities and environmental factors using SPSS software. The results showed that the content of bacteria in forest soil significantly correlated with latitude and C/N (P<0.01); fungi were negatively correlated with C/N (P<0.05) generally. Further correlated analysis between two main PLFAs representing fungi (C18:1ω9、C18:2ω6,9) with C/N demonstrated that C18:1ω9 was significantly correlated with C/N (P<0.01), whereas C18:2ω6,9 was not significantly correlated with C/N. Therefore, the single PLFA as biomarker is probably more sensitive to the change of C/N. (4)The principal components analysis indicated that the soil biodiversity was determined by the vegetation types (P<0.01), and it was influenced by soil C/N and soil moisture content as well (P<0.05).
phospholipid fatty acid; forest soil; microbial community structure; Pingding Mountain; Changbai Mountain; Sahanwula Mountain
S714.3
:A
:1674-5906(2014)08-1272-08
姜懿珊,肖静,罗春玲,李军,张干. 平顶山、长白山、赛罕乌拉森林土壤微生物群落结构分析[J]. 生态环境学报, 2014, 23(8): 1272-1279.
JIANG Yishan, XIAO Jing, LUO Chunling, LI Jun, ZHANG Gan. The Microbial Community of Three Mountains Pingding, Changbai and Saihanwula Based on the Analysis of Phospholipid Fatty Acids(PLFAs) [J]. Ecology and Environmental Sciences, 2014, 23(8): 1272-1279.
国家杰出青年基金项目(Y212041B01)
姜懿珊(1990年生),女,硕士研究生,从事森林土壤微生物生态学研究。E-mail:Jiangyishan_12345@yahoo.com
*通讯作者:罗春玲,女,研究员,主要从事植物修复及土壤微生物生态学研究。E-mail:clluo@gig.ac.cn
2014-04-25

