沣河水系脱氮微生物群落结构研究
孙寓姣,赵 轩,王 蕾,卢思丹,丁爱中
北京师范大学水科学研究院,北京 100875
沣河水系脱氮微生物群落结构研究
孙寓姣,赵 轩,王 蕾,卢思丹,丁爱中*
北京师范大学水科学研究院,北京 100875
河流水体氮素的超负荷不仅破坏了水体生态环境,也严重威胁着人类的生存和发展。水体中有机氮、无机氮(氨氮、亚硝氮、硝氮)和分子氮之间的转化(氮循环)有赖于水体中大量的氮循环微生物(固氮细菌、硝化细菌和反硝化细菌),然而这些氮循环微生物的生长繁殖也受到包括氮素的形态和浓度在内的多种环境因子的影响,这些因素也通过影响氮循环微生物的生长繁殖进而使得水体中氮素的转化速率发生变化,对水体氮污染的防治有不可忽视的作用。本研究通过在沣河设置不同的研究断面,采集水体样品,进行水质分析,并通过现代分子生物学技术(PCR-DGGE)方法对研究断面水体中氮循环微生物(固氮细菌、硝化细菌和反硝化细菌)的群落结构进行分析。再通过统计学软件对所得分子生物学信息与水质环境因子的相关性进行统计学分析,发现沣河水体中氮循环微生物群落结构受到多种环境因子共同影响,且在枯水期和丰水期表现出不同的特征。在丰水期沣河水体中,硝化细菌群落在中游表现出较高的多样性和丰富性,这与沣河中上游农业COD(化学需氧量)、BOD(生化需氧量)氨氮及有机氮污染物排放量较大,沣河水体DO(溶解氧)高有关。水体中的氨氮、亚硝氮、温度的增加是促进水体中硝化细菌的均匀性和丰富度的增高的主要因子,而pH值的升高,使得水体中硝化细菌的均匀性和丰富度降低。反硝化微生物在中游和下游的多样性和丰富度较高,与有机物及硝酸盐含量相关。水体中的BOD、COD、TP(总磷)、硝氮的增加是促进水体中反硝化细菌的均匀性和丰富度的增高主要相关因子,而DO的增多则会对部分反硝化细菌产生不利影响,使得水体中反硝化细菌的均匀性和丰富度降低。本研究结果为沣河以及其他河流的污染控制以及基于微生物的生态修复提供了科学研究和工程实践依据。
沣河;脱氮细菌;DGGE;环境因子
氮素是生物必须营养元素之一,也是维持水体生态平衡的重要物质。然而近年来由于人类活动,如化肥的使用、生活垃圾的排放、化石燃料的燃烧等活动的日益加剧,陆地和水生态系统中氮污染物不断增多。使得水环境中氮污染物含量增加,水体氮污染已成为目前人们最为关注的环境问题之一。我国七大水系整体轻度污染,氨氮(NH4+-N)为主要污染指标之一;河流氮循环对与氮的迁移转化和赋存形态及含量都有重要作用,是水体氮污染研究的重要方向之一。自然界中氮素存在3种形态:有机态氮、无机态氮(NH4+-N、NO3--N、NO2--N)和N2,各形态氮之间转化的过程即为氮循环。河流水体中氮素天然来源极少,主要来源于点源、面源和内源污染,河流中氮素的循环代谢主要是通过微生物作用实现。硝化细菌以氨氮为底物,氨氮浓度较低时难以满足硝化细菌的需求,但浓度过高时又可能会抑制硝化细菌,所以水体氨氮浓度对硝化细菌群落结构影响较大。Lydmark等(2007)利用PCR-DGGE和FISH技术对中试污水处理系统中环境条件下硝化种群进行了初步研究,结果表明氨氮是各种环境因素中最重要的因素,氨氮的浓度与硝化微生物细胞有着紧密的联系。DO(溶解氧)是影响AOB(氨氧化细菌)群落结构的重要因素,张丹等(2004)利用PCR-DGGE和FISH技术对生物脱氮系统中的AOB群落结构进行研究时发现,AOB种群受DO的影响较大。硝化细菌的群落结构与生物地球化学环境因素有关,硝酸盐和氧是影响反硝化细菌群落结构的重要因素(Liu等,2003)。Maribeb等(2005)对东南太平洋DO最低区域水体的nirS基因进行研究,发现不同采样点反硝化细菌群落结构明显不同,O2、NO2-、NO3-浓度和取样样深度等环境因素对水体反硝化细菌群落结构有重要影响。Falk等(2006)对波罗的海沿岸水体反硝化细菌群落结构进行了研究,分析发现随着生物地球化学因素的梯度变化,水体反硝化细菌的群落组成也有明显变化。
氮循环微生物是影响河流水体氮迁移转化的重要因素。现有的研究多只针对水体氮素组成及含量,或氮转化细菌群落结构,而由于河流水体微生物与环境因子相互影响,关系密切,对氮迁移转化有重要影响,对河流氮循环进行研究时必须将这些因素作为整体考虑。传统微生物研究方法(显微镜观察、微生物计数、分离纯化等)都是以分离培养为基础,利用微生物生理生化特性、遗传及生态特性等进行研究,且微生物鉴定主要是利用选择性培养基进行选择、纯化、分离、根据形态、温度、生物量、酶活性等指标进行种群鉴定。然而由于微生物外在的生长特征并不明显,且其在自然界中的生长环境也比较复杂,实验室中培养条件与其自然生长条件差异较大,难以真实模拟,所以实验室中只能培养得到环境中极少部分(0.001%~15%)的微生物,且培养法所得结果及微生物情况也难以全面反应样品微生物信息的真实情况,不能对微生物进行多样性分析和统计(邢德峰等,2006)。基于培养的传统微生物研究方法,只可作为辅助方法,必须与现代分子生物学技术相结合,才能客观、全面反映环境中的微生物信息。
沣河发源于秦岭以北,主要靠雨水和冰雪融水补给。沣河上游水质满足地表水І-П类标准。入河点源、非点源污染物的排放及河流自净能力等使得沣河水质变化复杂,近20年来,沣河上游水质污染总体略有加重,中下游水质明显改善, 但氮污染问题依然严峻。本研究通过在沣河(包括太平峪、高冠峪、潏河)设置24个研究断面,采集水体样品,进行水质分析,并通过现代分子生物学技术(PCR-DGGE)方法对研究断面水体中氮循环微生物(固氮细菌、硝化细菌和反硝化细菌)的群落结构进行分析。通过统计学软件对所得分子生物学信息进行统计分析,并对环境因子与氮循环微生物信息之间的相关性进行统计学分析。本研究结果为沣河以及其他河流的污染控制以及基于微生物的生态修复提供了科学研究和工程实践依据。
1 试验材料与方法
1.1 研究断面的设置
样品采集尽量考虑在河流每个分支设置采样点,于丰水期在沣河干流和部分支流设置24个采样断面位置如图1所示。
1.2 水样采集
用有机玻璃采样器采集水深0.5 m左右处水样。用于基因组DNA提取的水样,注入洗净灭菌后的玻璃瓶中低温带回。其它水样用预先洗净的聚乙烯采样瓶采集,低温带回实验室检测。
1.3 水质监测方法
在保存时限内,送至西安市环境监测站,对水样进行水质理化指标TN(总氮)、NH4+-N(氨氮)、NO3--N(硝氮)、NO2--N(亚硝氮)、COD(化学需氧量)、BOD(生化需氧量)、TP(总磷)等分析,其余如T(水温)、pH、DO(溶解氧)、ORP(氧化还原电位)、SpC(电导率)等在调研采样时用相关仪器现场监测获得。
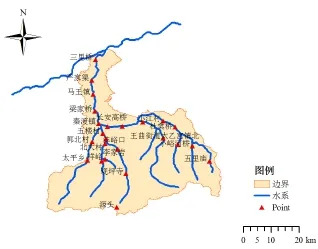
图1 采样断面位置Fig. 1 The sampling section positions
1.4 总DNA提取及脱氮基因PCR(聚合酶链式反应)扩增
水样于24 h内经0.22 μm醋酸纤维素滤膜过滤,浓缩生物样品。滤膜放置-20 °C保存。使用Omega Water DNA Kit(快速水质DNA提取试剂盒)按其操作说明提取水体微生物的总DNA。1.2%的琼脂糖凝胶电泳检测结果。
1.4.1 硝化细菌的特异性扩增
选择氨氧化细菌16S rDNA的V3高变区的特异性引物CTO189F、GC-CTO189F和CTO654R进行嵌套式PCR扩增(OvreasL等,1998;Kowalchuk等,1997)。第一轮引物CTO189F(5’-GGA GRA AAG CAGGGGATC G-3’)和CTO654R(5’-CTA GCY TTG TAG TTT CAAACG C-3’)。以1μL DNA样品为模板,PCR扩增体系含有:2×Mix Maste(r不含染料)12.5 uL, 20 mmol上下游引物各1μL,无菌水补齐至25 μL。采用PCR扩增程序为:94 ℃/5 min;94 ℃/1min,55 ℃/1min,72℃/2min,30个循环,72 ℃/10min。使用无菌水替代DNA模板作为阴性对照。PCR产物用1.2%琼脂糖电泳进行检测,用Omega PCR产物纯化试剂盒对产物进行切胶回收。
第二轮引物GC-CTO189F(5’-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGG CACGGGGGGCC GGAGRA AAG CAGGGGATC G-3’)和CTO654R。目标长度:约450 bp。以1 μL第一轮PCR产物为模板,PCR扩增体系含有:2×Mix Master(不含染料)12.5 uL,20 mmol上下游引物各1 μL,无菌水补齐至25 μL。采用PCR扩增程序为:94 ℃/5 min;94 ℃/0.5min,55 ℃/0.5min,72 ℃/1min,30个循环,72 ℃/7min。使用无菌水替代DNA模板作为阴性对照。
1.4.2 反硝化微生物的nirS扩增
通过对编码细胞色素亚硝酸盐还原酶(cd1-Nir)的nirS基因片段进行PCR扩增(Throback等,2004;方芳等,2010;樊景凤等,2011;宋亚娜等,2012)。引物:GC-nirS 3F(5’-GGC GGC GCG CCG CCC GCC CCG CCC CCG TCG CCC TTC CTB CAY GA CGG CGG C-3’)和nirS 6R(5’-CGT TGA ACT TRC CGG T-3’)。目标长度约520 bp。以1μL DNA样品为模板,PCR扩增体系含有:2×Mix Master(不含染料)12.5 uL,20 mM上下游引物各1 μL,无菌水补齐至25 μL。采用PCR扩增程序为:94 ℃/10 min;94 ℃/1min,57 ℃/1min,72 ℃/2min,30个循环,72 ℃/10min。
PCR产物均用1.0%琼脂糖凝胶电泳检测。然后用北京博迈德生物科技发展有限公司生产的PCR产物纯化回收试剂盒和PCR产物琼脂糖凝胶回收试剂盒对所得PCR产物进行纯化回收。
1.4.3 基因扩增片段变性梯度凝胶电泳(DGGE)
基因扩增片段通过DGGE分离来研究微生物多样性。聚丙烯酰胺的变性梯度范围为35%~65%,DNA扩增产物上样量约为200 ng,60 °C恒温,120V恒压条件下电泳8 h,电泳完毕后采用银染技术染色,白光成像(Umax PowerLook 2100XL)。随后使用Quantity One(凝胶成像分析系统)软件对DGGE图谱进行分析,分析各泳道条带数目及灰度。
氮循环微生物群落的多样性分析利用Shannon-Wiener多样性指数(SW)反映微生物群落结构的均匀性(董志新等,2012),计算式为:

式中:Pi为泳道中第i个条带灰度占其泳道所有条带灰度之和的比例;
n为所在泳道条带总数。
当所研究的群落中只有一个物种时,SW最小,为0;当所研究的群落中每个种都有一个成员时,SW最大,为SWmax。
基因的丰度(Species Number,SN)
SN=n
1.5 微生物群落结构与水质相关性分析
用Excel和Arc GIS对所得枯水期和丰水期沣河监测断面的水体中氮循环微生物多样性指数和水质相关指标进行分析、绘制分布图。通过统计学软件SPSS 20和生态统计学软件CANOCO对微生物群落结构与环境因子的相互关系进行分析。
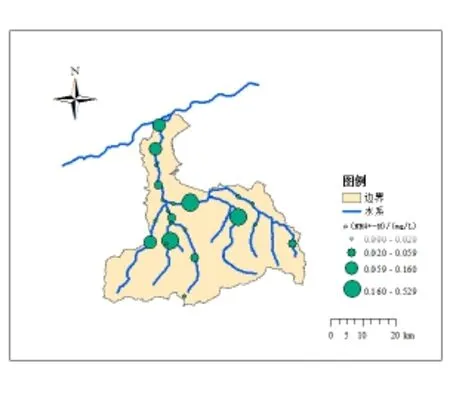
图2 丰水期沣河水体氨氮分布情况Fig.2 Ammonia nitrogen distribution in wet season of Fenghe River
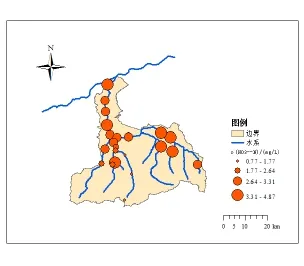
图3 丰水期沣河水体硝氮分布情况Fig. 3 Nitrate nitrogen distribution in wet season of Fenghe River
2 结果与讨论
2.1 丰水期沣河水质特征
由于环境气温较高,沣河水体除源头(10.9 ℃)外,其余监测断面水体温度均在15 ℃以上,甚至在三里桥超过20 ℃。
除马王村、五星蛟河大桥和王曲街道断面DO小于7.5 mg·L-1(II类水)外,沣河水体DO整体较高,为富氧状态。丰水期沣河水体氨氮分布情况如图2所示。丰水期沣河水体硝氮分布情况如图3所示。
从图2可以看出,丰水期沣河水体氨氮含量均可达到国家地表水II类水标准,与丰水期水量大,对污染物有稀释作用有关。且在所有研究断面中,祥峪断面河水氨氮质量浓度最高(0.53 mg·L-1)。
从图3可以分析出,沣河水体硝酸盐氮浓度整体没有明显变化,除沣河源头断面水体硝氮浓度为0.77 mg·L-1外,均大于1.0 mg·L-1,且在祥峪、杜樊桥、小江村和太乙宫街道断面水体硝氮浓度超过4.0 mg·L-1。
整体上看,沣河水体氮素污染主要集中于中下游,中游较为严重,与高榕等(2003)对沣河水质变化特征的相关研究结果一致。两次沣河调研也发现,沣河中游地区村庄密集,河岸边垃圾堆放,甚至向河中倾倒垃圾的现象比较严重;下游地区由于城区较多,城区污水、垃圾处理设施较为完善,向河中乱丢垃圾废弃物的现象也较少见,李英杰等(2011)也发现了此问题。可见,要改善沣河水质问题,除了加强修复技术研发及应用以外,更要提高当地群众的环保意识。
2.2 脱氮菌多样性指数变化
2.2.1 脱氮细菌SW多样性指数变化
在丰水期,水体硝化细菌SW指数由图4所示。硝化细菌基因16s特异区DGGE结果显示出上游的沣河源头、太平乡断面该指数相对较低,中游的王曲街道、北大村、五楼村、长安高桥、五星蛟河大桥、秦渡镇以及下游的梁家桥和马王村断面水体中SW多样性指数相对较高,在2.64~3.11之间。丰水期水体反硝化细菌nirS基因SW指数如图5所示。反硝化细菌功能基因上游的沣河源头、观坪寺、李家岩、太平乡、小峪河桥断面的nirS基因的SW多样性指数相对较低,在2.11~2.58之间。中游的王曲街道、小江村、滈河桥、秦渡镇和下游的马王村断面的水体nirS基因的SW多样性指数相对较高,在3.03~3.29之间;而整体上看,丰水期沣河水体氮循环微生物香浓-威纳多样性指数SW相对枯水期较高。在硝化细菌和反硝化细菌中,硝化细菌的SW多样性指数相对较低。
丰水期硝化细菌多样性指数(SW)从大到小的分布为:中游>下游>上游;反硝化细菌多样性指数(SW)从大到小的分布为:中游>下游>上游。
2.2.2 脱氮细菌SN丰度指数变化
在丰水期,水体硝化细菌丰度SN如图6所示。上游的沣河源头、观坪寺、沣峪口、太平乡的硝化细菌的丰度相对较低,在4~9之间,而中游的北大村的硝化细菌的丰度均处于较高水平。下游的梁家桥的硝化细菌的丰度相对较高,在19~25之间。丰水期,水体反硝化nirS基因丰度SN如图7所示。上游别的沣河源头、观坪寺、李家岩、太平乡nirS的丰度相对较低,在10~15之间。中游的王曲街道、小江村的nirS的丰度相对较高,在25~30之间;下游的马王村的nirS的丰度均处于较高水平。整体上看,丰水期水期沣河水体氮循环微生物硝化细菌和反硝化细菌中,硝化细菌的丰度SN相对较低。
硝化细菌多样性指数(SW)和丰度(SN)从大到小的分布为:中游>下游>上游;而反硝化细菌在丰水期SW和SN指数从大到小的分布为:中游>下游>上游。

图4 水体硝化细菌SW指数Fig. 4 SW index of nitrifying bacteria
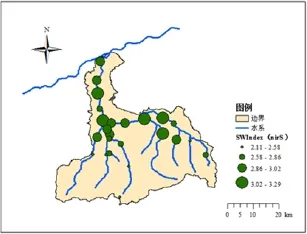
图5 丰水期水体反硝化细菌nirS基因SW指数Fig. 5 SW index of Denitrifying bacteria nirS gene in wet season
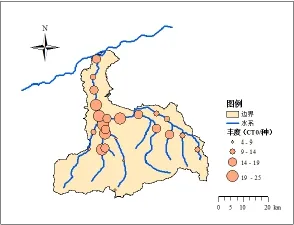
图6 丰水期水体硝化细菌丰度SNFig. 6 Nitrifying bacteria abundance of SN in wet season
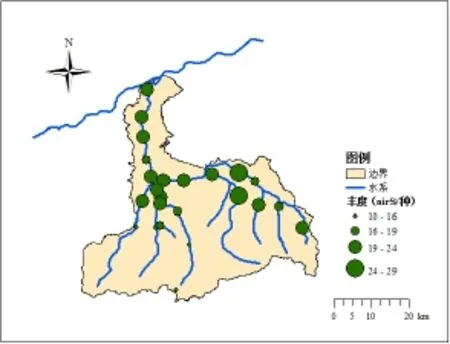
图7 丰水期水体反硝化细菌nirS基因丰度SNFig. 7 Denitrifying bacteria nirS gene abundance SN in wet season
2.3 沣河氮循环微生物与水质相关性分析
丰水期水体nirS基因丰度SN如图8所示。图8中,通过氮循环微生物群落多样性指数、丰度和环境因子之间的夹角表示其间的相关性。夹角越小,表明其相关性越大,若箭头同向,表示他们之间是正相关;若箭头反向,则表示他们之间是负相关;若夹角接近于直角,则表示他们之间的相关性较小。因此可以判断,若环境因子与氮循环微生物多样性、丰度箭头方向相同,则可以初步预测该氮循环微生物指数随相应环境因子指标的增加而增加,因此由图所示可以分析得到丰水期沣河氮循环微生物多样性指数、丰度与环境因子之间关系。
2.3.1 硝化细菌多样性指数、丰度与环境因子相关性分析
从图8中可以看出,硝化细菌香浓-威纳多样性指数(SW-CTO-f)、丰度指数(SN-CTO-f)与氨氮正相关性最大,与亚硝氮、T、也显示出了较大的正相关性。说明:
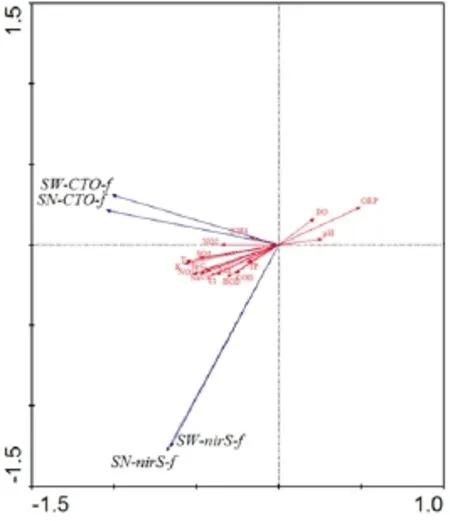
图8 丰水期水体nirS基因丰度SNFig. 8 NirS gene abundance SN in wet season
水体中氨氮作为硝化细菌生长繁殖的底物,对硝化细菌的群落结构影响最大(Otawa等,2006;Lydmark等,2007),但是在丰水期沣河氨氮浓度变化范围(<0.530 mg·L-1)内,氨氮的增加会提高硝化细菌的生存繁殖能力和多样性,有利于硝化细菌群落结构的稳定;硝化细菌香浓-威纳多样性指数(SW-CTO-f)、丰度指数(SN-CTO-f)与亚硝氮正相关性,说明丰水期沣河中的硝化细菌可能会利用亚硝氮,亚硝氮的增加也有利于提高硝化细菌的多样性和丰度;此外,硝化细菌香浓-威纳多样性指数(SW-CTO-f)、丰度指数(SN-CTO-f)还与pH呈现出一定的负相关性。说明丰水期沣河水体中pH的升高,水体中阴离子含量增加会对水体中的氨氮的氧化产生一定的抑制作用。
2.3.2 反硝化nirS基因多样性指数、丰度与环境因子相关性分析
从图8中可以看出,反硝化nirS基因香浓-威纳多样性指数(SW-nirS-f)、丰度指数(SN-nirS-f)与BOD、COD、TP、硝氮呈现了一定的正相关性。说明BOD、COD作为碳源,对反硝化细菌的生长繁殖具有重要作用;硝氮是反硝化细菌作用的主要基质,其含量变化是影响反硝化细菌群落的主要因素之一。此外,反硝化细菌香浓-威纳多样性指数(SW-nirS-f)、丰度指数(SN-nirS-f)还与DO呈现出一定的负相关性。说明沣河水体中DO升高也会对反硝化细菌有抑制作用(Maribeb等,2005)。
3 结论
丰水期沣河水硝酸盐氮浓度较高,污染较为严重,氨氮污染主要集中在中游。水体中脱氮微生物的多样性指数、丰度受多种环境因子共同影响,群落在中游表现出较高的多样性和丰富性。
水体中硝化细菌的均匀性和丰富度主要与水环境因子中氨氮、亚硝氮、T、成呈相关,主要与水体pH成负相关。
反硝化细菌多样性指数、丰度主要与水环境因子中BOD、COD、TP、硝氮呈正相关,而主要与DO呈负相关。
FALK S, HANNIG M, BRAKER G, et al. 2006. NirS-containing denitrifier communities in the water column and sediment of the Baltic Sea[J]. Biogeosciences, 3: 697-727.
KOWALCHUK G A, BODELIER P, HEILIG G, et al. 1998. Community analysisofammonia- -oxidising baeteria, inrelation to oxygen availability in soils and root-oxygenated sediments, using PCR, DGGE and oligonucleotideProbehybridisation[J]. FEMS Microbiology Ecology, 27(4): 339-350.
LIU X D, SONIA M T, GINA H, et al. 2003. Molecular diversity of denitrifying genes in continental margin sediments within theoxygen-deficient zone off the pacific coast of Mexico[J]. Applied and Environmental Microbiology, 69(6): 3549-3560.
LYDMARK P, ALMSTRAND R, SAMUELSSON K, et al. 2007. Effects of environmental conditions on the nitrifying population dynamics in a pilot wastewater treatment plant[J]. Environmental Microbiology, 9(9): 2220-2233.
MARIBEB C G, GESCHE B, LAURA F, et al. 2005. Communities of nirS-type denitrifiers in the water column of the oxygen minimum zone in the eastern South Pacific[J]. Environmental Microbiology, 7(9): 1298-1306.
OTAWA K, ASANO R, OHBA Y, et al. 2006. Molecular analysis of ammonia-oxidizing bacteria community in intermittent aeration sequencing batch reactors used for animal wastewater treatment [J]. Environmental Microbiology, 8(11): 1985-1996.
OVREASL, FORNEYL, DAAEFL, et al. 1997. Distributionofbacterioplanktonin meromictic Lake Saelenvannet, as determined by denaturing gradient gel electrophoresis of PCR-amplified gene fragments coding for 16S rRNA[J]. Applied and Environmental Microbiology, 63(9): 3367-3373.
THROBÄCK IN, ENWALL K, JARVIS A, et al. 2004. Reassessing PCR primers targetingnirS ,nirK and nosZgenesfor community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 49: 401-417.
ZHANG D, ZHANG D M, LIU Y P, et al. 2004. Community analysis of ammonia oxidizer in the oxygen-limited nitritation stage of OLAND system by DGGE of PCR amplified 16S rDNA fragments and FISH[J]. Journal of Environmental Sciences, 16(5): 838-842.
董志新, 孙波, 殷士学, 等. 2012. 气候条件和作物对黑土和潮土固氮微生物群落多样性的影响[J]. 土壤学报, 49(1): 130-138.
樊景凤, 陈佳莹, 陈立广, 等. 2011. 辽河口沉积物反硝化细菌数量及多样性的研究[J]. 海洋学报, 33(3): 94-102.
方芳, 陈少华. 2010. 功能基因在反硝化菌群生态学研究中的应用[J].生态学杂志, 29(9): 1836-1845.
高榕, 高兵, 洪晖. 2003. 西安市沣河流域重点污染物——有机污染物的特征分析[J]. 陕西环境, 10(6): 49-51.
李英杰, 程三友, 王莉, 等. 2011. 西安沣河1986-2009年水质时空变化研究[J]. 中国农村水利水电, 8: 1-5.
宋亚娜, 林智敏, 林艳. 2012. 氮肥对稻田土壤反硝化细菌群落结构和丰度的影响[J]. 中国生态农业学报, 20(1): 7-12.
邢德峰, 任南琪, 宋佳秀, 等. 2006. 不同16S rDNA靶序列对DGGE分析活性污泥群落的影响[J]. 环境科学, 27(7): 1424-1428.
Study on the microorganisms of nitrogen cycle in Fenghe river
SUN Yujiao, ZHAO Xuan, WANG Lei, LU Sidan, DING Aizhong
College of Water Science,Beijing Normal University, Beijing 100875, China
Nitrogen (N) is among the paramount interests to biogeochemistry and life on earth. But pollution of N in river water will make a threat to the ecological environment and human life.The transformation among organic nitrogen, inorganic nitrogen (ammonia, nitrite, nitrate) and molecular nitrogen(N2) in river water, called nitrogen cycling, depends on the nitrogen cycle microorganisms (nitrogen-fixing bacteria, nitrifying bacteria and denitrifying bacteria). And these microorganisms and their activity of the nitrogen cycling are affected by a variety of environmental factors including the form and concentration of nitrogen, these factors affect the growth of microorganisms thus change the rate of transformation of nitrogen in water, which make a significant contribution to prevention of nitrogen pollution and removal of nitrogen pollutants. And thus a research of nitrogen cycle microbial and the related environmental factors is of great importance to removal of nitrogen pollutants in river water.Based on PCR-DGGE technology, water sampling points along the Feng River were set to study on the water quality and community of microorganisms related with nitrogen cycle. Then the related statistical softwares were used to analyze the relationship among the water quality and community of microorganisms related.In this study, during wet season, nitrifying bacteria community structure in the middle reaches is relatively rich in water, resulted from the agricultural COD, BOD, ammonia nitrogen, organic nitrogen emissions and high river water DO level. The increasing of BOD, ammonia nitrogen, nitrate nitrogen, T, TP promoted to the uniformity, richness of nitrifying bacteria in water, while the rising of pH reduced the uniformity and the abundance of nitrifying bacteria in water. Denitrifying bacteria community structure in the midstream and downstream is relatively rich in water, associated with organic matter and nitrate content. The increasing of BOD ,COD, TP, nitrate nitrogen was the main related factor of the uniformity, richness of denitrifying bacteria in water. While the rising of DO was harmful to part of denitrifying bacteria, and reduced the uniformity, richness of denitrifying bacteria. The results of this study provided the basis for pollution control and ecological restoration based on microbial technology in Fenghe River and other rivers.
Fenghe River; denitrification bacteria; DGGE; environment factors
X172
A
1674-5906(2014)09-1451-06
孙寓姣,赵轩,王蕾,卢思丹,丁爱中. 沣河水系脱氮微生物群落结构研究[J]. 生态环境学报, 2014, 23(9): 1451-1456.
SUN Yujiao, ZHAO Xuan, WANG Lei, LU Sidan, DING Aizhong. Study on the Microorganisms of Nitrogen Cycle in Fenghe River [J]. Ecology and Environmental Sciences, 2014, 23(9): 1451-1456.
国家自然科学基金项目(51178048,51378064);北京师范大学自主基金项目(2014KJJCB22)
孙寓姣(1975年生),女,副教授,主要研究方向为环境生物技术,分子微生态学。E-mail:sunyujiao@bnu.edu.cn *通信作者:E-mail:sun201405@163.com
2014-09-11

