苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响
赵欢,赵新达,岳宗豪,周一兵
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连 116023)
苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响
赵欢,赵新达,岳宗豪,周一兵
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连 116023)
在实验室条件下,利用诱导试验分析了不同浓度苯并(a)芘[B(a)P]对双齿围沙蚕Perinereis aibuhitensis(体质量为1.5 g±0.5 g)细胞色素P450基因表达和肌肉组织抗氧化酶活性的影响。结果表明:双齿围沙蚕细胞色素P450基因表达与B(a)P诱导浓度和诱导时间呈正相关,随着诱导浓度的增加和暴露时间的延长,表达量逐步上调;超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)和谷胱甘肽过氧化物酶 (GPx)活性均随B(a)P诱导时间的延长而逐步升高,其中SOD酶活性随B(a)P浓度的增加出现抑制,CAT和GPx酶活性则与B(a)P浓度呈正相关。
双齿围沙蚕;苯并(a)芘;细胞色素P450;抗氧化酶
多环芳烃 (PAHs)是一类由两个或两个以上芳香环以线状、角状或簇状排列构成的碳氢化合物,是最早被发现和研究的致癌类化合物之一[1]。近年来,随着社会经济的高速发展,废物焚化以及工业废气废水和生活污水的任意排放等产生了大量的PAHs污染物,它们通过降水和径流进入沿海水域,造成海洋PAHs污染[2]。已有调查表明,中国主要海域都存在不同程度的PAHs污染[3-4]。PAHs对海洋环境的影响已成为海洋环境保护的重要问题,PAHs也成为海洋环境中优先控制和必须检测的污染物之一。
生物体通过体内解毒酶活化代谢异生化学物质是机体主要的适应机制之一。已有研究表明,PAHs进入生物体后会被CYP450依赖的混合功能氧化酶等氧化代谢,形成亲水性中间产物,并产生大量活性氧物质。这些中间代谢物会与以谷胱甘肽硫转移酶为代表的内源性分子结合转化为低毒代谢产物排出体外,而形成的活性氧物质则会被包括超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GPx)等在内的抗氧化防御酶所清除[5]。Wang 等[6]研究表明,褐菖鮋Sebatiscusmarmoratus的CYP1A蛋白含量,以及SOD和GST酶活性均随着苯并(a)芘[B(a)P]暴露浓度的增加而增加;Holtha等[7]研究发现,斑马鱼Danio rerio的CYP1A基因表达可被 PAHs显著诱导;任加云等[8]研究发现,在PAHs胁迫下,栉孔扇贝Chlamys farreri的SOD、CAT、GPx酶活性呈现一定的时间剂量效应。PAHs与机体解毒代谢酶之间的剂量效应关系已在鱼类、贝类等海洋生物中被大量报道,因此,生物体解毒代谢酶等生理生化指标也成为海洋污染监测和评价的重要指标之一。
多毛类隶属于环节动物门,广泛栖居于污染物较为汇集的海陆交错带沉积质中,是具有典型沉积食性的底栖无脊椎动物。多毛类是许多大型海洋生物幼体的优质饵料,其丰度的大小会影响海洋生态系统食物链的能量流动和物质循环[9]。多毛类对有毒污染物较为敏感,常被用作生态监测的指示生物。近年来,国外学者陆续开展了多毛类外源污染物生物转化的研究,发现混合功能氧化酶CYP450在多毛类生物转化代谢过程中起着重要作用。已有报道显示[10-12]:欧洲沙蚕Nereis virens的 CYP342AI基因mRNA水平可被苯并(a)蒽等显著诱导;小头虫Capitella capitata的CYP4AT1和CYP331A1基因表达可被PAHs显著诱导;多齿围沙蚕Perinereis nuntia的CYP432A1、CYP431A1基因可被PAHs显著诱导。在国内相关报道尚不多见,本研究中,以广泛分布的多毛类双齿围沙蚕Perinereis aibuhitensis为研究对象,以B(a)P这一典型PAHs作为暴污物,研究了B(a)P暴露对双齿围沙蚕体内主要抗氧化酶和解毒代谢相关因子CYP450的影响,探讨了B(a)P对双齿围沙蚕的致毒机理,旨在为利用多毛类进行海洋环境污染监测提供参考依据。
1 材料与方法
1.1 材料
试验用双齿围沙蚕于退潮期采自辽宁省葫芦岛海域,体质量为 (1.5±0.5)g,将采集的个体放入塑料箱后迅速带回实验室进行暂养。暂养期间,每24 h更换一次海水,水温为 (13±0.5)℃,盐度为31~32,pH为8.25±0.10。
试验用分析纯B(a)P购于Sigma公司 (纯度为99%);分析纯丙酮购于上海国药集团化学试剂有限公司;RNAiso Plus、PrimeScript RT reagent Kit gDNA Eraser、SYBR Premix Ex TaqTMⅡ均购于TaKaRa公司;考马斯亮兰试剂盒、SOD试剂盒、CAT试剂盒和GSH-Px试剂盒均购于南京建成生物工程研究所。
1.2 方法
1.2.1 B(a)P暴露试验 参考文献[13]中的方法,设置两个B(a)P浓度,分别为5、50 μg/L,另设一空白对照组和体积分数为0.01%的丙酮溶剂对照组。挑取健康沙蚕个体,放入2 L预先加入500 mL不同浓度B(a)P毒液的塑料杯中,每个杯中放入8尾沙蚕,每个浓度设置4个重复。每24 h更换一次新的溶液,整个试验过程不投喂饲料,试验期间,水温维持在 (11±0.5)℃。于试验开始后第4、7、14天分别从各处理组中随机取8尾沙蚕,取体壁肌肉组织立即放入超低温冰箱 (-80℃)中保存备用。
1.2.2 CYP4基因表达的检测 采用相对定量方法分析B(a)P暴露下双齿围沙蚕CYP4基因表达的规律,选取β-actin作为内参基因。根据本实验室前期获得的双齿围沙蚕CYP4和β-actin序列信息[14],利用Primer 5.0软件设计引物,引物序列信息见表1。
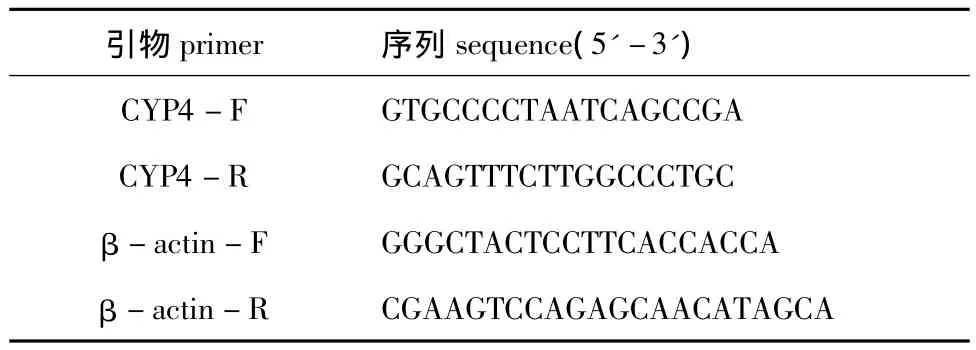
表1 引物序列信息Tab.1 Sequences of primers used in this experiment
将沙蚕体壁研磨成粉末,利用RNAiso Plus试剂盒提取总RNA,用10 g/L琼脂糖凝胶电泳检测RNA的完整性。取500 ng RNA,用PrimeScript RT reagent Kit gDNA Eraser试剂盒进行反转录获得cDNA。实时定量 PCR反应体系 (20 μL):SYBRⓇPremix Ex TaqTMⅡ 10 μL,引物 (10 μmol/L)各0.8 μL,ROX Reference Dye 0.4 μL,cDNA 2 μL,灭菌双蒸水6 μL。
PCR反应条件:95℃下预变性30 s;95℃下变性5 s,60℃下退火30 s,共进行40个循环。每个样品进行3次重复[15]。
1.2.3 组织匀浆的制备 取各处理组沙蚕体壁肌肉组织,加入一定量的生理盐水,制成10%的组织匀浆,于4℃下以2000 r/min离心15 min,取上清液于冰箱 (-20℃)中保存,用于后续酶活性的检测。
1.2.4 抗氧化酶活性的测定 各抗氧化酶指标的测定按照试剂盒说明书进行。采用黄嘌呤氧化酶法测定超氧化物歧化酶 (SOD)的活性,酶活力单位定义为:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U)。
采用分光光度计法测定过氧化氢酶 (CAT)的活性,酶活力单位定义为:每毫克组织蛋白每秒分解1 μmol H2O2为1个CAT活力单位 (U)。
采用双硫代对硝苯甲酸 (DTNB)比色法测定谷胱甘肽过氧化物酶 (GPx)的活性,酶活力单位定义为:每毫克蛋白质每分钟使反应体系中还原型谷胱甘肽浓度降低1 μmol/L为1个GPx活力单位(U)。
采用考马斯亮兰法测定样品蛋白含量,以牛血清白蛋白 (BSA)为标准蛋白。
1.3 数据处理
试验数据用平均值±标准差 (mean±S.D.)表示,利用SPSS 16软件对同一取样时间不同处理组进行单因素方差分析,显著性水平设为0.05。
2 结果与分析
2.1 暴露于不同B(a)P浓度中的双齿围沙蚕CYP4基因表达的变化
从图1可以看出,B(a)P胁迫到一定程度可以诱导沙蚕CYP4基因表达的升高,但是诱导趋势并不显著。暴露4 d时,各浓度组沙蚕CYP4基因表达与对照组相比均无显著性差异 (P>0.05);暴露7 d时,50 μg/L B(a)P浓度组沙蚕CYP4基因转录水平显著上调 (P<0.05),而5 μg/L浓度组CYP4基因表达与对照组依然无明显差异 (P>0.05);暴露14 d时,5、50 μg/L浓度组CYP4基因转录水平均出现升高。
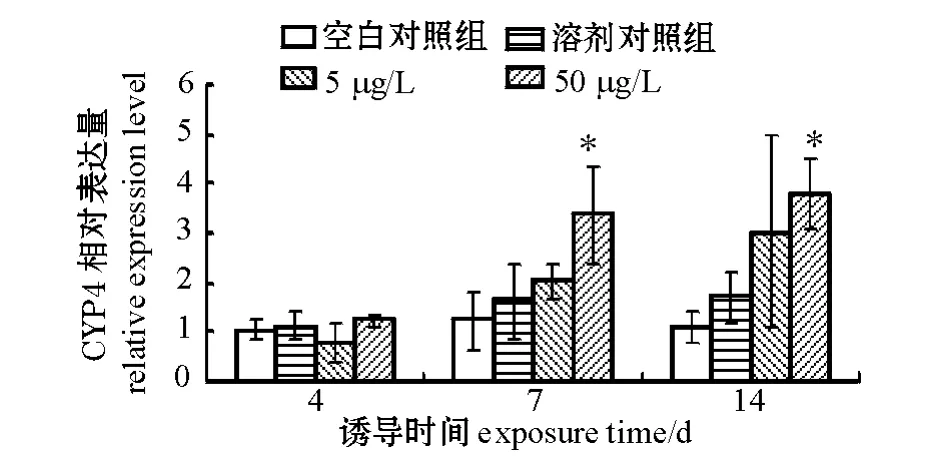
注:*表示与对照组有显著性差异 (P<0.05);**表示与对照组有极显著性差异 (P<0.01),下同Note:* means significant difference compared with the control(P<0.05);** means very significant difference compared with the control(P<0.01),et sequentia
2.2 暴露于不同B(a)P浓度中双齿围沙蚕SOD、CAT、GPx酶活性的变化
从图2可以看出,溶剂对照组与空白对照组的3种抗氧化酶活性均无明显差异 (P>0.05),表明丙酮作为助溶剂对沙蚕没有明显的毒性效应。在5 μg/L和50 μg/L B(a)P胁迫下,双齿围沙蚕SOD酶活性极显著升高 (P<0.01),并且随着胁迫时间的延长酶活性逐渐升高。在5 μg/L B(a)P中暴露4、7、14 d时,SOD酶活力分别为对照组的1.6、1.91、2.61倍;而在50 μg/L B(a)P中暴露4、7、14 d时,SOD酶活力分别为对照组的1.32、1.47、1.84倍。可以看出,5 μg/L B(a)P暴露组酶活性的升高趋势较50 μg/L浓度组明显。
从图2可以看出,在5、50 μg/L浓度组中,CAT酶活性呈现明显的上升趋势 (P<0.05),且CAT酶活性变化与暴露时间存在显著的正相关。在5 μg/L B(a)P中暴露4、7、14 d时,CAT酶活性分别为对照组的1.10、1.33、1.54倍;在50 μg/L B(a)P中暴露4、7、14 d时,酶活性分别为对照组的1.59、1.76、2.13倍。这一变化趋势与SOD酶活性的变化特征存在明显差异。
与SOD和CAT酶活变化规律相比,B(a)P胁迫下双齿围沙蚕GPx酶活性的变化幅度最大。从图2可见,沙蚕GPx酶活性随着B(a)P浓度和暴露时间的增加呈极显著的升高趋势 (P<0.01)。B(a)P各浓度处理组沙蚕GPx酶活性在4 d时已极显著高于对照组 (P<0.01),随着暴露时间的延长,酶活逐步升高。在5 μg/L和50 μg/L B(a)P胁迫下,双齿围沙蚕GPx酶活性在4 d时分别为对照组的3.34、4.61倍,在14 d时,GPx酶活力增加趋势更加明显,分别为对照组的4.64、5.70倍。
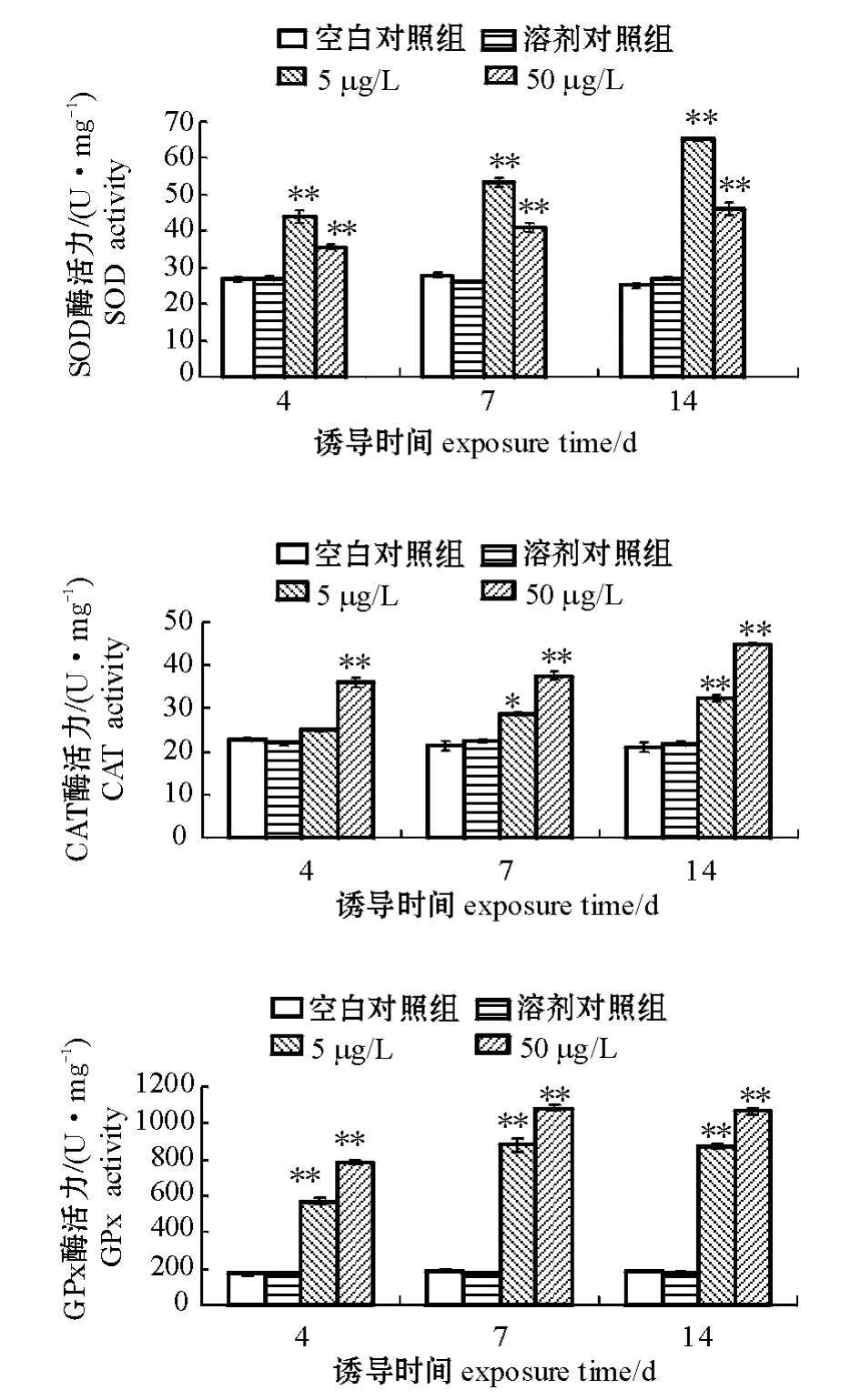
图2B(a)P胁迫对双齿围沙蚕SOD、CAT、GPx酶活性的影响Fig.2 The effects of B(a)P on activities of SOD,CAT and GPx in sandworm Perinereis aibuhitensis
3 讨论
3.1 B(a)P对双齿围沙蚕CYP450基因表达的影响
Jorgensen等[16]指出,多环芳烃在多毛类体内的生物转化过程类似于脊椎动物,亦包括细胞色素P450酶的氧化代谢和谷胱甘肽硫转移酶的解毒代谢两个阶段。本研究中,双齿围沙蚕CYP4基因的表达随着B(a)P暴露时间的延长和浓度的增加呈现上升趋势,表明B(a)P可以在转录水平上调双齿围沙蚕CYP4的表达,但CYP4基因上升趋势并不显著,暴露14 d时50 μg/L B(a)P浓度组沙蚕的CYP4基因转录水平仅为对照组的4.2倍。王振[17]在研究多齿围沙蚕对B(a)P毒性响应中发现,CYP4A在2.5 μg/L B(a)P诱导下表达量为对照组的 1203倍,而在 50 μg/L B(a)P诱导下CYP4A表达量与对照组相近,而CYP4B则无明显变化。在前期试验中,作者对获得的双齿围沙蚕CYP4基因进行了同源性比对[14],确定获得的CYP4基因属于CYP4B亚家族。本试验中CYP4基因表达与王振[17]的研究结果有差异,这可能与不同多毛类对多环芳烃生物转化能力的差别有关。Rust等[18]比较了6种不同多毛类对苯并芘的生物转化能力,结果发现,6种不同多毛类生物转化效率存在从92%~6%的较大差异性。另外,相比于脊椎动物和昆虫CYP家族基因在毒性诱导作用下的高表达水平,双齿围沙蚕CYP4基因表达的诱导程度较低,这一现象与Li等[11]在Capitella capitata中获得的结果相近,这种低诱导水平的表达可能与多毛类CYP酶表达的低调控能力有关。
3.2 B(a)P对双齿围沙蚕抗氧化酶活性的影响
污染物经过生物转化过程后会产生一定量的活性氧自由基,如果机体不及时清除会产生氧化损伤。在防御机体氧化损伤过程中,SOD、CAT和GPx 3种酶是起主要作用的抗氧化酶,SOD可以催化氧自由基(O-2·)歧化生成H2O2,CAT可以分解H2O2成为H2O和 O2,GPx可以催化 H2O2分解为H2O或使许多脂质过氧化物还原为正常状态[19]。本试验结果显示,双齿围沙蚕的这3种抗氧化酶活性随着B(a)P暴露时间的延长均呈明显的上升趋势,表明随着暴露时间的延长机体内活性氧自由基大量产生,SOD活性的升高可以消除活性氧自由基,CAT和GPx酶活性的变化趋势具有一致性,这两种酶活性的提高可以去除代谢中产生的过氧化氢,从而减少生物体受到氧化损伤的风险。这一变化趋势与其他研究结果相类似[8,17,20 -22]。
但SOD与CAT和GPx酶活性的变化并不一致,在50 μg/L B(a)P诱导条件下,沙蚕SOD活性的上升趋势明显低于5 μg/L B(a)P浓度组,而CAT和GPx活性则与B(a)P浓度呈现正相关。不少研究表明,SOD、CAT和GPx之间存在一定的正相关性,也有学者发现,这3个酶之间不一定存在正相关。本试验中产生这一现象的原因可能与CYP家族在多环芳烃代谢中的作用有关。Livingstone等[23]在研究沙丁鱼 Limanda limanda的抗氧化酶活性时发现,SOD和CAT变化趋势并不一致,推断成因是由于H2O2的来源不只是SOD催化的歧化反应产物,它还可以通过氨基酸或细胞色素P450氧化酶激活。本试验中获得的数据与这一结果相一致,在进行B(a)P对双齿围沙蚕抗氧化酶活性影响研究的同时,也进行了B(a)P对双齿围沙蚕CYP450基因表达的影响分析,发现B(a)P会诱导该基因的表达。故推断在双齿围沙蚕中H2O2的来源可能有一部分是通过细胞色素P450氧化酶来激活的。
[1] Tsai W T,Mi H H,Chang Y M,et al.Polycyclic aromatic hydrocarbons(PAHs)in biocrudes from induction-heating pyrolysis of biomass wastes[J].Bioresource Technology,2007,98:1133 -1137.
[2] 周启星,孔繁翔,朱琳.生态毒理学[M].北京:科学出版社,2004:372-378.
[3] Wu Y,Zhang J.Distribution of polycyclic aromatic hydrocarbon in core sediments of the Bohai Straight[J].Environment Science,2001,22(3):74 -77.
[4] Tian Y,Zheng T L,Wang X H,et al.Contamination characteristics of polycyclic aromatic hydrocarbons and bioremediation strategy in sediments of Western Xiamen Harbor and its adjacent sea area[J].Journal of Oceanography Taiwan Strait,2003,22(2):192 -200.
[5] Wu Y,Wang C,Wang Y,et al.Antioxidant responses to benzo[a]pyrene,tributyltin and their mixture in the spleen ofSebastiscus marmoratus[J].Journal of Environmental Science,2007,19(9):1129-1135.
[6] Wang Y,Zheng R,Zuo Z,et al.Relation of hepatic EROD activity and cytochrome P4501A level in Sebastiscusmarmoratusexposed to benzo[a]pyrene[J].Journal of Environmental Science,2008,20(1):101-104.
[7] Holtha T F,Nourizadeh - Lillabadic R,Blaesbjergd M,et al.Dif-ferential gene expression and biomarkers in zebrafish(Danio rerio)following exposure to produced water components[J].Aquatic Toxicology,2008,90(4):277 -291.
[8] 任加云,潘鲁青,苗晶晶.苯并(a)芘和苯并(k)荧葱混合物对栉孔扇贝毒理学指标的影响[J].环境科学学报,2006,26(7):l-7.
[9] Jogensen A,Giessing A M B,Rasmussen L J,et al.Biotransformation of the polycyclic aromatic hydrocarbon pyrene in the marine polychaete Nereis virens[J].Environmental Toxicology and Chemistry,2004,24:2796 -2805.
[10] Rewitz K,Kjellerup C,Jogensen A,et al.Identification of two Nereis virens(Annelida:Polychaeta)cytochromes P450 and induction by xenobiotics[J].Comparative Biochemistry and Physiology Part C,2004,138:89 -96.
[11] Li B,Bisgaard H C,Forbes V.Identification and expression of two novel cytochrome P450 genes,belonging to CYP4 and a new CYP331 family,in the polychaete Capitella capitata sp.I[J].Biochemical and Biophysical Research Communications,2004,325:510-517.
[12] Won E J,Rhee J S,Shin K H,et al.Expression of three novel cytochrome P450 and antioxidative genes from the polychaete,Perinereis nuntiaexposed to water accommodated fraction(WAF)of Iranian crude oil and benzo[a]pyrene[J].Marine Environmental Research,2013,90,75 -84.
[13] 宋莹莹,袁秀堂,张升利,等.苯并(a)芘、镉单一及复合污染对双齿围沙蚕3刚节疣足幼体发育的影响[J].海洋环境科学,2011,30(3):333 -336.
[14] Chen X,Zhou Y,Yang D,et al.CYP4 mRNA expression in marine polychaetePerinereis aibuhitensisin response to petroleum hydrocarbon and deltamethrin[J].Marine Pollution Bulletin,2012,64(9):1782 -1788.
[15] Lival K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2–△△Ctmethod[J].Methods,2001,25:402 -408.
[16] Jorgensen A,Giessing A M B,Rasmussen L J,et al.Biotransformation of polycyclic aromatic hydrocarbon pyrene in marine polychaete[J].Marine Environmental Research,2008,65:171 -186.
[17] 王振.多齿围沙蚕(Perinereis nuntiaSavigny)对苯并(a)芘的毒性响应[D].汕头:汕头大学,2010.
[18] Rust A J,Burgess R M,Brownawell B J,et al.Relationship between metabolism and bioaccumulation of benzo(a)pyrene in benthic invertebrates[J].Environmental Toxicology and Chemistry,2004,23:2587 -2593.
[19] 邢慧芳,李涌泉,杨慧珍,等.镉对背角无齿蚌外套膜和鳃抗氧化酶活性及脂质过氧化的影响[J].环境科学学报,2013,33(3):856-860.
[20] Sole H M,Porte C,Albaiges J,et al.Mixed - function oxygenase system components and antioxidant enzymes in different marine bivalves:its relation with contaminant body burdens[J].Aquatic Toxicology,1994,30(3):271 -283.
[21] 丁正峰,薛晖,王晓丰,等.乐斯本对克氏原螯虾肝胰脏抗氧化系统的影响[J].大连海洋大学学报,2013,28(1):72 -76.
[22] 郭黎,马爱军,王新安,等.盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J].大连海洋大学学报,2012,27(5):422-428.
[23] Livingstone D R,Archibald S,Chipman J K,et al.Antioxidant enzymes in liver of the dab(Limanda limanda)from the North Sea[J].Marine Ecology Progress Series,1992,91:97 -104.
Effects of B(a)P exposure on antioxidant enzyme activity and CYP450 gene expression in sandworm Perinereis aibuhitensis
ZHAO Huan,ZHAO Xin-da,YUE Zong-hao,ZHOU Yi-bing
(Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
The influence of B(a)P exposure on three different antioxidant enzyme activities and CYP450 gene expression were investigated in sandwormPerinereis aibuhitensiswith body weight of 1.5 g ±0.5 g in an indoor experiment.The CYP450 gene expression was shown to be positively related to exposure time and dosage of B(a)P,with up-regulation with time elapse and increase in B(a)P concentration.There was increase in activities of superoxide dismutase(SOD),catalase(CAT)and glutathione peroxidase(GPx)with increase in B(a)P concentration and the exposure time.SOD activity,however,was exhibited by higher concentration of B(a)P,and the activities of CAT and GPx were shown to be positive relation with the B(a)P concentration.
Perinereis aibuhitensis;B(a)P;CYP450;antioxidant enzyme
X174;Q786
A
10.3969/J.ISSN.2095 -1388.2014.04.004
2095 -1388(2014)04 -0342 -05
2013-11-29
国家海洋局海洋溢油鉴别与损害评估技术重点实验室开放基金资助项目 (201217);海洋公益性项目 (201305002,201305043);国家自然科学基金资助项目 (41306138,30901107)
赵欢 (1983—),女,博士,助理研究员。E-mail:zhaohuan@dlou.edu.cn
周一兵 (1957—),男,教授。E-mail:ybzhou@dlou.edu.cn
- 大连海洋大学学报的其它文章
- 双齿围沙蚕Cu/Zn-SOD cDNA基因的克隆及序列分析

