罗格列酮对糖尿病牙周炎大鼠炎症反应的影响研究
黄 辉
牙周炎是一种由于细菌侵犯牙龈和牙周组织而引起的慢性炎症,其主要特征为牙周袋的形成及袋壁的炎症,牙槽骨吸收和牙齿逐渐松动[1]。牙周炎在糖尿病人群中发病率较高[2],已被认为是糖尿病的第六大并发症[3]。罗格列酮通过与过氧化物酶体增殖物激活受体γ(PPAR-γ)结合而发挥作用,除了具有治疗2型糖尿病[4]的功能之外,还可减轻急性、慢性炎症反应[5]。因此,本研究将对罗格列酮在糖尿病牙周炎大鼠牙周组织中的炎症抑制效应进行探讨。
1 材料与方法
1.1 主要药品和试剂 马来酸罗格列酮片(文迪雅)由葛兰素史克(天津)有限公司提供,批号 06070021。试剂链脲佐菌素(批号040103)、GW9662(PPAR-γ特异拮抗剂)购自Sigma公司;细胞间黏附分子1(ICAM-1)及血管细胞黏附分子1(VCAM-1) 酶联免疫吸附测定(ELISA)试剂盒购自美国R&D公司。兔抗人actin多克隆抗体、兔抗人PPAR-γ多克隆抗体、兔抗人核因子κB(NF-κB)多克隆抗体、羊抗兔二抗及ECL显影剂均购自美国Santa Cruz公司。
1.2 动物分组及模型制备 选用纯种雄性6月龄SD大鼠40只(广西医科大学实验动物中心提供),体质量(236±13)g。以随机数字表法随机分为对照组、糖尿病牙周炎组、罗格列酮组及罗格列酮+GW9662组,每组10只。除对照组外,其余各组大鼠按55 mg/kg体质量腹腔一次性注射链脲佐菌素溶液,确定空腹血糖>16.7 mmol/L糖尿病动物模型建立。1周后1%戊巴比妥钠麻醉下用直径0.2 mm的正畸钢丝结扎右侧上颌第一磨牙颈部,并喂黏性食料。结扎术后4周,临床观察见右上颌第一、二磨牙间牙龈红肿糜烂;动物组织学观察发现结合上皮与牙体分离,胶原纤维排列紊乱,牙槽嵴顶破坏吸收,确认牙周炎动物模型建立。糖尿病牙周炎动物模型建立后第1天起,对照组予10%二甲基亚砜(DMSO)2 ml/kg;糖尿病牙周炎组予DMSO 2 ml/kg;罗格列酮组予罗格列酮3 mg/kg,罗格列酮+GW9662组予罗格列酮3 mg/kg+GW9662 0.3 mg/kg,灌胃1次/d,连续1周。1周后处死大鼠,取牙龈组织,称质量,分别用于相关生化指标的检测及免疫组织切片的制备,剩余部分置液氮中保存。
1.3 牙槽骨骨吸收度测量 实验终点处死大鼠后,截取包括实验区磨牙的双侧上颌骨,置于10%中性甲醛溶液中,固定后脱钙,制作石蜡切片,苏木素-伊红(HE)染色,德国DMR+Q550病理图像分析仪测量釉牙骨质界(CEJ)至第一磨牙近中牙槽嵴顶(A)的垂直距离(CEJ-A),取5张切片的平均值。
1.4 牙龈组织多形核中性粒细胞计数(PMNs) 实验终点处死大鼠后,迅速切下牙龈组织,冰0.9%氯化钠溶液洗净后,置于10%中性甲醛溶液中固定12 h,常规石蜡包埋。3 μm厚切片,HE染色。观察高倍镜下(×400)牙龈结缔组织及上皮组织共20个视野,视野范围内计数浸润的PMNs,取平均值。
1.5 牙龈组织ICAM-1及VCAM-1含量测定 取每只大鼠牙周组织,用无菌0.9%氯化钠溶液冲洗干净,吸干水分,称质量,按每0.1 g牙周组织加磷酸盐缓冲液(PBS)1.5 ml稀释,匀浆后,离心取上清液,置-80 ℃冰箱冻存备检。ELISA法检测步骤严格按照试剂盒说明书操作。用考马斯亮蓝法测定牙龈组织上清液蛋白含量。计算出每克蛋白ICAM-1及VCAM-1含量。
1.6 Western blotting测定NF-κB及PPAR-γ 取牙龈组织,液氮冻存。提取总蛋白并按Pierce BCA蛋白定量试剂盒说明书操作,取细胞溶解液蛋白50 μg在80 g/L的十二烷基苯磺酸钠(SDS)聚丙烯酰胺凝胶上电泳后,冰上恒压100 V电转1 h,蛋白转至聚偏二氟乙烯(PVDF)膜上,加入1∶200稀释的兔抗人NF-κB抗体以及兔抗人PPAR-γ抗体,4 ℃过夜。TBST缓冲液漂洗后加入1∶400生物素化的羊抗兔二抗,室温下摇床杂交1 h。TBST漂洗后以ECL化学发光底物系统放射自显影。以相同方法测定内参照β-actin的表达。通过bio-rad gel doc2000图像分析系统分析结果,NF-κB、PPAR-γ的表达水平以NF-κB、PPAR-γ灰度值与β-actin灰度值的相对值(相对灰度值)表示。
2 结果
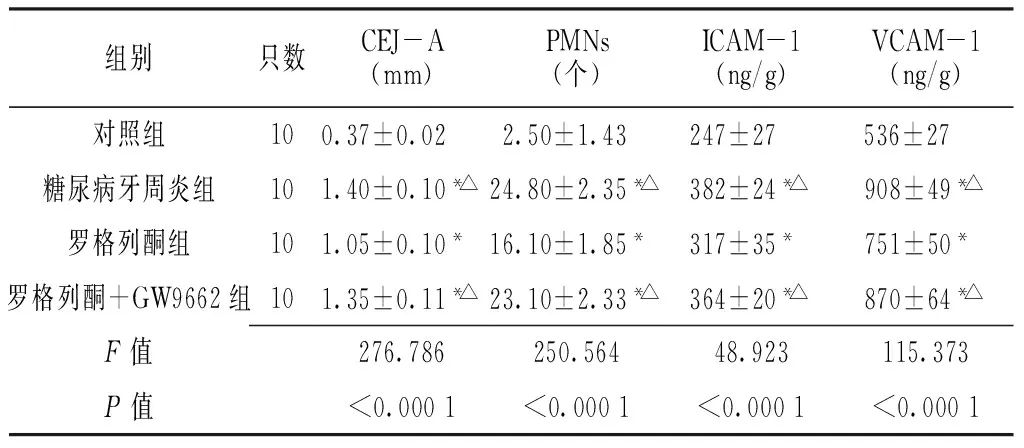
2.1 各组CEJ-A比较 与对照组比较,糖尿病牙周炎组、罗格列酮组及罗格列酮+GW9662组CEJ-A增高,差异均有统计学意义(P<0.05);与罗格列酮组比较,糖尿病牙周炎组及罗格列酮+GW9662组CEJ-A增高,差异均有统计学意义(P<0.05,见表1)。
2.2 各组牙龈组织PMNs比较 与对照组比较,糖尿病牙周炎组、罗格列酮组及罗格列酮+GW9662组PMNs增高,差异均有统计学意义(P<0.05);与罗格列酮组比较,糖尿病牙周炎组及罗格列酮+GW9662组PMNs增高,差异均有统计学意义(P<0.05,见表1)。
2.3 各组牙龈组织ICAM-1及VCAM-1含量比较 与对照组比较,糖尿病牙周炎组、罗格列酮组及罗格列酮+GW9662组ICAM-1及VCAM-1含量增高,差异均有统计学意义(P<0.05);与罗格列酮组比较,糖尿病牙周炎组及罗格列酮+GW9662组ICAM-1及VCAM-1含量增高,差异均有统计学意义(P<0.05,见表1)。
2.4 各组牙龈组织NF-κB及PPAR-γ比较 与对照组比较,糖尿病牙周炎组、罗格列酮组及罗格列酮+GW9662组NF-κB表达增高,差异均有统计学意义(P<0.05);与罗格列酮组比较,糖尿病牙周炎组及罗格列酮+GW9662组NF-κB表达增高,差异均有统计学意义(P<0.05)。罗格列酮组PPAR-γ表达高于对照组、糖尿病牙周炎组及罗格列酮+GW9662组,差异均有统计学意义(P<0.05,见图1)。
Table1 Comparison of expressions of CEJ-A,PMNs,ICAM-1 and VCAM-1 in each group
组别只数CEJ-A(mm)PMNs(个)ICAM-1(ng/g)VCAM-1(ng/g)对照组100.37±0.02 2.50±1.43 247±27 536±27 糖尿病牙周炎组101.40±0.10*△24.80±2.35*△382±24*△908±49*△罗格列酮组101.05±0.10* 16.10±1.85* 317±35* 751±50* 罗格列酮+GW9662组101.35±0.11*△23.10±2.33*△364±20*△870±64*△F值276.786250.56448.923115.373P值<0.0001<0.0001<0.0001<0.0001
注:CEJ-A =釉牙骨质界至第一磨牙近中牙槽嵴顶的垂直距离,PMNs=多形核中性粒细胞计数,ICAM-1=细胞间黏附分子1,VCAM-1=血管细胞黏附分子1;与对照组比较,*P<0.05;与罗格列酮组比较,△P<0.05
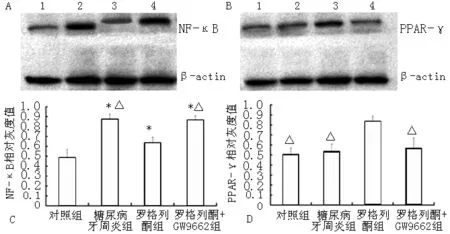
注:NF-κB=核因子κB,PPAR-γ=过氧化物酶体增殖物激活受体γ;A各组NF-κB的Western blotting结果,B各组PPAR-γ的Western blotting结果,C各组NF-κB相对灰度值比较,D各组PPAR-γ相对灰度值比较;1为对照组,2为糖尿病牙周炎组,3为罗格列酮组,4为罗格列酮+GW9662组;与对照组比较,*P<0.05;与罗格列酮组比较,△P<0.05
图1 各组牙龈组织NF-κB及PPAR-γ比较
Figure1 Comparison of expressions of NF-κB and PPAR-γ in gingival tissues in each group
3 讨论
糖尿病是牙周炎的危险因素,同时牙周炎对糖尿病的代谢控制亦有不良影响[6]。糖尿病患者体内长期高血糖生成的氧自由基,不但可直接损伤牙周组织,还可激活NF-κB、蛋白激酶C(PKC)等通路,产生白介素6(IL-6)和ICAM-1等炎性细胞因子,进而激活破骨细胞和胶原酶,导致骨与牙周组织破坏[7],而抑制炎症反应可抑制牙槽骨吸收的速度[8]。在本研究中,也证实了这一现象,患有糖尿病牙周炎的大鼠CEJ-A要比正常大鼠高;同时,糖尿病牙周炎组牙龈组织中PMNs、ICAM-1、VCAM-1、NF-κB均较对照组增高,这提示糖尿病牙周炎组牙龈组织炎症反应明显,牙槽骨高度丧失。其机制可能在于糖尿病牙周炎组NF-κB活性增强,致其下游的炎性细胞因子ICAM-1及VCAM-1合成增加[9]。由于ICAM-1和VCAM-1的介导,PMNs向炎症部位的运动也随之增强[10],对牙龈组织造成进一步破坏[11],最终引起牙槽骨的吸收[12]。
罗格列酮是噻唑烷二酮类药物,是有效的核转录因子PPAR-γ的选择性激动剂,与PPAR-γ结合后,激活PPAR-γ的生物学作用,从而调控许多炎症反应,人工合成的PPAR-γ受体激动剂可抑制单核细胞产生肿瘤坏死因子α(TNF-α)和其他前炎性细胞因子[13]。本研究结果也证实了这一观点。与糖尿病牙周炎组比较,罗格列酮组可减少ICAM-1、VCAM-1、NF-κB,减少PMNs浸润,表明罗格列酮可缓解糖尿病牙周炎大鼠牙龈组织炎症反应,抑制CEJ-A增高。
本研究观察到,罗格列酮组PPAR-γ表达上调。PPAR-γ配体可能在转录水平抑制激活蛋白-1(AP-1)和NF-κB活性[14],因此罗格列酮可能通过上调PPAR-γ表达,抑制NF-κB活性,从而下调趋化因子ICAM-1和VCAM-1表达,减少PMNs浸润牙龈组织,进而抑制牙周组织炎症对牙龈组织的破坏,减少牙槽骨的吸收。此外,对于罗格列酮+GW9662组,由于使用PPAR-γ特异拮抗剂GW9662可拮抗罗格列酮上调PPAR-γ蛋白的效应,因而抑制了罗格列酮在大鼠糖尿病牙周炎的抗炎作用。
综上所述,在大鼠糖尿病牙周炎模型中,罗格列酮可通过上调PPAR-γ表达,抑制NF-κB活性,减少PMNs浸润,进而减轻炎症反应,减少牙槽骨的吸收。但由于动物和人体之间的构造不同,因而还有待于在临床上进一步探索。
1 Tominari T,Hirata M,Matsumoto C,et al.Polymethoxy flavonoids,nobiletin and tangeretin,prevent lipopolysaccharide-induced inflammatory bone loss in an experimental model for periodontitis[J].J Pharmacol Sci,2012,119(4):390-394.
2 Bascones-Martínez A,Arias-Herrera S,Criado-Cámara E,et al.Periodontal disease and diabetes[J].Adv Exp Med Biol,2012,771:76-87.
3 Shetty S,Kohad R,Yeltiwar R,et al.Gingival blood glucose estimation with reagent test strips:a method to detect diabetes in a periodontal population[J].J Periodontol,2011,82(11):1548-1555.
4 Norwood P,Liutkus JF,Haber H,et al.Safety of exenatide once weekly in patients with type 2 diabetes mellitus treated with a thiazolidinedione alone or in combination with metformin for 2 years[J].Clin Ther,2012,34(10):2082-2090.
5 Ji Y,Liu J,Wang Z,et al.PPARγ agonist rosiglitazone ameliorates LPS-induced inflammation in vascular smooth muscle cells via the TLR4/TRIF/IRF3/IP-10 signaling pathway[J].Cytokine,2011,55(3):409-419.
6 Taylor GW,Bornakke WS.Periodiontal disease:associations with diabetes,glycemic control and complications[J].Oral Dis,2008,14(3):191-203.
7 邓雨泉,付云,齐刘英,等.糖基化终产物对人牙龈成纤维细胞增殖和基质金属蛋白酶-1合成的影响[J].中华口腔医学研究杂志:电子版,2009,3(3):250-254.
8 Liu R,Bal HS,Desta T,et al.Diabetes enhances periodontal bone loss through enhanced resorption and diminished bone formation[J].J Dent Res,2006,85(6):510-514.
9 王永霞,李道明,李海梅,等.NF-κB p65与ICAM-1在食管鳞癌中的表达及临床病理意义[J].实用医学杂志,2011,27(22):4078-4080.
10 Yasukawa K,Tokuda H,Tun X,et al.The detrimental effect of nitric oxide on tissue is associated with inflammatory events in the vascular endothelium and neutrophils in mice with dextran sodium sulfate-induced colitis[J].Free Radic Res,2012,46(12):1427-1436.
11 Carneiro VM,Bezerra AC,Guimarães Mdo C,et al.Decreased phagocytic function in neutrophils and monocytes from peripheral blood in periodontal disease[J].J Appl Oral Sci,2012,20(5):503-509.
12 Papadopoulos G,Weinberg EO,Massari P,et al.Macrophage-specific TLR2 signaling mediates pathogen-induced TNF-dependent inflammatory oral bone loss[J].J Immunol,2013,190(3):1148-1157.
13 Kilgore KS,Billin AN.PPARbeta/delta ligands as modulators of the inflammatory response[J].Curr Opin Investig Drugs,2008,9(5):463-469.
14 Neri T,Armani C,Peqoli A,et al.Role of NF-kappaB and PPAR-gamma in lung inflammation induced by monocyte-derived microparticles[J].Eur Respir J,2011,37(6):1494-1502.

