COPD急性加重期并发呼吸衰竭患者血清血管内皮生长因子测定的意义
王 虹,张少卿
COPD患病人数多、病死率高、社会经济负担沉重,到2020年,其死亡率将上升至所有疾病的第3位[1]。当COPD患者因感染等诱因急性发作时,可产生心肺功能失代偿,出现呼吸衰竭[2-3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是最有力的促血管生成因子,并可调节血管渗透性,近年研究发现VEGF不仅有上述功能,还能调节肺泡上皮细胞及血管内皮细胞的凋亡,并在慢性炎症性气道疾病中的气道重塑中起作用,从而参与COPD的病理生理过程[4]。本研究旨在观察血清VEGF在COPD急性加重期(AECOPD)并发呼吸衰竭患者预后判定中的作用,以期为降低COPD病死率提供临床途径和线索。
1 资料与方法
1.1 临床资料 选取2012年12月—2013年12月在广东药学院附属第一医院呼吸科及ICU住院的AECOPD并发呼吸衰竭患者69例为研究对象,均符合2007年中华医学会呼吸病学分会制订的COPD诊治指南的诊断标准[5];符合AECOPD 诊断标准:短期内有咳嗽加重、呼吸困难加重、脓性痰三项表现中的两项及以上的COPD患者;动脉血气分析结果符合以下标准:在海平面、静息状态、吸氧或吸空气时,动脉血二氧化碳分压(PaCO2)>50 mm Hg (1 mm Hg=0.133 kPa)伴或不伴动脉血氧分压(PaO2)<60 mm Hg;均有吸烟和被动吸烟史(5年以上)。排除标准为:(1)左心衰竭等原发心脏因素导致低氧的疾病;(2)合并恶性肿瘤及自身免疫性疾病。
1.2 方法 采用前瞻性研究方法,患者入组时间是因AECOPD 住院的入院时间,结局事件为死亡,观察截止时间是患者出院。在患者入院后24 h内收集患者一般情况,包括患者年龄、身高、体质量、有无其他慢性病、吸烟情况及病史资料。所有患者入院即予经验性广谱抗生素、氧疗、祛痰剂,支气管扩张剂及无创通气,必要时行有创机械通气及入住ICU 病房治疗。
1.3 标本收集 患者收入住院后,首先抽取2 ml 动脉血测定动脉血气。并于入院24 h内清晨卧位抽取静脉血5 ml,-70 ℃冻存待测。
1.4 指标检测 采用酶联免疫吸附法(ELISA)测定血清VEGF水平,操作严格按试剂盒(RD,美国)说明书进行,在酶标仪上读数。血清超敏C反应蛋白(hs-CRP)采用乳胶免疫比浊法(SEKISUI,日本)测定。血浆纤维蛋白原(FIB)采用凝固法测定。血气分析采用电极法(Nova Stat Profile M,美国)测定。外周血中性粒细胞分数(N)由广东药学院附属第一医院检验科测定。测量患者身高、体质量,计算体质指数(BMI)。
1.5 分组 根据患者随访期内是否死亡将患者分为两组:死亡组及存活组。
2 结果
2.1 2组患者入院时一般情况比较 69例患者中死亡17例,病死率为24.6%。存活组和死亡组性别比较,差异无统计学意义(P>0.05)。死亡组患者年龄、COPD病程、吸烟指数均高于存活组,BMI低于存活组,差异有统计学意义(P<0.05,见表1)。
2.2 2组检测指标比较 死亡组VEGF、pH值、氧合指数(PaO2/FiO2)均低于存活组,hs-CRP、N、PaCO2均高于存活组,差异有统计学意义(P<0.05)。2组FIB比较,差异无统计学意义(P>0.05,见表2)。
表1 2组患者入院时一般情况比较
Table1 Comparison of baseline characteristics between two groups of patients
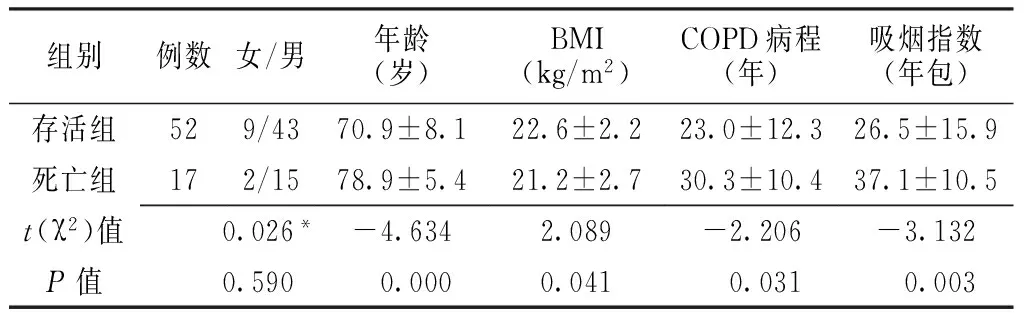
组别例数女/男年龄(岁)BMI(kg/m2)COPD病程(年)吸烟指数(年包)存活组529/4370.9±8.122.6±2.223.0±12.326.5±15.9死亡组172/1578.9±5.421.2±2.730.3±10.437.1±10.5t(χ2)值0.026*-4.6342.089-2.206-3.132P值0.590 0.0000.041 0.031 0.003
注:BMI=体质指数,COPD=慢性阻塞性肺疾病;*为χ2值

表2 2组检测指标比较
注:VEGF=血管内皮生长因子,hs-CRP=超敏C反应蛋白,FIB=纤维蛋白原,N=中性粒细胞分数,PaCO2=二氧化碳分压,PaO2/FiO2=氧合指数
2.3 影响AECOPD并发呼吸衰竭患者预后的多因素分析 以预后为因变量,以患者的性别(男=1,女=0)、年龄、BMI、COPD病程、吸烟指数及血清VEGF、hs-CRP、N、PaCO2、PaO2/FiO2(均为实测值)为自变量,纳入Logistic回归方程,结果显示,入院血清VEGF、hs-CRP、PaCO2进入回归方程(见表3)。
表3 AECOPD并发呼吸衰竭患者预后影响因素的多因素Logistic回归分析
Table3 Multivariate Logistic regression analysis on the influencing factors for prognosis of patients with AECOPD complicated with respiratory failure

变量βSEWaldχ2值P值OR95%CIVEGF-0.0350.0136.8600.0090.966(0.941,0.991)hs-CRP0.1240.0515.8880.0151.132(1.024,1.251)PaCO20.2090.0954.8860.0271.233(1.024,1.485)
2.4 AECOPD并发呼吸衰竭患者血清VEGF与各项指标的相关性 血清VEGF与BMI(r=0.351,P=0.003,见图1)、动脉血pH值(r=0.305,P=0.011,见图2)呈正相关,与COPD病程(r=-0.254,P=0.036,见图3)、PaCO2(r=-0.574,P=0.000)呈负相关(见图4);与吸烟指数(r=-0.090,P=0.464)、hs-CRP(r=-0.121,P=0.321)、FIB(r=-0.128,P=0.294)、N(r=0.044,P=0.718)无直线相关关系。
3 讨论
COPD是世界范围内严重危害公共健康的常见病与多发病,常并发呼吸衰竭。尽管目前已有包括机械通气等多种治疗手段,但其死亡率仍较高[6-8]。因此,积极寻找相关危险因素,客观、快速、准确地评估预后,对降低COPD并发呼吸衰竭的死亡率有重要临床意义。

图1 血VEGF与BMI的相关性散点图
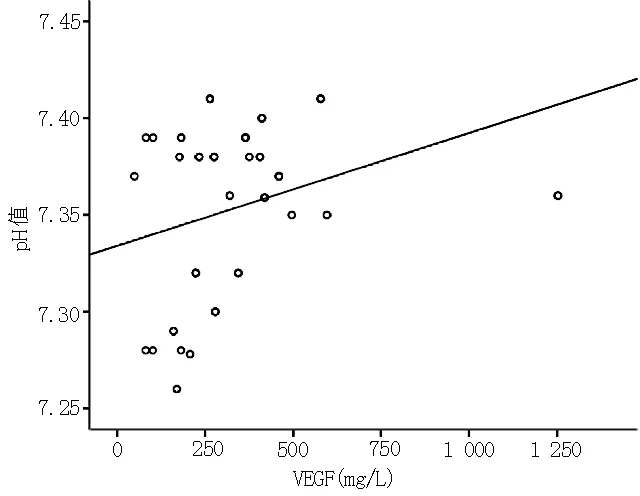
图2 血VEGF与pH值的相关性散点图

图3 血VEGF与COPD病程的相关性散点图
Figure3 Scatter diagram of correlation between serum VEGF level and course of COPD
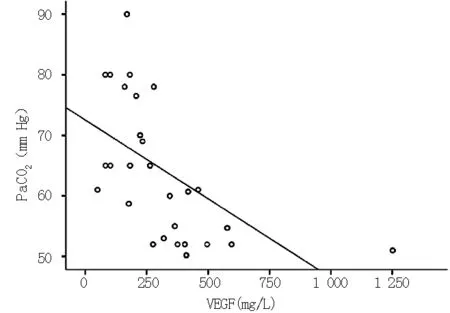
图4 血VEGF与PaCO2的相关性散点图
本研究单因素分析结果表明,AECOPD并发呼吸衰竭患者年龄、BMI、COPD病程、吸烟指数、血清VEGF、hs-CRP、N、动脉血pH值、PaCO2、PaO2/FiO2在死亡组与存活组均有差异。而多因素分析在排除年龄、BMI、COPD病程、吸烟指数等指标的影响后,最终得出血清VEGF、hs-CRP、PaCO2为影响AECOPD并发呼吸衰竭患者住院期间短期预后的独立危险因素。
系统性炎症是COPD的主要特征之一[9]。在众多的系统性炎性因子中,CRP的重要性被众多学者所关注。在多个研究中,血CRP水平已被发现与COPD 疾病的严重程度、生活质量、运动能力、对治疗的反应和病死率相关[10-11]。有研究表明COPD患者CRP水平高于健康对照者[12-13]。Thomsen等[14]认为hs-CRP水平升高增加COPD急性加重的风险;Liu等[15]观察发现CRP是稳定期COPD病死率的预测因素之一;Moberg等[16]进行了为期45个月的观察,也发现CRP是稳定期重度至极重度COPD患者病死率的预测因素。国内聂姗等[17]也发现hs-CRP水平升高预示AECOPD的风险增大。本研究的结果与上述研究结果相似,认为血清hs-CRP水平升高增加AECOPD并发呼吸衰竭患者住院期间死亡风险,且为预测AECOPD并发呼吸衰竭患者住院期间死亡的独立危险因素。
VEGF最初被定义为血管通透性因子,后发现其在血管生成、血管重塑、伤口愈合和组织细胞保护等多方面起关键作用。VEGF在血管丰富的器官和组织广泛表达,在肺内VEGF表达水平较高,起着维持肺泡结构正常关键作用[4]。可溶性VEGF由包括平滑肌细胞、成纤维细胞和上皮细胞在内的靠近气道微血管的多种细胞分泌,此外,一些非内皮细胞也表达VEGF受体[18]。近年研究发现VEGF失调参与了支气管哮喘和COPD等慢性气道炎症性疾病的发病过程[19]。越来越多的研究表明,VEGF也是COPD的炎性因子之一[20]。
目前有关VEGF在COPD表达水平的研究结果各有不同[21],观察发现,无症状吸烟者和COPD支气管炎型吸烟者诱导痰VEGF水平比非吸烟者高,且VEGF水平与吸烟指数相关[18]。鼠类接触烟草烟雾引发支气管肺泡灌洗液VEGF水平升高及肺部炎性反应[22]。另一方面,有研究表明,VEGF可能对缺氧诱发的肺动脉高压有一定的保护作用[23]。香烟的烟雾干扰VEGF介导的存活信号传导,降低VEGF,减少VEGF受体在COPD肺部表达,从而导致内皮细胞凋亡和血管减少[24]。而且,COPD患者痰VEGF水平减少与一秒用力呼气容积(FEV1)下降相关,提示VEGF表达减少导致肺泡壁,包括微血管破坏[4,25]。由此,有学者推测,在COPD早期,VEGF尚能发挥其对肺结构的保护作用,对抗肺部炎性反应而代偿性升高。而随着COPD病情加重,VEGF表达减少,进一步加重肺泡结构的破坏[26]。国内郭瑛等[27]研究表明,COPD组较健康对照组VEGF水平明显降低。同时,随着肺功能逐渐减退,COPD患者的VEGF水平有逐渐下降的趋势。本研究结果显示血清VEGF水平降低为预测AECOPD并发呼吸衰竭患者住院期间死亡的独立危险因素,而且其水平与患者BMI、动脉血pH值呈正相关,与COPD病程、PaCO2呈负相关。
FIB是一种凝血因子,也是一种炎性因子。一些研究发现FIB是COPD 系统性炎症的炎性因子之一,是COPD急性加重的危险因素[28]。但本研究为阴性结果,可能与样本量过少有关系,也可能与FIB非肺部特异性生物学指标,其水平变化并不能够确切反映肺部病变的情况有关[29]。
总之,本研究结果表明,血清VEGF作为COPD的炎性因子之一,和血清hs-CRP一样,是AECOPD并发呼吸衰竭短期预后判定的重要指标。因此,AECOPD并发呼吸衰竭患者测定血清VEGF,可为更好地救治COPD并发呼吸衰竭、降低病死率提供线索和帮助。今后仍需大宗病例及长程随访期的研究,以进一步证实血清VEGF与AECOPD并发呼吸衰竭患者预后的关系。
1 Global Initiative for Chronic Obstructive Lung Disease (GOLD).Global strategy for the diagnosis,management and prevention of chronic obstructive pulmonary disease[EB/OL].(2013-02-15).http://www.goldcopd.org/htm.
2 赵林凤,赵祺.慢性心力衰竭患者合并慢性阻塞性肺疾病的诊治分析[J].实用心脑肺血管病杂志,2013,21(1):90.
3 张景,盛艳玲.慢性阻塞性肺疾病急性加重期的诊治 [J].中国临床医生,2013,41(2):7.
4 Alagappan VK,de Boer WI,Misra VK,et al.Angiogenesis and vascular remodeling in chronic airway diseases[J].Cell Biochem Biophys,2013,67(2):219-234.
5 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
6 张牧城,汪正光,程金霞.慢性阻塞性肺疾病和支气管哮喘生理评分对慢性阻塞性肺疾病急性加重期伴呼吸衰竭患者病情评估的价值研究[J].中国危重病急救医学,2010,22(5):275-278.
7 李连彬.有创-无创序贯机械通气治疗慢性阻塞性肺疾病并呼吸衰竭的疗效分析[J].实用心脑肺血管病杂志,2012,20(2):342.
8 李飞,李惠,郭彩霞.慢性阻塞性肺疾病急性呼吸衰竭有创机械通气患者血气分析动态变化规律与预后的关系研究[J].中国全科医学,2013,16(4):1123-1127.
9 Garcia-Rio F,Miravitlles M,Soriano JB,et al.Systemic inflammation in chronic obstructive pulmonary disease:a populationbased study[J].Respir Res,2010,11(1):63.
10 Rosenberg SR,Kalhan R.Biomarkers in chronic obstructive pulmonary disease[J].Transl Res,2012,159(4):228-237.
11 郑晓可.慢性阻塞性肺疾病合并肺动脉高压患者血清C-反应蛋白和内皮素-1水平测定及临床意义研究[J].中国全科医学,2012,15(9):2899.
12 Biljak VR,Pancirov D,Cepelak I,et al.Platelet count,mean platelet volume and smoking status in stable chronic obstructive pulmonary disease[J].Platelets,2011,22(6):466-470.
13 刘玉玲,赵小慧,张克武.降钙素原与超敏C-反应蛋白在慢性阻塞性肺疾病急性加重期中的临床意义[J].中国煤炭工业医学杂志,2012,15(9):1384-1385.
14 Thomsen M,Ingebrigtsen TS,Marott JL,et al.Inflammatory biomarkers and exacerbations in chronic obstructive pulmonary disease[J].JAMA,2013,309(22):2353-2361.
15 Liu SF,Wang CC,Chin CH,et al.High value of combined serum C-reactive protein and BODE score for mortality prediction in patients with stable COPD[J].Arch Bronconeumol,2011,47(9):427-432.
16 Moberg M,Vestbo J,Martinez G,et al.Prognostic value of C-reactive protein,leukocytes,and vitamin D in severe chronic obstructive pulmonary disease[J].Scientific World Journal,2014,2014:140736.
17 聂姗,王浩彦,徐秋芬,等.超敏C反应蛋白增高预示慢性阻塞性肺疾病急性加重的风险增大[J].中国呼吸与危重监护杂志,2011,10(2):116-120.
18 Volpi G,Facchinetti F,Moretto N.Cigarette smoke and α,β-unsaturated aldehydes elicit VEGF release through the p38 MAPK pathway in human airway smooth muscle cells and lung fibroblasts[J].Br J Pharmacol,2011,163(3):649-661.
19 Lee CG,Ma B,Takyar S,et al.Studies of vascular endothelial growth factor in asthma and chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2011,8(6):512-515.
20 张杰,马晋,张颖,等.老年慢性阻塞性肺疾病急性加重期诊断与病情评估中血管内皮因子的应用价值[J].中国全科医学,2013,16(10):3317.
21 王虹,张少卿,毛锐,等.诱导痰细胞因子水平对鉴别慢性阻塞性肺疾病、支气管哮喘及慢性阻塞性肺疾病合并支气管哮喘的价值[J].安徽医科大学学报,2013,48(8):953-956.
22 Braber S,Henricks PA,Nijkamp FP.Inflammatory changes in the airways of mice caused by cigarette smoke exposure are only partially reversed after smoking cessation[J].Respir Res,2010,11(1):99-110.
23 Kratzer A,Salys J,Nold-Petry C,et al.Role of IL-18 in second-hand smoke-induced emphysema[J].Am J Respir Cell Mol Biol,2013,48(6):725-732.
24 Guan XJ,Song L,Han FF,et al.Mesenchymal stem cells protect cigarette smoke-damaged lung and pulmonary function partly via VEGF-VEGF receptors[J].J Cell Biochem,2013,114(2):323-335.
25 Siafakas NM,Antoniou KM,Tzortzaki EG.Role of angiogenesis and vascular remodeling in chronic obstructive pulmonary disease[J].Int J Chron Obstruct Pulmon Dis,2007,2(4):453-462.
26 Asada S,Takahashi T,Isodono K,et al.Downregulation of Dicer expression by serum withdrawal sensitizes human endothelial cells to apoptosis[J].Am J Physiol Heart Circ Physiol,2008,295(6):H2512-2521.
27 郭瑛,李燕芹,刘斌,等.血管内皮功能变化与慢性阻塞性肺疾病的关系[J].上海交通大学学报:医学版,2010,30(9):1152-1155.
28 Duvoix A,Dickens J,Haq I,et al.Blood fibrinogen as a biomarker of chronic obstructive pulmonary disease[J].Thorax,2013,68(7):670-676.
29 Gagnon P,Lemire BB,Dubé A,et al.Preserved function and reduced angiogenesis potential of the quadriceps in patients with mild COPD[J].Respir Res,2014,15(1):4.

