COPD急性加重期纤维蛋白原和D-二聚体水平与预后的关系研究
陈建强
临床上将COPD分为COPD急性加重期(AECOPD)和稳定期,其中AECOPD患者易出现呼吸困难加重、咳嗽和/或痰的性状和量发生改变,严重者可能危及生命[1]。监测COPD病情变化情况对COPD患者预后的判断具有重要意义。近年研究发现,凝血异常及血栓形成能够加速COPD的进展[2],本研究检测了纤维蛋白原(FIB)和D-二聚体水平的变化,探讨其与AECOPD患者预后的关系。
1 资料与方法
1.1 临床资料 选择2012年8月—2013年8月江苏盛泽医院收治的AECOPD患者134例为研究对象,其中男101例,女33例;年龄57~86岁,平均(71.5±2.3)岁。均满足中华医学会呼吸病学会于2007年时制定的COPD诊治指南[3]。排除标准[4]:(1)研究前2周内已服用阿司匹林和华法林等抗凝药物者;(2)合并有心、脑血管疾病者;(3)有肝、肾功能障碍者;(4)血液病者。患者及其家属均对本研究知情同意,并由本院成立的伦理委员会审批通过。
1.2 检测指标与检测方法 对患者给予合理的吸氧、平喘、止咳、祛痰及抗感染等综合治疗。患者入院时收集2 ml股动脉血行血气分析;另采集2 ml静脉血,将血浆分离后测定FIB及D-二聚水平,采用日本Sysmex CA 6000型血凝仪进行检测,相关试剂采用德国Dade behring Marburg GMBH。检测时严格依照说明书进行操作。
1.3 研究方法 依据患者预后分为无呼吸衰竭组(without respiratory failure,WRF组)、呼吸衰竭好转组(respiratory failure improvement,RFI组)、呼吸衰竭死亡组(respiratory failure death,RFD组)。呼吸衰竭诊断标准:(1)有低氧血症〔动脉血氧分压(PaO2)<8.00 kPa〕;(2)伴或不伴CO2潴留〔动脉血二氧化碳分压(PaCO2)>6.67 kPa〕;无呼吸衰竭诊断标准:PaO2≥8.00 kPa,PaCO2≤6.67 kPa;呼吸衰竭好转诊断标准:患者存在呼吸衰竭,但PaO2水平较前升高,PaCO2较前降低;呼吸衰竭死亡诊断标准:患者符合呼吸衰竭诊断,并导致死亡。
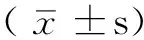
2 结果
2.1 一般资料比较 3组患者的性别构成、年龄、入院时PaO2比较,差异均无统计学意义(P>0.05,见表1)。
表1 3组患者一般资料比较
Table1 Comparison of the general information among three groups of patients
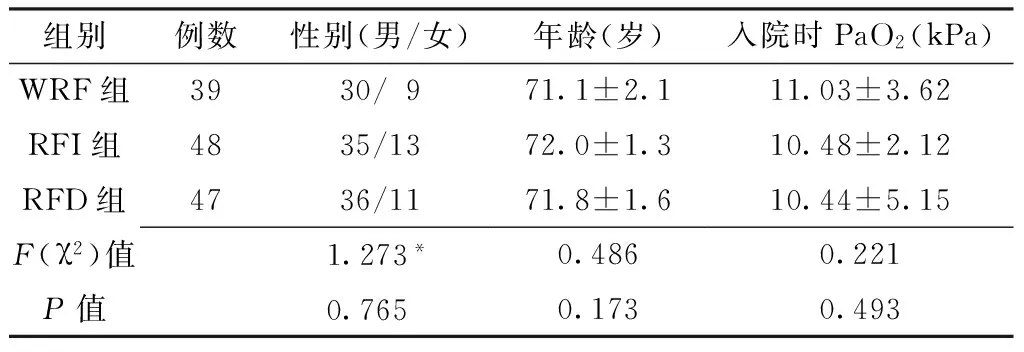
组别例数性别(男/女)年龄(岁)入院时PaO2(kPa)WRF组3930/971.1±2.111.03±3.62RFI组4835/1372.0±1.310.48±2.12RFD组4736/1171.8±1.610.44±5.15F(χ2)值1.273*0.4860.221P值0.765 0.1730.493
注:*为χ2值;PaO2=动脉血氧分压
2.2 3组患者FIB与D-二聚体水平比较 3组FIB与D-二聚体水平间差异均有统计学意义(P<0.05)。其中,RFD组与RFI组FIB、D-二聚体水平高于WRF组,RFD组高于RFI组,差异均有统计学意义(P<0.05,见表2)。
2.3 FIB、D-二聚体水平与AECOPD患者预后的相关性分析 FIB、D-二聚体水平均与AECOPD患者的预后呈正相关(r=0.764,P=0.002;r=0.832,P=0.000)。

Table2 Comparison of levels of FIB and D-dimer among three groups of patients
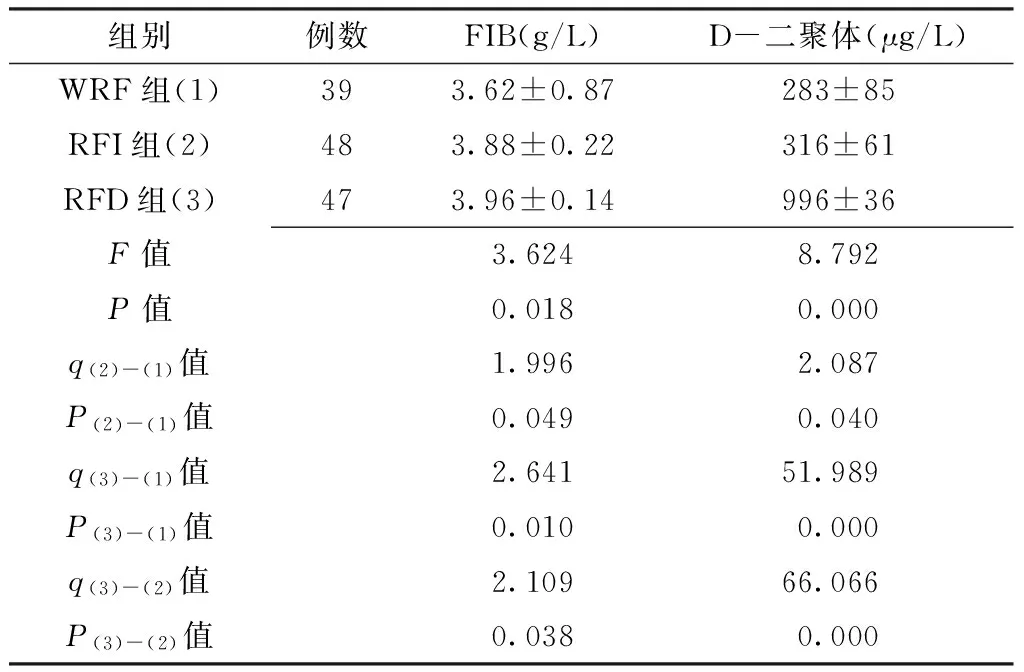
组别例数FIB(g/L)D-二聚体(μg/L)WRF组(1)393.62±0.87283±85RFI组(2)483.88±0.22316±61RFD组(3)473.96±0.14996±36F值3.6248.792P值0.0180.000q(2)-(1)值1.9962.087P(2)-(1)值0.0490.040q(3)-(1)值2.64151.989P(3)-(1)值0.0100.000q(3)-(2)值2.10966.066P(3)-(2)值0.0380.000
注:FIB=纤维蛋白原
3 讨论
COPD是一种气流受限为特征的病症,其发病涉及多类炎性细胞及炎性因子,并呈现进行性发展[5]。伴随疾病进展,机体易缺氧、发生CO2潴留,导致酸碱中毒和电解质紊乱[6];患者血液逐渐呈现高凝状态,进而引发肺动脉高压并形成不良预后。临床上对于AECOPD患者的治疗报道较多,亦有研究检测FIB与D-二聚体水平的变化[7],本研究探讨了FIB、D-二聚体水平与AECOPD患者不良预后的相关性。
FIB是一种凝血系统中心蛋白,D-二聚体为纤维蛋白特异降解产物,有研究表明,二者的异常通常可较为敏感地反映机体凝血及纤溶功能[8],因此本研究将其作为研究指标。本研究发现,3组不同预后患者的一般资料间具有可比性,但RFD组与RFI组的FIB、D-二聚体水平均高于WRF组,且RFD组高于RFI组;进一步行Spearman相关分析发现,FIB和D-二聚体水平均与AECOPD患者预后呈正相关。分析其原因,认为与下列因素有关:(1)COPD患者的肺部在病理上通常表现为肺气肿及小气道炎症,不仅肺泡受到破坏,其间隔组织内的微血管及毛细血管的前微动脉亦受到损伤[9-10]。加之肺血管含大量受体及血管活性类物质,若肺血管的内皮细胞受到激活和损伤,易导致功能性紊乱,从而释放出大量炎性递质,进而激活机体凝血系统,从而促使FIB与D-二聚体水平升高。随着AECOPD患者病情的进一步加重,FIB与D-二聚体水平进一步升高,更易产生不良预后[11]。(2)AECOPD患者血液的高凝状态较为显著,若发生继发性感染以及心肾功能不全,容易引发支肺血管微血栓,进而导致或加重患者的肺动脉高压症状,并加速COPD的疾病进展[12]。国外Petersen[13]报道称,COPD患者经肝素治疗后机体D-二聚体和FIB水平均显著下降,发生不良预后的概率亦明显减少,再次表明Fgb与D-二聚体水平能提示患者的预后。该报道虽未直接提及AECOPD患者的预后情况,但在一定程度上为本文研究结果提供了相应佐证。
综上所述,FIB、D-二聚体水平与AECOPD患者的不良预后相关,临床治疗时可借助FIB与D-二聚体水平辅助判定患者的预后情况。
1 文富强.慢阻肺年度综述2012—2013[J].中华医学信息导报,2013,28(18):14-15.
2 慢性阻塞性肺疾病评估论坛专家组.慢性阻塞性肺疾病病情严重程度评估系统在中国应用的专家共识[J].中华结核和呼吸杂志,2013,36(6):476-478.
3 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南[J].中华结核和呼吸杂志,2007,30(1):8-17.
4 Li G.Prof.Denis E.O′Donnell:personalized treatment of COPD[J].J Thorac Dis, 2014,6(2):177-180.
5 周淑新(译).WONCA研究论文摘要汇编(四十七)——COPD维生素D缺乏高流行性与维生素D结合基因变异相关[J].中国全科医学,2011,14(13):1506.
6 Grouse L,Nonikov D.The global battle to improve patients′ health outcomes:COPD awareness,activities,and progress[J].J Thorac Dis,2014,6(2):161-168.
7 王红阳,郭秀华,戈艳蕾,等.小剂量肝素对老年AECOPD患者疗效及Fbg、Hs-CRP、TNF-α的影响[J].实用医学杂志,2013,29(20):3312-3314.
8 Takahashi T.Annual FEV1changes and numbers of circulating endothelial microparticles in patients with COPD:a prospective study[J].BMJ Open,2014,4(3):4571-4572.
9 王国琴.慢性阻塞性肺病患者人工气道气囊压力监测及护理[J].检验医学与临床,2013,10(3):293-294.
10 Demeyer H.Standardizing the analysis of physical activity in patients with COPD following a pulmonary rehabilitation program[J].Chest,2014,6(10):1965-1968.
11 仇琴,裴新军,潘扬,等.血必净注射液对AECOPD患者凝血状态及肺功能的影响[J].中国急救医学,2013,33(6):543-545.
12 李少丹.AECOPD患者病情严重程度与甲状腺激素水平、D-二聚体、CRP的相关性研究[J].现代预防医学,2012,39(19):5202-5203.
13 Petersen J.Optimal surface segmentation using flow lines to quantify airway abnormalities in chronic obstructive pulmonary disease[J].Med Image Anal,2014,18(3):531-541.

