上海地区小鼠诺瓦克病毒的检测分析及病毒分离
刘芹,魏晓锋,田立立,高诚2,
(1.复旦大学,上海 200032;2.上海市计划生育科学研究所,上海 200032;3.上海实验动物研究中心,上海 201203)
诺瓦克病毒(Norwalk-like viruses,NLV),也称为诺如病毒(Noroviruses,NVs)或小圆结构病毒(Small round structured virus),是一种高致病性、低致病剂量病毒[1],该病毒于1972 年由Kapikian[2]应用免疫电镜(IEM)从患者粪便标本中首次找到致病病毒颗粒,将其命名为诺瓦克病毒(Norwalk viruses,NVs)。
小鼠诺瓦克病毒(MNV)属于杯状病毒科,诺如病毒属,无包膜,呈线性,是单股正链RNA 病毒[3],基因组RNA 长约7.4 kb,3’端有一个多聚A 尾结构,5’端共价连接病毒蛋白VPg[4]。NVs 的RNA 基因组由三个主要的开放阅读框(Open Reading Frames,ORFs)组成[5,6]。据文献报道小鼠诺瓦克病毒(Murine norovirus,MNV)是目前发现的第一个能在细胞内增殖的诺瓦克病毒,它既可以在原代巨噬细胞和树突状细胞内生长,也可以在传代细胞小鼠巨噬细胞系RAW264.7 细胞内生长并产生细胞病变效应(cytopathic effects,CPE)[7],同时,MNV 被认为是实验小鼠内流行最广泛的一种病毒,其在小鼠中的感染率是排在第二位的细小病毒的10 倍[8]。目前国内对MNV 的相关研究较少,2010 年袁文等[9]对广东省内7 个小鼠繁育设施进行了MNV 感染情况的调查,阳性率为37.38%,这是国内首次有关实验小鼠携带MNV 的报道。本实验利用RTPCR 方法及ELISA 方法对上海地区各实验动物生产或使用机构送检小鼠的MNV 感染状况进行调查研究,并对两种检测方法的结果进行分析比较。
1 材料和方法
1.1 动物、MNV 毒株及细胞
动物:上海地区实验动物生产或使用单位委托上海市实验动物质量监督检验站检测的实验小鼠,采样时间为2012 年11 月至2013 年8 月,共13 家检测单位的319 只SPF 级小鼠。MNV 毒株(MNV strain Guangzhou/K162/09/CHN, GenBank 序 列 号:HQ317203.1)由广东省实验动物监测所赠送。实验所用RAW264.7 细胞株购自中国科学院上海细胞库。
1.2 主要试剂
AMV 反转录酶,recombinant RNase inhibitor(RRI),dNTP(2.5/10 mmol/L),Oligo d(T)18Primer,rTaq DNA 聚合酶,DNA 分子量marker 等购自Takara 公司;病毒RNA 提取试剂盒(QIAamp Viral RNA Mini Kit)购自Qiagen 公司;ELISA 试剂盒购自Biotech Trading Partners(SMART-M35,美国);DMEM、FBS、Pen-Strep 购自美国GIBCO 公司。
1.3 RT-PCR 方法
1.3.1 样本采集及处理
小鼠安乐死后,无菌采集约米粒大小的小鼠盲肠内容物,置于去RNA 酶的1.5 mL 离心管内,加入400 μL DEPC 水配置的无菌PBS 溶液,震荡涡旋30 s,4000 g/min 离心20 min,取上清液经0.22 μm的滤膜过滤待用。
1.3.2 RNA 提取
按照QIAamp Viral RNA Mini Kit 试剂盒说明书进行操作,提取所采集盲肠内容物样本总RNA,取预处理样本140 μL,最终得到60 μL 总RNA,测量RNA 浓度,-80℃保存备用。
1.3.3 引物
根据文献[10]报道,由Invitrogen(上海)公司合成,上游引物F:CAGATCACATGCTTCCCAC,下游引物R :AGACCACAAAAGACTCATCAC,引物位于MNV 序列保守区域衣壳蛋白基因ORF2 编码区位置,其扩增产物大小为187 bp(5473-5659nt)。
1.3.4 反转录
在去RNA 酶的0.2 mL 离心管内依次加入如下试剂:模板RNA 4 μL,5 × AMV buffer 4 μL,dNTP(10 mmol/L)2 μL,RRI 0.5 μL,AMV 1μL,Oligo d(T)181μL,DEPC-H2O 补足反应体系至20 μL。混匀后室温放置10 min,42℃水浴1 h,置冰上冷却2 min,得到的反应产物即为cDNA。
1.3.5 PCR
以反转录得到的cDNA 为模板进行PCR 扩增,在一无菌的0.2 mL 离心管内依次加入cDNA 模板4 μL,10 ×PCR buffer(Mg2+free)2 μL,dNTP(2.5 mmol/L)1.6 μL,MgCl21.2 μL,上下游引物F/R(20 μmol/L)各0.4 μL,rTaq DNA 聚合酶0.2 μL,灭菌ddH2O 补足反应体系至20 μL,混匀。95℃预变性5 min,然后94℃变性30 s,60℃退火30 s,72℃延伸30 s,共35 个循环,最后72℃延伸10 min。每次反应均以ddH2O 替代模板cDNA 做阴性对照,以广东MNV 毒株为阳性对照进行RT-PCR 扩增。
1.3.6 凝胶电泳及测序
取PCR 产物在1%琼脂糖凝胶电泳,纯化回收阳性产物,并送上海生工生物工程技术服务有限公司进行序列测定,用NCBI 的BLAST 软件对测序结果进行分析。
1.4 血清学方法
1.4.1 样本处理
无菌条件下采用摘眼球法采集小鼠血液,室温静置2 h,3000 r/min 离心10 min,小心将上层血清吸出分装,-20℃储存备用。
1.4.2 酶联免疫吸附试验
参考相关文献[11],采用美国Biotech Trading Partners 公司的ELISA 试剂盒(SMART-M35),按照试剂盒说明书进行操作:取经RT-PCR 检测小鼠中的180 份冻存血清进行检测,血清样本及试剂盒内的标准液均作50 倍稀释,阴阳性对照不稀释,孵育30 min,洗板,加酶结合物孵育30 min,洗板,加底物显色10 min,加入终止液轻拍混匀,用酶标仪测450 nm光吸收值并分析结果。
1.5 病毒分离
取2 个RT-PCR 检测结果为阳性的样本进行病毒分离。复苏RAW264.7 细胞,用含10%胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素的DMEM 培养液传代培养。待细胞在24 h 内长满培养瓶90%左右时,弃去原来的培养液,并用DMEM 冲洗两次,将粪便样本用PBS 溶液稀释并通过0.22 μm 滤膜过滤,取100 μL 滤液轻轻覆盖在细胞表面,放37℃5% CO2的培养箱内孵育1 h,期间每隔15 min 轻轻晃动培养瓶,防止细胞表面干涸。1 h 后弃去接种病毒液,立即加入含4%胎牛血清的DMEM 维持液并于培养箱内培养,72 h 内观察细胞是否出现CPE。因样本中可能含有其他致细胞病变物质,可将细胞冻融三次后的过滤液继续进行盲传,待细胞能在24~72 h 内出现稳定的CPE 时,将细胞冻融三次后回收病毒并用RT-PCR方法鉴定,保存在-80℃。
1.6 统计学处理
应用SPSS 13.1 版本统计学软件,计数资料比较采用χ2检验,计量资料以±s 表示,比较采用t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 PCR 产物电泳及测序结果
PCR 产物电泳,在凝胶成像系统下观察,阳性样本在187 bp 处显示目的条带,与阳性对照位置一致(图1)。送上海生物工程技术服务有限公司进行测序,PCR 产物大小为187 bp。应用NCBI 的BLAST 软件对测序结果进行分析显示,与GenBank 中登陆的广州株(HQ317203)核酸同源性为99.5%(图2),由此可证实引物扩增的片段为MNV 基因片段,阳性检测结果的小鼠有MNV 感染。GenBank 中登陆的MNV毒株多为欧美国家,也有亚洲的韩国、日本、中国台湾,中国大陆登录株为广州株(HQ317203)。
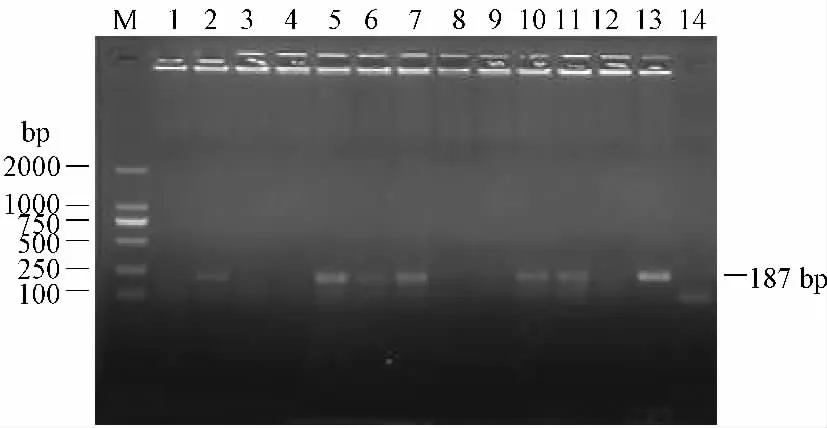
图1 部分样本RT-PCR 电泳结果Note:M:DNA marker DL2000;Lane 1-12:samples;Lane 13:positive control;Lane14:negative controlFig.1 Electrophoresis of RT-PCR products from some samples
2.2 RT-PCR 检测结果
RT-PCR 检测的319 份盲肠内容物样本中95 份为阳性,阳性率为29.78%。13 家送检单位的实验小鼠均有MNV 检出,阳性率最低为11.11%,最高为91.67%,卡方检验分析显示不同送检单位之间的MNV 自然感染率差异有显著性(P<0.05)(表1)。近交系、封闭群、免疫缺陷小鼠和基因工程小鼠均有MNV 感染,不同品系的实验小鼠之间MNV感染状况也不同,卡方检验分析显示不同品系小鼠之间的MNV 自然感染率差异有显著性(P<0.05),其中ICR 小鼠阳性率最高(47.13%),而免疫缺陷小鼠阳性率最低(13.95%)(表2)。
2.3 ELISA 检测结果
ELISA 检测的180 份血清样本中有70 份血清抗体阳性,阳性率为38.89%。11 家送检单位均有抗体阳性检出,阳性率在14.29%到75%之间,卡方检验分析显示不同送检单位之间的MNV 抗体阳性率差异有显著性(P<0.05)(表1)。不同品系小鼠间MNV 抗体阳性率差异有显著性(P<0.05),封闭群ICR 小鼠MNV 抗体阳性率最高(71.05%),免疫缺陷小鼠阳性率最低(25%)(表2)。
2.4 共同检测结果
在同时经过RT-PCR 扩增和ELISA 检测的180只小鼠中,阳性小鼠分别为45 只和70 只,阳性率分别为25%和38.89%,两种方法同为阳性的有34只,阳性率为18.89%。
2.5 病毒分离结果
阳性样本经RAW264.7 细胞盲传至第5 代,接种病毒液的细胞与未接毒的细胞相比,在24 h 内出现CPE,72 h 内CPE 逐渐明显,主要表现为细胞变圆,变大,接触抑制消失,而未接毒的细胞逐渐脱落死亡(图3,见彩插8)。细胞冻融3 次之后,接毒后的细胞培养物经RT-PCR 方法,在187 bp 处出现预期目的条带,测序结果显示与组织样本扩增测序结果一致,而未接毒的对照细胞冻融液无目的条带(图4)。
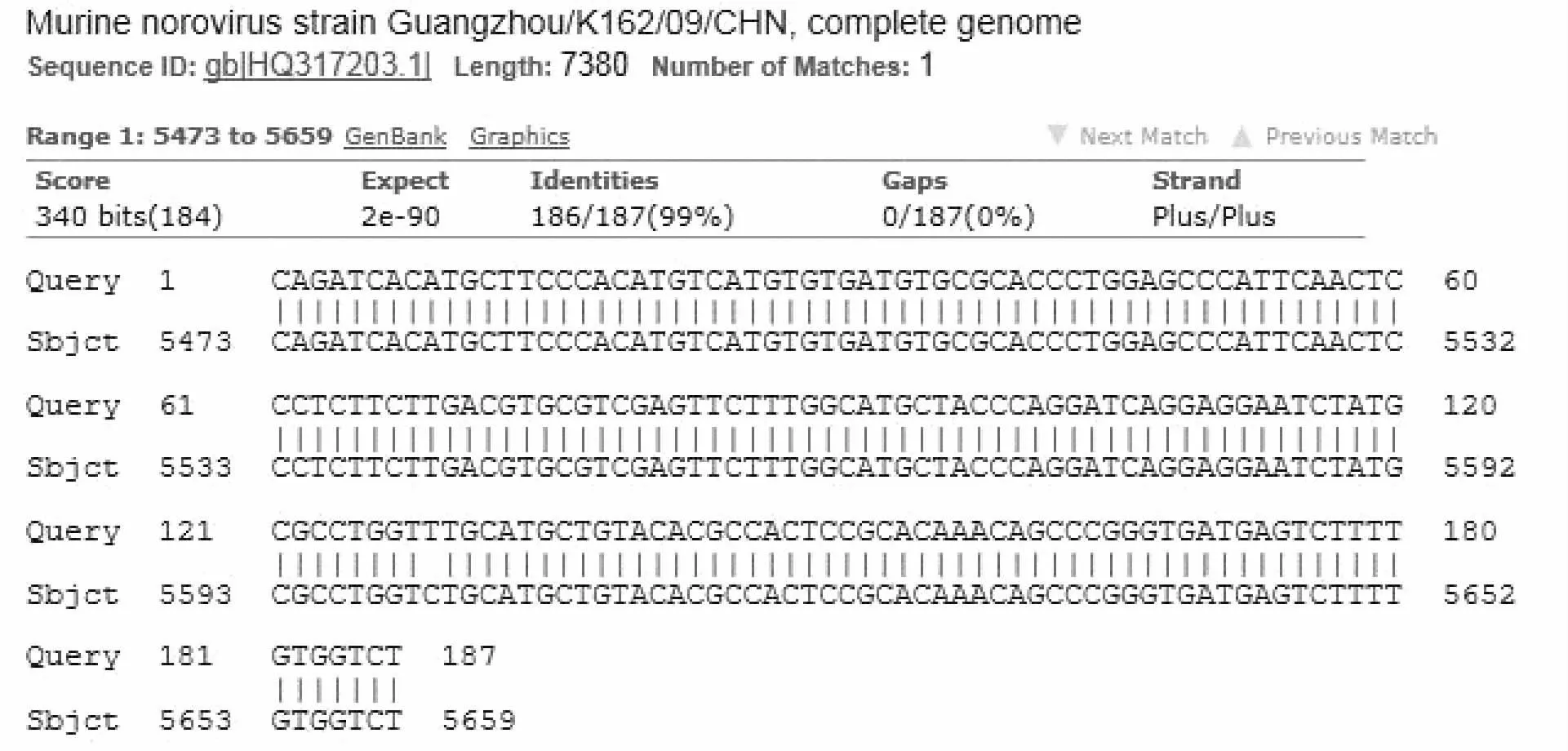
图2 与广州株(HQ317203)的序列对比结果Fig.2 Alignment results of DNA fragments with HQ317203

表1 各送检单位小鼠MNV 的感染情况Tab.1 MNV infection of different tested units

表2 不同品系小鼠MNV 感染情况Tab.2 MNV infection in mice of different strains
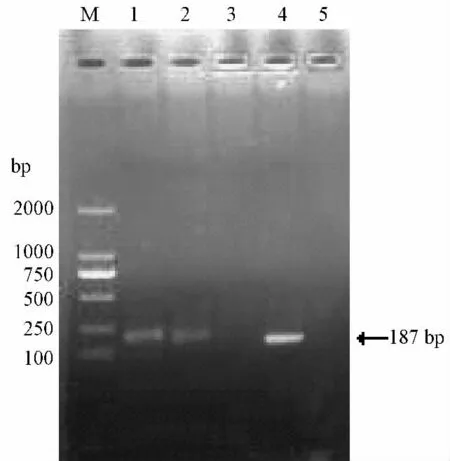
图4 RAW264.7 细胞冻融液RT-PCR 结果Note:M:DNA marker DL2000;Lane 1-2:inoculated with stool filtrate(72 h);Lane 3:un-inoculated with stool filtrate(72 h);Lane 4:positive control;Lane 5:negative control.Fig.4 RT-PCR results of RAW 264.7 cells freezethaw liquid
3 讨论
2003 年,Karst[12]等在信号转导蛋白和转录激活因子(STAT1)以及重组体激活基因2(RAG2)缺陷(RAG/STAT1-/-)小鼠中首次发现并分离得到MNV,并将其命名为MNV-1,MNV-1 可以导致RAG/STAT1-/-小鼠发生致死性感染,病变主要有脑炎、脑膜炎、脑脉管炎、肝炎和肺炎,并且MNV-1在干扰素α、β、γ 受体阴性(IFN-αβγR-/-)小鼠内较野生型小鼠内表现出更强的毒力,而在免疫功能正常小鼠内通常无明显临床症状。自MNV-1 发现之后,各地又陆续分离得到其他多个MNV 毒株,不同的MNV 毒株会导致不同程度的肠道病变及CPE等[13]。
本研究分别采用核酸检测和血清学检测两种方法对上海地区实验动物生产或使用单位送检的SPF小鼠进行了MNV 自然感染状况的调查。结果显示各送检单位小鼠均有MNV 感染,采用RT-PCR 核酸检测的阳性率为29.78%,ELISA 检测的血清抗体阳性率为38.89%,由此可见上海地区实验小鼠普遍存在MNV 的自然感染,检测结果显示不同品系的实验小鼠均有阳性结果检出,这一方面说明感染的普遍性,另一方面也说明MNV 的感染或许与动物饲养环境、饲养密度等相关。MNV 属于RNA 病毒,在自身增殖过程中较易发生突变,如果突变发生在与病毒毒力相关的减毒位点,则容易引起动物的持续性感染[14]。所以应该加强实验动物饲养管理,及时处理发生病变或病原感染的实验动物,保证实验动物的质量。
Hsu[15]建立了一种高通量的新型血清学检测方法——流式荧光微球检测技术,检测小鼠血清中MNV 抗体,密苏里大学的实验动物检测中心从美国和加拿大的研究机构送检的实验小鼠(n =12639)血清样本中,经复用荧光免疫测定(Multiplexed fluorescent immunoassay,MFI)测得血清抗MNV-1 抗体阳性率为22.1%。本实验检测的319 只实验小鼠中,有180 只小鼠既采用RT-PCR 扩增,同时又对血清进行了ELISA 检测,结果显示通过RT-PCR 扩增为阳性的有45 只,通过ELISA 检测为阳性的有70只,两种检测方法均显示为阳性的有34 只。ELISA检出率比RT-PCR 方法稍高,共同检出率比单独检出率略低,出现这种情况可能与以下因素相关:一是与小鼠感染MNV 的时间、感染量和样本种类有关,MNV 属于肠道病毒,RT-PCR 仅检测盲肠内容物中的病毒核酸。Hsu[15]通过人工灌胃的方法造成10只小鼠感染MNV,分别收集0-7d 的粪便,结果发现第1 天时全部呈现阳性,第7 天时仅有两只为阳性。也有研究表明小鼠感染MNV 后8 周仍可在粪便中检测到病毒核酸,感染具有很强的持续性[10,12]。ELISA 法用于检测血清抗体,当小鼠感染MNV 后,体内抗体的形成需要一定时间,Hsu[10]通过人工灌胃法造成10 只小鼠感染MNV,利用MFI法检测小鼠血清中MNV 抗体,结果发现第1 周有两只小鼠处于临界值范围,其余8 只呈阴性;第2~5周有7 只处于临界值或呈阳性。因为两种检测方法不同,所检测的对象不同,所以检出率会出现一定差异。在感染初期,免疫抗体尚未产生时可以采用RT-PCR 检测病毒核酸,感染2 周后可以采用ELISA方法检测血清中的抗体。二是核酸检测与实验操作过程紧密相关,如果粪便样本处理不当或样本中病毒量过少,RT-PCR 方法可能出现假阴性。所以两种方法相结合可以从一定程度上提高检出率。另外需要注意的是,免疫缺陷小鼠亦有MNV 病毒核酸和血清抗体阳性的检出,这或许暗示MNV 感染与机体的免疫系统相关,有待进一步研究MNV 感染的机制。
袁文等[9]对广东省实验小鼠感染MNV 的调查中,近交系、封闭群、免疫缺陷小鼠的阳性率均在60%以上。本实验中检测的实验小鼠各品系也均存在MNV 感染,卡方检验分析MNV 的感染率差异有显著性,两种检测方法结果显示ICR 小鼠感染MNV的阳性率最高,免疫缺陷小鼠的阳性率最低(表2),这可能与免疫缺陷小鼠的饲养环境更加严格有关。
CPE 是病毒在细胞内增殖及其对细胞产生损害的最明显表现,不同病毒作用于不同细胞会产生特异性CPE,组织培养细胞内CPE 的出现,一般可以认为是病毒增殖的确切证据,接种物内的非特异性毒性物质导致的非特异性CPE 在盲传过程中可消失,而病毒可由于其对细胞培养物的适应导致CPE提前出现,病变更明显[16]。本实验RAW264.7 细胞接种阳性盲肠内容物后,经过盲传至第5 代,细胞在24h 内出现CPE,72h 内逐渐明显,与MNV-1 致CPE 表现[17]相似,细胞变圆、变大、接触抑制消失。同时接种病毒液后的细胞培养物经RT-PCR 鉴定得到187bp 的目的条带,未接种病毒的细胞培养物无目的条带,说明成功分离到病毒毒株,但为排除其他肠道病原体的存在,需进一步采用蚀斑纯化方法,挑取单克隆进行病毒纯化。
目前MNV 感染的小鼠对动物实验有何影响尚无定论,但是国外相关实验动物机构如Charles River,Harlan 等已越来越重视对实验小鼠MNV 的监测,并已开发出相应的检测方法。国内一些CRO 公司也要求实验动物检测机构能开展对MNV 的检测。本文通过对上海地区MNV 感染状况的调查,在一定程度上了解了国内MNV 的感染状况。同时本研究建立的检测方法可在实验动物生产单位和使用单位中推广应用,为进一步补充完善实验动物质量控制体系提供技术支持,促进实验动物事业的健康发展。另外,全世界范围内90%以上的非细菌性胃肠炎是由人诺瓦克病毒(Human Norovirus,HuNV)引起的[12],由于HuNV 缺乏有效的细胞培养体系及实验动物模型,无法在体外进行增殖,相关研究受到限制,而MNV 与HuNV 在基因组大小、结构和功能、病毒粒子大小(直径28~35 nm)、形状、浮力密度、致病症状以及在自然界的传播方式(主要通过粪口途径传播)等[18]方面有一定的相似性,MNV 可以作为HuNV 的研究模型,通过对MNV 的研究,有助于开展对HuNV 的研究,可以指导治疗及预防HuNV 引起的胃肠炎,减少由HuNV 感染导致的医疗损失。
(本文图3 见彩插8)。
[1]王大鹏,吴清平,寇晓霞.诺瓦克病毒研究进展[J].微生物学报.2007,47(5):942-946.
[2]Kapikian AZ,Wyatt RG,Dolin R,et al.Visualization by immune electron microscopy of a 27-nm particle associated with acute infectious nonbacterial gastroenteritis[J].J Virol.1972,10(5):1075-1081.
[3]Mayo MA.A summary of taxonomic changes recently approved by ICTV[J].Arch Virol.2002,147(8):1655-1663.
[4]Chaudhry Y,Nayak A,Bordeleau ME,et al.Caliciviruses differ in their functional requirements for eIF4F components[J].J Biol Chem.2006,281(35):25315-25325.
[5]Farkas T,Fey B,Keller G,et al.Molecular detection of murine noroviruses in laboratory and wild mice[J].Vet Microbiol.2012,160(3-4):463-467.
[6]Thackray LB,Wobus CE,Chachu KA,et al.Murine noroviruses comprising a single genogroup exhibit biological diversity despite limited sequence divergence[J].J Virol.2007,81(19):10460-10473.
[7]Courtney Cox,Shengbo Cao,Yuanan Lu.Enhanced detection and study of murine norovirus-1 usinga more efficient microglial cell line[J].Virol J.2009,6:196.
[8]Henderson KS.Murine norovirus,a recently discovered and highly prevalent viral agent of mice[J].Lab Anim.2008,37(7):314-320.
[9]袁文,张钰,刘忠华,等.广东省实验小鼠自然感染鼠诺如病毒的调查[J].中国比较医学杂志.2010,20(2):78-82.
[10]Hsu CC,Riley LK,Wills HM,et al.Persistent infection with and serologic cross-reactivity of three novel murine noroviruses[J].Comp Med.2006,56(4):247-251.
[11]Ohsugi T,Matsuura K,Kawabe S,et al.Natural infection of murine norovirus in conventional and specific pathogen-free laboratory mice[J].Front Microbiol.2013,4(12):1-6.
[12]Karst SM,Wobus CE,Lay M,et al.STAT-1 dependent innate immunity to a Norwalk-like virus[J].Science.2003,299:1575-1578.
[13]Kahan SM,Liu G,Reinhard MK,et al.Comparative murine norovirus studies reveal a lack of correlation between intestinal virus titers and enteric pathology[J].Virology.2011,421(2):202-210.
[14]Bailey D,Thackray LB,Goodfellow IG.A single amino acid substitution in the murine norovirus capsid protein is sufficient for attenuation in vivo[J].J Virol.2008,82(15):7725-7728.
[15]Hsu CC,Wobus CE,Steffen EK,et al.Development of a microsphere-based serologic multiplexed fluorescent immunoassay and a reverse transcriptase PCR assay to detect murine norovirus 1 infection in mice[J].Clin Diagn Lab Immunol.2005,12(10):1145-1151.
[16]殷震,刘景华,于康震,等.动物病毒学[M].第二版.北京:科学出版社.1997.326-327.
[17]Cox C,Cao SB,Lu YA.Enhanced detection and study of murine norovirus-1 using a more efficient microglial cell line[J].Virol J.2009,6:196.
[18]Wobus CE,Thackray LB,Virgin HW 4th.Murine norovirus:a model system to study norovirus biology and pathogenesis[J].J Virol.2006,80(11):5104-5112.

