七十味珍珠丸对局灶性脑缺血大鼠脑组织中SOD、CAT、MDA的影响
甄丽芳罗远带黄福开胡贤达邵 杰尚 颖刘亚丽杜文兵
(1南方医科大学中医药学院,广州,510515;2中国藏学研究中心北京藏医院,北京,100029)
实验研究
七十味珍珠丸对局灶性脑缺血大鼠脑组织中SOD、CAT、MDA的影响
甄丽芳1罗远带2黄福开2胡贤达2邵 杰2尚 颖1刘亚丽1杜文兵1
(1南方医科大学中医药学院,广州,510515;2中国藏学研究中心北京藏医院,北京,100029)
目的:观察七十味珍珠丸对永久性大脑中动脉阻塞(Permanent Middle Cerebral Artery Occlusion,PMCAO)大鼠脑组织中超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)及丙二醛(Maleic dialdehyde,MDA)含量的影响,初步探讨其脑保护作用机制。方法:取SD大鼠用线栓法制备PMCAO模型。观察七十味珍珠丸对大鼠脑梗死体积、脑组织中超SOD、CAT及MDA含量的影响。结果:与PMCAO模型组比较,七十味珍珠丸高、低剂量组大鼠脑梗死体积都有不同程度的减小(P<0.01或P<0.05),脑组织中SOD、CAT含量都有所升高,MDA含量有不同程度下降(P<0.01)。结论:七十味珍珠丸可能通过有效地增强内源性抗氧化酶清除自由基的能力、减轻脑组织脂质过氧化损伤来实现脑保护作用的。
七十味珍珠丸;局灶性脑缺血损伤;氧化应激
缺血性脑损伤病理过程涉及钙超载、氧化应激、炎症级联反应、兴奋性氨基酸毒性、神经元细胞凋亡等,越来越多的研究表明,氧化应激在缺血性脑损伤的病理生理机制中发挥了重要的作用。氧化应激是指机体在遭受各种有害刺激时,机体内自由基的产生和内源性抗氧化系统(超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶、细胞色素氧化酶等)之间的严重失衡,导致氧自由基在机体蓄积而引起细胞毒性反应,从而导致组织损伤的过程[1]。而自由基反应参与了脑缺血后神经细胞的损害过程,是导致迟发性神经元损伤的核心环节。七十味珍珠丸(Rannasangpei)由金、银、珍珠、蓝宝石、玛瑙、麝香、天然牛黄等70味天然动、植、矿物类药经煮、烧、泡等特殊的加工方法精制而成。含有较高的铁、镁、铜、铬、锌以及锰等微量元素[2]。而这些微量元素参与构成了抗氧化系统中许多酶的活性中心,由此猜想七十味珍珠丸应该具有抗氧化损伤的作用。本次实验意在通过观察七十味珍珠丸对于局灶性脑缺血大鼠脑梗死体积、脑组织中SOD、CAT及MDA含量的影响来验证上述猜想是否成立。
1 材料与方法
1.1 实验药品 七十味珍珠丸由北京藏医院提供,批号:20130109。维脑路通片(曲克芦丁片)由亚宝药业集团股份有限公司生产,批号:20130701。
1.2 实验动物 SPF级SD大鼠80只,体重230~250g,雌雄各半,由广州中医药大学实验动物中心提供,合格证号:44005900000285。
1.3 实验试剂 氯化三苯基四氮唑(TTC)购于Sigma公司。大鼠SOD、CAT及MDA的ELISA试剂盒均购自广州拓科达生物科技有限公司。
1.4 主要仪器 Thermo酶标仪、2K-15低温离心机等均由南方医科大学生命科学楼解剖教研室提供。
1.5 实验方法
1.5.1 动物分组、给药剂量及方式 购买230~250 g SD大鼠80只,随机分成两批,每批随机分成5组,即假手术组,PMCAO模型组;七十味低剂量组(166 mg/kg·d);七十味高剂量组(664mg/kg·d);维脑路通组(50 mg/kg·d),每组各8只大鼠。每天灌胃给药1次(按体表面积法),连续14 d,于造模前1 h给药1次,给药剂量及途径同前。假手术组和PMCAO模型组用蒸馏水灌胃。
第一批:进行脑梗死体积检测(脑片TTC染色及脑梗体积百分比计算)。第二批:测定大鼠脑组织中CAT、SOD、MDA的含量。
1.5.2 建立PMCAO模型 采用改良后的Zea Longa模型[3]制作方法。实验动物以10%的水合氯醛(0.32 mL/100 g)腹腔麻醉后,仰卧固定于手术台上,颈部正中切开皮肤及浅筋膜,钝性分离胸锁乳突肌与胸骨舌骨肌,暴露右侧颈总动脉(Common Carotid Artery,CCA),沿着颈总动脉快速分离劲外动脉(External Carotid Artery,ECA)和颈内动脉(Internal Carotid Artery,ICA)。电凝联系ECA与ICA之间的动脉。在右ECA主干的远心端1.5 cm处结扎,提拉ECA残端的结扎线,用微型血管夹在CCA分出ECA处,将ECA临时夹闭,在血管夹与ECA残端之间结扎一道缝合线,不打紧。在ECA远心端死结与近心端活结之间开一小口,用制备好的直径为0.21 mm线栓沿ECA插入,扎紧缝合线,绑住线栓,同时松开微型血管夹。当线栓头端进到ICA与ECA的分叉处。剪断开口上端的ECA,使线栓掉头进入右ICA,避开翼颚动脉(Pterygopalatine Artery,PPA),待线栓标记点(距线栓顶端18 mm处做标记)进到分叉内,有阻挡感时,扎紧线栓,缝合切口。在插线的过程中要注意手感,当遇到阻力时不要用蛮劲插入,当线栓弯曲时要更换,手法要轻柔、迅速。假手术组:只是不插入线栓,其他步骤与上述步骤相同。模型成功标准:手术清醒后Bederson评分[4]≥l分者,认为造模成功,可作为实验纳入患者。
1.6 观测指标
1.6.1 脑组织TTC染色及梗死体积测定 第一批各组大鼠手术24 h后断头处死,在生理盐水冰盘上快速剥离出脑组织,放于-20℃冰箱冻至适当硬度,去除嗅球、小脑和低位脑干,其余以2 mm间隔行连续冠状切片共6片,放入2%氯化三苯基四氮唑(TTC)磷酸盐缓冲液中(pH=7.4)中,37℃水孵育恒温箱内避光孵育30 min后,置于4%多聚甲醛中固定24 h后观察,正常脑组织着玫瑰红色,梗死脑组织呈苍白色。将切片扫描入扫描仪中,保存图像。运行Image Pro Plus 4.5(IPP)图像处理软件,计算脑梗死面积及层面总面积,应用公式:V=(A1+…An)t(V:梗死体积或全脑体积,t:切片厚度,A:各切片梗死面积或总面积)计算出脑梗死体积及全脑体积,用脑梗死体积百分比(脑梗死体积/全脑体积)来表示脑组织坏死程度。
1.6.2 脑组织中SOD、CAT及MDA的测定 第二批各组大鼠手术24 h后断头处死,同时在冰上取脑,取新鲜右侧半脑组织,称重;用吸管吸取预冷的10倍于组织块重量的匀浆介质(冷PBS pH=7.4),加入玻璃匀浆管,眼科小剪剪碎组织块;将剪碎的组织倒入玻璃匀浆管中,放入冰水混合的大烧杯中,超声组织匀浆器制成10%的脑组织匀浆液,将匀浆液以3 000 r/min,离心20 min;取上清液,分装置-20℃保存,按ELISA试剂盒说明书测定CAT、SOD、MDA的含量。
1.7 统计学处理 用SPSS 13.0版统计软件进行统计,数据用均数±标准差(±s)表示,多组间比较用单向方差分析,组间两两比较方差齐时用LSD检验,方差不齐时用Dunntt's T3检验。
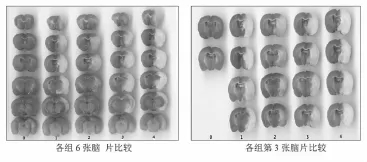
图1 TTC染色情况比较(0:假手术组;1:七十味低剂量组;2:七十味高剂量组;3:维脑路通组;4:PMCAO模型组)
2 结果
2.1 各组脑梗死体积比较(见图1、表1) 假手术组大鼠脑梗死体积测定均为0,即无梗死灶。而PMCAO模型组大鼠右半脑出现较大面积的白色梗死灶(P<0.01)。与PMCAO模型组比较,七十味高、低剂量组和维脑路通组大鼠脑梗死体积都有不同程度的减小(P<0.01或P<0.05)。七十味高剂量组大鼠脑梗死体积显著小于维脑路通组(P<0.01)。而七十味低剂量组大鼠脑梗死体积与维脑路通组相比无统计学意义。
2.2 各组SOD、CAT及MDA含量比较(见表2、表3)
与假手术组比较,PMCAO模型组大鼠脑组织中SOD、CAT含量明显下降,而MDA含量显著升高(P<0.01)。与PMCAO模型组比较,七十味高、低剂量组和维脑路通组大鼠脑组织中SOD、CAT含量都有所升高,MDA含量有不同程度下降(P<0.01),其中以七十味高剂量组更为显著。而七十味低剂量组大鼠脑组织中SOD、CAT及MDA含量与维脑路通组相比差异均无统计学意义。
表1 各组大鼠PMCAO后脑梗死体积的比较(±s)
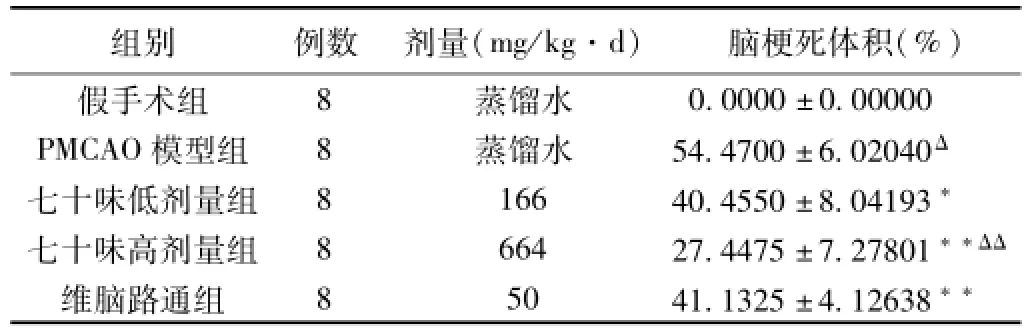
表1 各组大鼠PMCAO后脑梗死体积的比较(±s)
注:与假手术组比较,ΔP<0.01;与模型组比较,*P<0.05,**P<0.01;与维脑路通组比较,ΔΔP<0.01。
组别例数剂量(mg/kg·d)脑梗死体积(%)0.0000±0.00000 PMCAO模型组8蒸馏水54.4700±6.02040Δ七十味低剂量组8 166 40.4550±8.04193*七十味高剂量组8 664 27.4475±7.27801**ΔΔ维脑路通组8 50 41.1325±4.12638假手术组8蒸馏水**
表2 各组大鼠PMCAO后脑组织中SOD、CAT及MDA含量比较(±s)

表2 各组大鼠PMCAO后脑组织中SOD、CAT及MDA含量比较(±s)
注:与假手术组比较,▲▲P<0.01;与模型组比较,**P<0.01;与维脑路通组比较,ΔΔP<0.01。
组别例数剂量(mg/kg·d)SOD(U/L)CAT(U/L)MDA(nmol/L)04102 PMCAO模型组8蒸馏水100.9729±3.47249▲▲1.5306±0.07163▲▲2.8511±0.09876▲▲七十味低剂量组8 166 108.5886±2.65902**1.6415±0.09413**2.6368±0.09393**七十味高剂量组8 664 122.5188±2.94949**ΔΔ1.9168±0.07662**ΔΔ2.3381±0.08349**ΔΔ维脑路通组8 50 109.2335±4.39312**1.6794±0.05102**2.5708±0.08805假手术组8蒸馏水139.1979±3.18762 2.2063±0.06126 1.9515±0. **
3 讨论
大脑中动脉(MCA)是人类脑卒中的好发部位,线栓法造成大脑中动脉闭塞(Middle Cerebral Artery Occlusion,MCAO)模型被认为是局灶性脑缺血的标准动物模型[5]。由于大鼠脑血管解剖结构和功能与人类相近似,种内纯合性好,便于进行统计学处理,所以常被用做脑缺血的实验动物模型。其中永久性大脑中动脉阻塞(Permanent Middle Cerebral Artery Occlusion,PMCAO)模型具有制作简单、成功率高、术后感染少、结果稳定等特点,入选为本次实验患者。
氯化三苯基四氮唑(TTC)是呼吸链中吡啶-核苷结构酶系统的质子受体,与正常组织中的脱氢酶反应而呈红色,而缺血组织因脱氢酶活性下降,不能反应而呈苍白色[6]。本实验观察到假手术组大鼠冠状脑组织切面呈均一深红色,即无梗死灶。而PMCAO模型组脑组织TTC处理后均见到右侧半球自颞顶皮层至基底节区有较大面积的白色梗死灶(P<0.01),未缺血组织呈深红色,说明脑缺血造成了脑组织大面积坏死,坏死区与MCA支配的脑区一致,模型制作成功。与PMCAO模型组比较,七十味高、低剂量组大鼠脑梗死体积都有不同程度的减小(P<0.01或P<0.05),以七十味高剂量组更为显著,说明七十味珍珠丸可减小大鼠PMCAO后脑梗死体积,抑制缺血造成的脑损伤,具有较好的脑保护作用,其中高剂量作用显著。
自由基广泛存在于生物体内,正常情况下参与药物及毒物的降解,杀灭细菌,调节免疫功能,而体内存在许多内源性抗氧化系统(超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶、细胞色素氧化酶等)可以清除自由基,使自由基的生成与清除处于动态平衡,对机体并无有害影响。由于脑缺血时产生大量自由基,远远超过自身内源性抗氧化系统的清除能力,导致大量毒性自由基在组织细胞内堆积,表现为:1)使脂质过氧化,破坏细胞膜;2)使蛋白质变性;3)使DNA突变;4)RNA大分子损伤。
而SOD是体内重要的抗氧化酶,属于金属酶,当体内氧自由基(Oxygen Free Radicals,OFR)生成增多时,可与超氧阴离子反应生成过氧化氢,再由过氧化氢酶和谷胱甘肽过氧化酶转变为水,从而清除OFR,保护细胞免受损伤[7]。CAT是一种酶类清除剂,是以铁卟啉为辅基的结合酶。它可促使自由基H2O2分解为分子氧和水,清除体内的H2O2,从而使细胞免于遭受H2O2的毒害[8],是生物防御体系的关键酶之一。MDA是机体脂质过氧化反应的最终产物,其含量可以反映组织中自由基的含量和组织细胞受到自由基攻击即脂质过氧化反应的程度[9]。
与假手术组比较,PMCAO模型组大鼠脑组织中SOD、CAT含量明显下降,而MDA含量显著升高(P<0.01),说明脑缺血造成了自由基的堆积,引起脑组织脂质过氧化反应加强,消耗了过多的内源性抗氧化酶,氧化-抗氧化平衡被打破,机体抗自由基能力下降,脑组织损伤加重。与PMCAO模型组比较,七十味高、低剂量组大鼠脑组织中SOD、CAT含量都有所升高,MDA含量有不同程度下降(P<0.01),其中以七十味高剂量组更为显著;再加之,七十味珍珠丸所含的铁、镁、铜、铬、锌以及锰等微量元素参与构成了抗氧化系统中多种酶的活性中心(其中锌、铜作为Cu/Zn-SOD的辅基,在其合成与调节方面发挥重要作用;锰参与Mn-SOD的构成,在线粒体中发挥清除超氧阴离子自由基的作用;Fe3+为CAT的辅基,CAT催化过氧化氢转变为水和氧气[10]),从而说明七十味珍珠丸能够增强内源性抗氧化酶的活性,清除多余自由基,抑制脂质过氧化反应造成的脑损伤,以高剂量作用显著。
上述实验结果提示,七十味珍珠丸可减小局灶性脑缺血大鼠的脑梗死体积,具有较好的脑保护作用;其机制可能与其增强内源性抗氧化酶的活性,提高机体的抗氧化能力,减轻脑组织脂质过氧化损伤有关。
[1]王译晗,张霞,张婷慧,等.转基因鼠在脑缺血氧化应激研究中的应用[J].中国比较医学杂志,2012,22(3):45-49.
[2]吴启勋,冀兰,库进良,等.抗缺氧藏药中微量及宏量元素的测定[J].光谱学与光谱分析,2008,28(8):1938-1941.
[3]Ding Y,Yao B,Zhou Y,et al.Pre-reperfusion flushing of ischemic territory:A therapeutic study in which histological and behavioral assessments were used to measure ischemia-reperfusion injury in rats with stroke.J Neurosurg,2002,96:310-319.
[4]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination. Stroke,1986,17(3):472-476.
[5]康涛,张洪.经颈总动脉和经颈外动脉制作大鼠MCAO模型的比较[J].中华脑血管病杂志,2013,7(3):142-152.
[6]吴文娟,王成达,于向荣.大鼠局灶性脑缺血再灌注TTC染色与M对弥散加权成像的相关性研究[J].中华神经医学杂志,2013,12(6):561-564.
[7]马东明,卢斌,姜希娟,等.银杏叶提取物对高胆固醇家兔模型过氧化损伤的影响[J].时珍国医国药,2012,23(3):585-586.
[8]钟亮,张睿,纪晓军,等.胡黄连苷Ⅱ对大鼠脑缺血损伤后H2O2含量和CAT活性的影响[J].中国医药科学,2013,3(9):20-22.
[9]魏丽丽,陈虹,姜勇,等.松果菊苷对局灶性脑缺血大鼠脂质过氧化损伤的影响[J].中国中医药信息杂志,2011,18(1):36-37.
[10]曹惠芝.运动员铁营养与抗氧化能力[D].南京:江苏大学,2006.
(2013-12-10收稿 责任编辑:王明)
Effect of Rannasangpei on the SOD,CAT and M DA in Brain Tissues of Rats with Local Cerebral Ischemia
Zhen Lifang1,Luo Yuandai1,Huang Fukai2,Hu Xianda2,Shao Jie2,Shang Ying1,Liu Yali1,Du Wenbing1
(1 College of Traditional Chinese Medicine,Southern Medical University,Guangzhou 510515,China;2 Beijing Tibetan Hospital,China Tibetology Research Center,Beijing 100029,China)
Objective:To explore the effect of Rannasangpei on the SOD,CAT and MDA in the brain tissues of rats with permanent middle cerebral artery occlusion(PMCAO),and to study its cerebral protective mechanism.Methods:SD rats were made into local cerebral ischemic models with the method of permanent middle artery occlusion.The effects of Rannasangpei on the volume of cerebral infarction in rats and the changes of SOD,CAT and MDA contents in their brain tissues were observed.Results:The infarct volumes of rats in two Rannasangpei intervention groups were obviously decreased compared with the PMCAO model group(P<0.01 or P<0.05);compared with the PMCAO model group,the SOD and CAT contents in brain tissues of the rats in the high and low dose Rannasangpei groups were all significantly increased,the MDA contents were decreased in different degrees(P<0.01).Conclusion:Rannasangpei has significant protective effect on cerebral ischemic injury in rats,and its protective mechanism may come from effectively enhancing ability of the endogenous antioxidant enzyme to scavenge the free radicals,and relieving lipid peroxidation damage of brain tissue.
Rannasangpei;Local ischemic injury;Oxidative stress
R285.5
A
10.3969/j.issn.1673-7202.2014.03.029
国家重大财政专项“藏医心脑血管病临床研究与药物研发”(编号:1981020421)
甄丽芳(1987.2—),女,研究生,研究方向:中西医结合脑病,E-mail:530539114@qq.com
黄福开(1958.2—),男,研究生,副主任医师,院长,研究生导师,研究方向:中西医结合心脑血管病;E-mail:530539114@qq.com

