大鼠注意定势转移任务模型的深入研究:种系和检测程序的影响*
原三娜 罗晓敏 张 帆 邵 枫 王玮文
(1中国科学院心理健康重点实验室,中国科学院心理研究所,北京 100101)(2中国科学院大学,北京 100039) (3北京大学心理系,北京 100871)
1 前言
注意定势转移任务(Attentional set-shifting,AST)是一种拟人类威斯康辛卡片分类测试(Wisconsin card sorting test,WSCT)模型,可用于检测啮齿类动物前额叶介导的认知灵活性(Brown &Bowman,2002)。认知灵活性是指个体能够觉察环境变化,并能根据环境变化的要求调整行动策略以完成目的行为的过程,是个体适应动态环境变化的认知基础。多种精神疾病,如抑郁症(Lyche,Jonassen,Stiles,Ulleberg,Landrø,2011),精神分裂症(Hilti et al.,2009; Millan et al.,2012)患者都伴随不同程度和不同特征的认知灵活性损伤。固着性认知和情感偏误还被认为是造成抑郁症和焦虑症的重要病因学因素之一(Beck,2008)。近年来,AST模型越来越多的应用于认知灵活性及其损害所导致的精神疾病认知障碍的神经机理研究(Bissonette &Powell,2012; Bondi,Jett,& Morilak,2010; Durstewitz,Vittoz,Floresco,& Seamans,2010; Floresco,Block,& Tse,2008; Millan et al.,2012)。目前不同AST研究采用的检测程序和实验动物种系存在差异,研究结果也不一致(Birrell & Brown,2000; Bissonette &Powell,2012; Cain,Wasserman,Waterhouse,&McGaughy,2011; Colacicco,Welzl,Lipp,& Wurbel,2002)。上述因素对检测结果的影响以及影响程度目前并不清楚,开展系统研究有利于比较和整合已有研究发现,并为模型的合理选择提供行为学依据。
AST测试的基本过程是训练动物在不同维度(如嗅觉、视觉、触觉等)的几对刺激中辨别与奖赏物相关联的正性刺激线索,并建立与之相应的策略寻找奖赏物。同时随着奖赏物和线索关系的转变调整已习得的策略或建立新的策略(Birrell & Brown,2000)。经典的AST检测模型采用七阶段鉴别学习模式,根据检测程序依次包括:简单辨别(Simple Discrimination,SD)、复杂辨别(Compound Discrimination,CD)、第一次逆反学习(Reversal Learning 1,RL1)、内维度转换(Intra-Dimensional shift,IDS)、第二次逆反学习(Reversal Learning 2,RL2)、外维度转换(Extra-Dimensional shift,EDS)和第三次逆反学习(Reversal Learning 3,RL3)七个阶段(Brown &Bowman,2002)。由于每个动物的AST测试过程较长(2~3小时/只)且只能人工实时观察和记录动物的行为表现,因此研究者在整个实验过程中都必须保持高度注意力,测试具有相当的难度。随后,Fox(Fox,Barense,& Baxter,2003)和Liston (Liston et al.,2006)提出了简化的五阶段 AST检测模式,检测程序依次包括:SD、CD、IDS、RL和EDS五个阶段。可见,这两种 AST检测程序都包含基本关联学习能力(规则形成和分类能力,如SD和CD),已习得问题解决策略的调整和转换能力(如IDS和RL),以及随着环境关系变化抑制旧策略和跨维度建立新的应对策略的能力(如 EDS)五种认知反应,但不同检测阶段间的顺序关系和逆反学习次数存在差异。考虑到在AST中除了SD,其它认知成分都包含前期“经验”的影响及调整过程,可以推测前期“经验”参数,例如经验类型和经历次数,可能影响个体随后的适应性调节过程。目前使用的七阶段和五阶段AST检测程序存在上述差异,它们是否会对动物认知表现产生影响及其影响程度目前还不清楚。一般来说,AST测试不同阶段的认知反应存在一定的结构关系,即简单和低水平学习任务需要的达标训练次数和错误率通常会低于复杂和高水平学习任务。以五阶段AST为例,动物在AST高难度任务阶段(如RL和EDS)的达标次数和错误率通常高于低难度任务阶段(如SD、CD和IDS)。这种差异是重要的实验证据,表明前期任务使得动物建立了注意定势,从而导致随后的认知转换困难。本研究将通过比较在两种检测程序中上述认知反应间结构关系的一致性评价不同检测过程对认知表现的影响及影响程度。
在AST中RL和EDS是评价认知灵活性的核心指标(Lapiz-Bluhm et al.,2008)。人类、灵长目和啮齿类动物的比较研究发现,认知灵活性依赖于前额叶及其相关神经通路的功能(Robbins & Arnsten,2009)。前额叶的结构和功能受遗传因素和环境因素的影响。例如人类WSCT中的错误反应次数和错误率(反映认知固着性的主要指标)具有 37%~46%中等程度的遗传基础(Anokhin,Heath,& Ralano,2003)。药物、应激或脑区损毁等不同处置差异性影响啮齿类动物 AST各阶段的认知表现 (Bondi,Rodriguez,Gould,Frazer& Morilak,2008; Chen,Baxter,& Rodefer,2004; McAlonan & Brown,2003)。目前啮齿类动物研究绝大多数采用SD (Bondi et al.,2008)和Hooded Lister (Allison & Shoaib,2013; Tait,Marston,Shahid,& Brown,2009)大鼠,也有采用Long Evans (Cain et al.,2011; Chen et al.,2004;Newman & McGaughy,2011)或Wistar-Kyoto (WKY)(Lapiz-Bluhm et al.,2008)大鼠作为实验动物。由于研究采用的实验程序也不一致,种系差异是否影响大鼠AST结果目前尚不清楚。SD和Wistar种系大鼠是目前最广泛使用的实验动物。已知这两类大鼠在某些行为和认知功能方面存在差异。例如Wistar大鼠对于放置在测试箱中的新颖物体的探索行为多于SD大鼠(Andrews,Jansen,Linders,Princen,&Broekkamp,1995)。在Morris水迷宫测试中,SD和Wistar大鼠海马依赖的空间学习能力也存在差异(Van der Borght,Wallinga,Luiten,Eggen,Van der Zee,2005)。本研究将比较它们在前额叶介导的认知灵活性方面是否存在差异。
总的来说,注意定势转移任务特异性检测前额叶及其相关神经通路功能,是研究认知灵活性及其障碍神经基础的重要模型。本研究首次系统比较了大鼠种系和检测程序差异对注意定势任务的影响,为相关研究实验动物和实验程序的选择提供依据。
2 材料和方法
2.1 动物
成年雄性 Wistar和 SD 大鼠(2~3月龄,体重200~250g)购自军事医学科学院实验动物中心。所有动物采用不锈钢隔栅笼单笼饲养,保持环境温度22±1°C,湿度 50±5%,12/12h 昼夜周期(7:00 a.m.开始照明)。实验前大鼠适应环境7天,每天接受2~3 min抚摸以避免操作性应激。实验期间除了AST测试外动物自由摄食饮水。实验程序获得中国科学院心理研究所伦理审查委员会批准,并符合国家动物管理和使用规则。

表1 七阶段AST 测试程序
2.2 实验一:七阶段AST检测方法
七阶段 AST检测装置和方法与我们以往的研究类似(王琼,罗晓敏,邵枫,王玮文,2012)。长方形的测试箱由不透明的白色有机玻璃制成(长×宽×高为 70 cm × 40 cm × 35 cm)。白色有机玻璃分隔板将测试箱的 1/3封闭,作为起始区,另一部分为测试区。隔板可上下垂直拉起。测试箱另一端用透明有机玻璃隔板将测试区后1/3区域平分为两个区域,每个区域内均置有可固定陶土罐的底座。每次任务前大鼠处于起始区,拉起隔板使大鼠进入测试区寻找陶土罐(高6 cm; 直径7 cm)中的奖赏物(蜂蜜脆果圈,家乐氏公司,美国)。陶土罐中装有填充物。奖赏物埋在填充物表面下2 cm。
实验一采用成年雄性Wistar大鼠(n
= 13)和SD大鼠(n
= 14)。经1周适应期后,进行AST行为测定。从测试前 7天开始限制动物摄食(10~15g/天),将体重逐步降低至限食前体重的 80%~85%左右,自由饮水。从限食第5 天开始,每只大鼠均进行如下3个阶段测试。测试在单独的房间内进行。每次实验前提前1 h将大鼠放入测试房中进行适应。第一天为适应期
:首先将陶土罐放入饲养笼,训练动物从装满垫料填充物的陶土罐中挖掘食物,直至动物连续3次在5 min内找到掩埋的食物。随后将大鼠移入 AST测试装置中,使其适应测试环境并从检测区两侧放置的陶土罐中挖掘奖赏物,直至动物连续3次每次在5 min内找到掩埋的食物。第二天为训练期:
大鼠在检测箱中分别进行单一气味/介质简单辨别学习。气味辨别任务使用柠檬和紫檀两种气味,填充物辨别任务选择吹塑纸片和牛皮纸片两种填充物。选择其中一种气味/填充物作为正性线索与奖赏物相关联,即始终将奖赏物放在正性线索标记的陶土罐中,每次测试陶土罐的位置随机放置在测试区的左侧或右侧。正确反应为大鼠只挖掘正性线索标记的陶土罐获得奖赏物且不挖掘负性线索标记的陶土罐。以连续6次正确反应作为完成训练标准。第三天为测试期:
包含7个连续的,难度不断增加的任务阶段:简单辨别(Simple Discrimination,SD),复杂辨别(Compound Discrimination,CD),第一次逆反学习(Reversal learning 1,RL1),内维度转换(Intra-Dimensional shifting,IDS),第二次逆反学习(Reversal learning 2,RL2),外维度转换(Extra-Dimensional shifting,EDS)和第三次逆反学习(Reversal learning 3,RL3)。各阶段任务依次进行。每一阶段直到动物达到连续6次正确反应的标准,然后转至下一阶段任务。每个阶段所记录的指标为:达标训练次数、错误率(错误反应次数与达标训练次数之比)和潜伏期(每次测试时拉起隔板大鼠进入测试区到出现挖掘行为的时间)。整个测试程序如表1示例。第一阶段为SD阶段,两个陶土罐分别以丁香和肉豆蔻气味标记,以垫料为填充物。其中一种气味(如丁香)作为正性线索,奖赏物始终放在此陶土罐中。大鼠学习根据正性线索寻找奖赏物直到达到连续6次正确反应的标准。第二阶段为CD阶段,引入非相关维度线索(两种新的填充物)并与两种气味的陶土罐随机配对呈现,但其正性线索(气味)与SD任务相同。第三阶段为 RL1阶段,使用与 CD中相同的气味和填充物,气味仍为相关维度,但先前的正性气味线索变为负性线索,而先前的负性气味线索变为正性线索; 第四阶段为IDS阶段,气味仍旧为相关刺激维度,填充物为非相关刺激维度,但此任务中同时更换两种新的气味(肉桂和迷迭香)及两种新的填充物(木珠和塑料珠)。以其中一种气味(如迷迭香)作为正性线索,其他与CD任务相同。第五阶段为RL2阶段,与RL1任务类似,原来在IDS任务中为正性线索的气味此阶段换为负性线索,原来的负性线索换为正性线索。第六阶段为 EDS阶段,更换新的填充物(白纸条和褶皱纸条)及气味(香茅和百里香)。同时此任务中填充物由不相关刺激维度变为相关刺激维度,其中一种填充物(如褶皱纸条)为正性线索,而气味变为非相关刺激维度。第七阶段为 RL3阶段,与RL1和RL2 类似,只是EDS任务中正性线索和负性线索互换。为了避免位置和线索偏好,在测试过程中随机选择相关维度的配对刺激物中的一个作为正性线索。同时每次任务中陶土罐的位置随机放置在测试区的左侧或右侧。
2.3 实验二:五阶段AST检测方法
五阶段 AST检测装置同实验一,检测方法参考(Fox et al.,2003)和 Lison (Liston et al.,2006)的研究,由实验一的程序简化而成(如表 2示例)。五阶段与七阶段 AST程序的主要差别在于测试过程不包含RL1和RL3阶段,仅包含五个连续的,难度不断增加的任务阶段,即SD,CD,IDS,RL和EDS。实验二采用成年雄性Wistar大鼠(n
= 7)和SD大鼠(n
= 9),实验过程与实验一相同,以进一步比较两种 AST检测程序结构效度的一致性,以及认知功能种系差异的稳定性。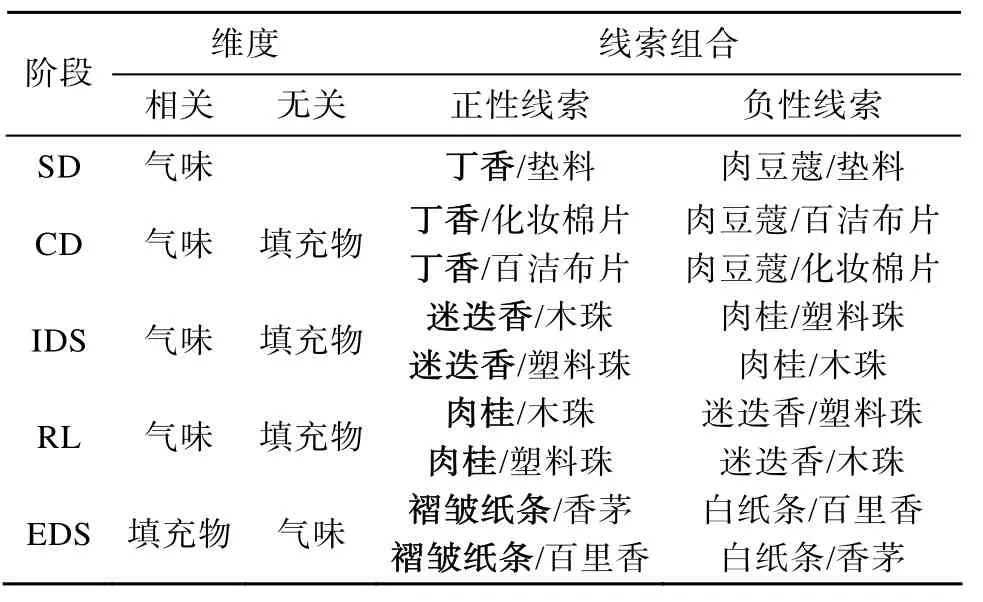
表2 五阶段AST测试程序
2.4 统计分析
所有数据均以均数±标准误表示。统计分析应用SPSS 13.0软件完成。AST测试中各阶段达标训练次数、错误率及潜伏期指标均采用两因素(种系×任务阶段)重复测量方差分析,LSD事后检验分析组间差异。p
< 0.05为统计学有显著差异。3 结果
3.1 七阶段AST认知表现的结构效度和种系差异
3.1.1 达标训练次数
两个种系大鼠在测试不同阶段达标训练次数的结果如图 1所示。两因素(种系×测试任务阶段)重复测量方差分析显示存在显著的种系主效应(F
(1,25) = 8.66p
= 0.007)和测试任务阶段主效应(F
(6,182) = 12.22p <
0.001),交互作用(F(6,175) =0.58p
= 0.745)不显著。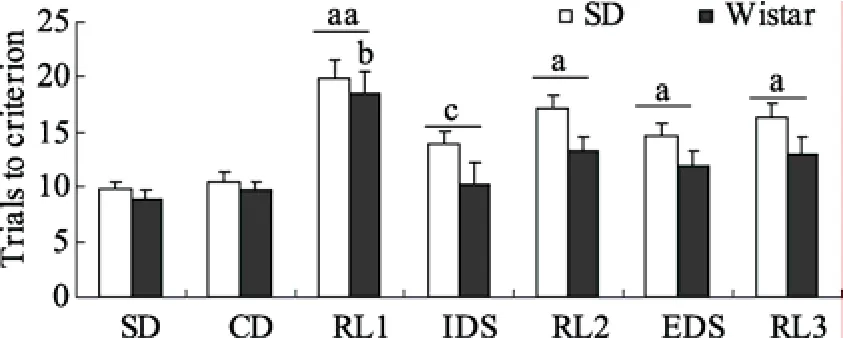
图1 Wistar和SD大鼠在七阶段AST各任务阶段的达标训练次数(均值±标准误)
达标训练次数种系主效应分析显示 Wistar大鼠的整体认知表现优于SD大鼠。事后检验进一步表明种系差异主要来自于 RL2和 RL3阶段,在这两个任务阶段Wistar大鼠的达标训练次数与SD大鼠相比有明显的降低趋势(RL2:F
(1,25) = 4.12p
=0.053; RL3:F
(1,25) = 3.87p
= 0.06)。单因素方差分析显示两个种系大鼠各任务阶段达标训练次数存在显著差异(SD:F
(6,91) = 5.90p
<0.001; Wistar:F
(6,84) = 8.19p
< 0.001)。LSD 事后检验发现Wistar和SD大鼠在RL1,RL2,EDS和RL3阶段的达标训练次数与相应的SD和CD阶段相比明显增加(p
值均小于0.05),以及在RL1阶段的达标训练次数也明显高于IDS阶段(p
< 0.05)。此外,Wistar大鼠的RL2和RL3阶段的达标训练次数明显低于RL1阶段(p
< 0.05)。3.1.2 错误率
两个种系大鼠在测试各任务阶段的错误率结果如图2所示。两因素(种系×测试任务阶段)重复测量方差分析显示有显著的种系主效应(F
(1,25) =12.85,p
= 0.001)和测试任务阶段主效应(F
(6,182) =19.59,p
< 0.001),交互作用不显著,F
(6,175) = 0.37,p
= 0.905。错误率种系主效应分析显示 Wistar大鼠的认知表现优于SD大鼠。事后检验进一步表明认知功能种系差异主要来自于 RL3阶段,在此任务阶段Wistar大鼠的错误率明显低于SD大鼠(F
(1,25) = 7.30,p
= 0.012)。单因素方差分析显示两个种系大鼠各任务阶段的错误率存在显著差异(SD:F
(6,91) = 9.18,p
<0.001; Wistar:F
(6,84) = 10.49,p
< 0.001)。事后检验发现Wistar和SD大鼠在RL1,RL2,EDS和RL3阶段的错误率与相应SD,CD和IDS阶段相比明显增加(p
值均小于 0.05)。此外,两个种系大鼠 RL2阶段以及Wistar大鼠RL3阶段的错误率明显低于相应的RL1阶段(p
< 0.05)。
图2 Wistar和SD大鼠在七阶段AST各任务阶段的错误率(均值±标准误)
3.1.3 潜伏期
两个种系大鼠在测试不同阶段潜伏期的结果如图3所示。两因素(种系×测试任务阶段)重复测量方差分析显示种系和测试任务阶段均存在显著的种系主效应(F
(1,25) = 15.10,p
< 0.001)和测试任务阶段主效应(F
(6,182) = 6.97,p
= 0.002),但交互作用不显著,F
(6,175) = 2.5,p
= 0.093。
图3 SD和Wistar大鼠在七阶段AST各任务阶段的潜伏期(均值±标准误)
潜伏期种系主效应分析显示 Wistar大鼠的潜伏期明显高于SD大鼠。事后检验进一步发现上述差异主要来自于SD阶段,在此任务阶段Wistar大鼠的潜伏期明显高于SD大鼠(F
(1,25) = 15.05p
=0.001)。同时在CD,RL2和RL3阶段Wistar大鼠的潜伏期与 SD大鼠相比也有明显增加的趋势(CD:F
(1,25) = 3.73,p
= 0.065; RL2:F
(1,25) = 3.76,p
=0.064; RL3:F
(1,25) = 3.88,p
= 0.06)。单因素方差分析显示Wistar而非SD种系大鼠各任务阶段潜伏期有显著差异(SD:F
(6,91) = 1.07,p
= 0.107; Wistar:F
(6,84) = 2.29,p
= 0.043)。LSD事后检验发现Wistar大鼠SD阶段的潜伏期明显高于RL1,RL2和EDS阶段(p
< 0.05)。3.2 五阶段AST认知表现的结构效度和种系差异
3.2.1 达标训练次数
两个种系大鼠在测试不同阶段达标训练次数的结果如图 4所示。两因素(种系×测试任务阶段)重复测量方差分析显示存在显著的种系主效应(F
(1,14) = 4.52,p
= 0.041)和测试任务阶段主效应(F
(4,75) = 12.37,p <
0.001),但交互作用不显著,F
(4,70) = 3.44,p
= 0.085。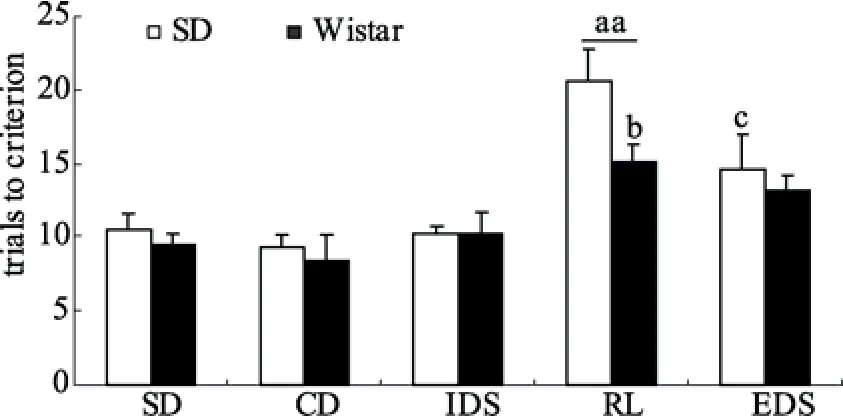
图4 SD和Wistar 大鼠在五阶段AST各阶段的达标训练次数(均值±标准误)
达标训练次数种系主效应分析显示 Wistar大鼠的认知表现优于SD大鼠。进一步事后检验发现种系差异主要来自于RL阶段,在此任务阶段Wistar大鼠的达标训练次数明显低于SD大鼠,F
(1,14) =8.19,p
= 0.013。单因素方差分析显示两个种系大鼠各任务阶段达标训练次数有显著差异(SD:F
(4,40) = 11.13,p
<0.001); Wistar: (F
(4,30) = 4.51,p
= 0.036)。事后检验发现两个种系大鼠RL阶段达标训练次数与相应的SD,CD和IDS阶段相比明显增加(Wistar:p
<0.05; SD:p
< 0.01)。此外,SD大鼠EDS阶段的达标训练次数明显高于CD阶段 (p
< 0.05)。3.2.2 错误率
两个种系大鼠在五阶段 AST不同任务阶段的错误率结果如图5所示。两因素(种系×测试任务阶段)重复测量方差分析显示存在显著的种系主效应(F
(1,14) = 5.07,p
= 0.042)和测试任务阶段主效应(F
(4,75) = 5.39,p =
0.001),交互作用不显著,F
(4,70) = 1.57,p
= 0.195。
图5 SD和Wistar 大鼠在五阶段AST各阶段的错误率(均值±标准误)
错误率种系主效应分析显示 Wistar大鼠的认知表现优于SD大鼠。进一步事后检验发现种系差异主要来自于RL阶段,在此任务阶段Wistar大鼠的错误率明显低于SD大鼠,F
(1,14) = 5.73,p
= 0.035。单因素方差分析显示两个种系大鼠各任务阶段的错误率有显著差异(SD:F
(4,40) = 5.29,p
=0.002;F
(4,30) = 3.46,p
= 0.034)。事后检验发现两个种系大鼠在 RL阶段的错误率与相应 SD和 CD阶段相比明显增加(p
< 0.05),同时EDS阶段的错误率也明显高于相应SD阶段(p
< 0.05)。此外,SD大鼠RL阶段的错误率明显高于相应的IDS阶段(p
<0.05)。3.2.3 潜伏期
两个种系大鼠在测试不同阶段潜伏期的结果如图6所示。两因素(种系×测试任务阶段)重复测量方差分析显示种系主效应不显著,F
(1,14) = 2.955,p
= 0.108; 测试任务阶段主效应显著,F
(4,75) =4.951,p
= 0.002; 交互作用显著,F
(4,70) = 3.687,p
=0.01。进一步分析显示在SD阶段Wistar大鼠的潜伏期明显高于SD大鼠,F
(1,25) = 5.58p
= 0.033。同时在CD阶段Wistar大鼠的潜伏期与SD大鼠相比也有增加的趋势(CD:F
(1,25) = 3.68,p
= 0.076)。单因素方差分析显示Wistar而非SD种系大鼠各任务阶段潜伏期有显著差异(SD:F
(6,91) = 1.495,p
= 0.225; Wistar:F
(6,84) = 3.629,p
= 0.014)。LSD事后检验发现Wistar大鼠SD阶段的潜伏期明显高于CD (p
< 0.05),IDS (p
< 0.01),RL (p
< 0.01)和EDS (p
< 0.01)阶段。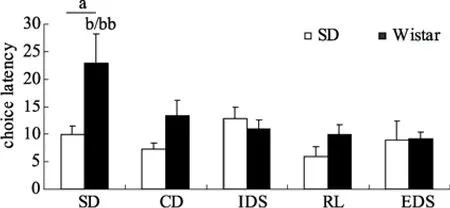
图6 SD和Wistar大鼠在五阶段AST各任务阶段的潜伏期(均值±标准误)
4 讨论
本研究考察了实验动物种系和检测程序差异对 AST认知表现及不同认知成分间反应模式的影响。结果表明大鼠的前额叶认知转换能力存在种系差异,主要表现为在两种 AST检测程序中 Wistar大鼠的整体认知表现优于 SD大鼠,尤其在逆反学习阶段的达标训练次数或错误率显著低于SD大鼠,表现出更高的策略转换灵活性; 另一方面所考察种系和检测程序差异不影响不同认知成分间的反应模式,即在逆反学习和/或外维度认知定势转移复杂学习阶段的达标训练次数和错误率显著高于简单鉴别和复杂鉴别等基本学习阶段。这些结果表明不同种系大鼠和检测程序的 AST都可以反映不同认知成分间的结构关系。
4.1 不同检测程序对AST认知结构的影响
在AST测试中RL和EDS是认知灵活性评价的核心指标,分别表征对已习得问题解决策略的调整和转换能力,以及随着环境关系变化抑制旧策略和跨维度建立新的应对策略的能力(Lapiz-Bluhm et al.,2008)。显然这两种认知转换过程分别基于前期策略定势和注意维度定势建立的基础上。因而通常与SD,CD或IDS阶段相比RL或EDS阶段达标训练次数和错误率更高。如果前期“定势”未能建立,将不表现出不同认知成分间的上述反应模式。例如研究发现小鼠建立“策略或维度定势”更加困难,通常需要重复的前期学习训练才能够诱发,例如重复的内维度转换训练才能够建立策略定势和注意维度定势(表现为更多的逆反学习和外维度转移达标训练次数和错误率) (Bissonette & Powell,2012)。另外,定势的建立及其稳定程度受前期“学习经验”参数,如经验类型和经历次数等的影响,一般来说多次的重复训练可以增强定势。而目前使用的五阶段和七阶段 AST检测程序中策略转换和注意定势转换之前动物经历的任务类型和训练次数存在差异,这是否会对定势形成和转移过程产生影响呢?本研究结果显示在复杂和简化版本的 AST检测程序中SD和Wistar大鼠不同阶段认知反应间的结构关系具有较好的一致性,提示所考察动物种系和检测程序都可以使得大鼠建立注意定势,从而构成评价认知转换能力的必要前提。采用SD,Lister和Long Evans等种系大鼠,一些研究报道药物、应激和脑区损毁等处理影响AST不同认知功能(Bondi,et al.,2008; Chen et al.,2004; McAlonan & Brown,2003)。尽管缺乏与本研究的直接关联,上述研究中对照组动物的结果也发现 AST不同认知成分间具有类似的相对稳定的结构关系。神经解剖和药物学研究证实不同类型的学习分别由不同脑区和神经通路介导。例如内侧前额叶皮质特异性介导 EDS阶段学习(Burnham et al.,2010; Floresco et al,2008),眶额叶皮质及其皮层下脑区背外侧纹状体完整神经通路特异性介导 RL阶段学习(McAlonan & Brown,2003)。SD和CD阶段的简单关联学习主要由皮层下脑区纹状体和基底神经结参与介导(Robbins &Arnsten,2009)。啮齿类动物类似的神经发育结构特征可能是导致认知结构模式具有相对稳定性的生理基础。
4.2 实验动物种系差异对AST的影响
本研究采用两种检测程序都发现SD和Wistar大鼠在AST测试中的认知表现存在差异,Wistar大鼠的总体认知表现,尤其是逆反学习阶段的成绩明显优于SD大鼠。以往研究报道这两个种系大鼠的认知功能存在差异。例如,在Morris水迷宫测试中SD大鼠在限定时间内找到站台所需的水平游动距离显著大于Wistar大鼠(Harker & Whishaw,2002;Van der Borght et al.,2005),提示二者海马依赖的空间认知能力存在差异。本研究结果表明它们在前额叶介导的习得策略调整和转换能力上也存在明显差异。另外,七阶段检测程序包括3次逆反学习训练。本研究发现两个种系大鼠,尤其是Wistar大鼠在第二次和第三次逆反学习的达标训练次数和达标错误反应率较第一次逆反学习均明显而稳定的降低,也提示Wistar大鼠表现出更好地对重复训练经验的迁移效应。与此一致,采用类似检测程序Bondi等也发现SD大鼠在第一次逆反学习阶段的表现与随后的两次相比较差(Bondi et al.,2010)。
造成上述认知灵活性种系差异的原因目前尚不清楚,相关研究提示这两个种系大鼠行为和前额叶功能差异的潜在影响。首先,Andrews等发现在新颖物体探索测试中 Wistar大鼠对于放置在测试箱中的新颖物体的接触时间明显长于 SD大鼠(Andrews et al.,1995),提示Wistar大鼠对新颖物体更强的探索能力。考虑到在 AST测试不同阶段大鼠不断接触到新的介质或气味刺激,因此对新颖刺激较强的探索能力有利于大鼠的学习过程,这可能部分解释了Wistar大鼠在AST中更好的整体认知表现。其次,在AST测试中大鼠需要学会在不同维度(如嗅觉、视觉、触觉等)的几对刺激中辨别与奖赏物相关联的正性刺激线索,并建立与之相应的策略寻找奖赏物。在多信号系统中确定与奖赏物相关联的正性刺激线索受选择性注意过程影响。本研究数据表明 SD和 Wistar大鼠的潜伏期存在明显差异。Wistar大鼠的潜伏期表现出明显的阶段性特点,在第一个阶段—SD阶段的潜伏期最长,随着检测进行平均潜伏期稳定而快速减少,后检测的 RL1,RL2和EDS阶段的潜伏期明显低于SD阶段,提示Wistar大鼠对测试环境和其他与奖赏获得不相关的探索行为减少,而与任务相关的目的性行为明显增加。与此不同,SD大鼠则未能观察到上述阶段性目的行为学习变化过程,提示二者的目标选择性注意过程可能存在差异。另一方面,SD大鼠在AST各阶段的潜伏期与Wistar大鼠相比更短(尤其在SD阶段有显著差异),而其认知表现相对较差(尤其在RL阶段有显著差异),二者行动速度和认知成绩相反的表现提示SD大鼠较差的认知表现并非是由于缺乏奖赏获得动机造成的。第三,已有研究证实逆反学习过程需要眶额叶皮质参与(Durstewitz et al.,2010; Rogers,Andrews,Grasby,Brooks,& Robbins,2000),眶额叶结构或功能异常特异性损害逆反学习能力(Lapiz-Bluhm,et al.,2008; McAlonan &Brown,2003)。SD和Wistar大鼠在眶额叶皮质参与的冲动行为(Brimberg,Flaisher-Grinberg,Schilman,& Joel,2007)和刺激条件下的皮层反应(Fuzik et al.,2013) 存在差异。在AST测试中,尤其是逆反学习阶段SD和Wistar大鼠的前额叶皮质激活是否存在差异还需要进一步的实验研究证实。
4.3 小结
本研究结果表明Wistar大鼠和SD大鼠前额叶认知灵活性存在种系差异,但不同认知成分间的反应模式不受种系和检测程序差异的影响,具有稳定的表面效度,均可作为研究认知转换灵活性及其障碍神经分子机理的实验模型。另一方面,考虑到AST是一项耗时和耗力的测试任务,采用Wistar种系大鼠的五阶段 AST测试更具操作便利性。上述发现为相关研究实验动物和实验程序的选择提供了行为学依据,扩展了对AST模型的认识。
Allison,C.,& Shoaib,M. (2013). Nicotine improves performance in an attentional set shifting task in rats.Neuropharmacology,64
,314–320.Andrews,J. S.,Jansen,J. H. M.,Linders,S.,Princen,A.,&Broekkamp,C. L. E. (1995). Performance of four different rat strains in the autoshaping,two-object discrimination,and swim maze tests of learning and memory.Physiology & Behavior,57
(4),785–790.Anokhin,A. P.,Heath,A. C.,& Ralano,A. (2003). Genetic influences on frontal brain function: WCST performance in twins.Neuroreport,14
(15),1975–1978.Beck,A. T. (2008). The evolution of the cognitive model of depression and its neurobiological correlates.American Journal of Psychiatry,165
(8),969–977.Birrell,J. M.,& Brown,V. J. (2000). Medial frontal cortex mediates perceptual attentional set shifting in the rat.Journal of Neuroscience,20
(11),4320–4324.Bissonette,G. B.,& Powell,E. M. (2012). Reversal learning and attentional set-shifting in mice.Neuropharmacology,62
(3),1168–1174.Bondi,C. O.,Jett,J. D.,& Morilak,D. A. (2010). Beneficial effects of desipramine on cognitive function of chronically stressed rats are mediated by alpha1-adrenergic receptors in medial prefrontal cortex.Progress in Neuro-psychopharmacology & Biological Psychiatry,34
(6),913–923.Bondi,C. O.,Rodriguez,G.,Gould,G. G.,Frazer,A.,&Morilak,D. A. (2008). Chronic unpredictable stress induces a cognitive deficit and anxiety-like behavior in rats that is prevented by chronic antidepressant drug treatment.Neuropsychopharmacology,33
(2),320–331.Brimberg,L.,Flaisher-Grinberg,S.,Schilman,E. A.,& Joel,D. (2007). Strain differences in ‘compulsive’ lever-pressing.Behavioural Brain Research,179
(1),141–151.Brown,V. J.,& Bowman,E. M. (2002). Rodent models of prefrontal cortical function.Trends in Neurosciences,25
(7),340–343.Burnham,K. E.,Bannerman,D. M.,Dawson,L. A.,Southam,E.,Sharp,T.,& Baxter,M. G. (2010). Fos expression in the brains of rats performing an attentional set-shifting task.Neuroscience,171
(2),485–495.Cain,R. E.,Wasserman,M. C.,Waterhouse,B. D.,& McGaughy,J. A. (2011). Atomoxetine facilitates attentional set shifting in adolescent rats.Developmental Cognitive Neuroscience,1
(4),552–559.Chen,K. C.,Baxter,M. G.,& Rodefer,J. S. (2004). Central blockade of muscarinic cholinergic receptors disrupts affective and attentional set-shifting.European Journal of Neuroscience,20
(4),1081–1088.Colacicco,G.,Welzl,H.,Lipp,H. P.,& Wurbel,H. (2002).Attentional set-shifting in mice: modification of a rat paradigm,and evidence for strain-dependent variation.Behavioral Brain Research,132
(1),95–102.Durstewitz,D.,Vittoz,N. M.,Floresco,S. B.,& Seamans,J.K. (2010). Abrupt transitions between prefrontal neural ensemble states accompany behavioral transitions during rule learning.Neuron,
66(3),438–448.Floresco,S. B.,Block,A. E.,& Tse,M. T. (2008). Inactivation of the medial prefrontal cortex of the rat impairs strategy set-shifting,but not reversal learning,using a novel,automated procedure.Behavioral Brain Research,190
(1),85–96.Fox,M. T.,Barense,M. D.,& Baxter,M. G. (2003). Perceptual attentional set-shifting is impaired in rats with neurotoxic lesions of posterior parietal cortex.Journal of Neuroscience,23
(2),676–681.Fuzik,J.,Gellért,L.,Oláh,G.,Herédi,J.,Kocsis,K.,Knapp,L.,…Toldi,J. (2013). Fundamental interstrain differences in cortical activity between Wistar and Sprague–Dawley rats during global ischemia.Neuroscience,228
,371–381.Harker,K. T.,& Whishaw,I. Q. (2002). Place and matchingto-place spatial learning affected by rat inbreeding (Dark-Agouti,Fischer 344) and albinism (Wistar,Sprague–Dawley) but not domestication (wild rat vs. Long–Evans,Fischer–Norway).Behavioural Brain Research,134
(1–2),467–477.Hilti,C. C.,Delko,T.,Orosz,A. T.,Thomann,K.,Ludewig,S.,Geyer,M. A.,… Cattapan-Ludewig,K. (2009). Sustained attention and planning deficits but intact attentional setshifting in neuroleptic-naive first-episode schizophrenia patients.Neuropsychobiology,61
(2),79–86.Lapiz-Bluhm,M. D.,Bondi,C. O.,Doyen,J.,Rodriguez,G. A.,Bédard-Arana,T.,& Morilak,D. A. (2008). Behavioural assays to model cognitive and affective dimensions of depression and anxiety in rats.Journal of Neuroendocrinology,20
(10),1115–1137.Liston,C.,Miller,M. M.,Goldwater,D. S.,Radley,J. J.,Rocher,A. B.,Hof,P. R.,… McEwen,B. S. (2006).Stress-induced alterations in prefrontal cortical dendritic morphology predict selective impairments in perceptual attentional set-shifting.Journal of Neuroscience,26
(30),7870–7874.Lyche,P.,Jonassen,R.,Stiles,T. C.,Ulleberg,P.,& Landrø,N.I. (2011). Attentional functions in major depressive disorders with and without comorbid anxiety.Archives of Clinical Neuropsychology,26
,38–47.McAlonan,K.,& Brown,V. J. (2003). Orbital prefrontal cortex mediates reversal learning and not attentional set shifting in the rat.Behavioural Brain Research,146
(1–2),97–103.Millan,M. J.,Agid,Y.,Brüne,M.,Bullmore,E. T.,Carter,C.S.,Clayton,N. S.,… Young,L. J. (2012). Cognitive dys-function in psychiatric disorders: Characteristics,causes and the quest for improved therapy.Nature Reviews Drug Discovery,11
(2),141–168.Newman,L. A.,& McGaughy,J. (2011). Adolescent rats show cognitive rigidity in a test of attentional set shifting.Developmental Psychobiology,53
(4),391–401.Robbins,T. W.,& Arnsten,A. F. (2009). The neuropsychopharmacology of fronto-executive function: Monoaminergic modulation.Annual Review of Neuroscience,32
,267–287.Rogers,R. D.,Andrews,T. C.,Grasby,P. M.,Brooks,D. J.,&Robbins,T. W. (2000). Contrasting cortical and subcortical activations produced by attentional-set shifting and reversal learning in humans.Journal of Cognitive Neuroscience,12
(1),142–162.Tait,D. S.,Marston,H. M.,Shahid,M.,& Brown,V. J. (2009).Asenapine restores cognitive flexibility in rats with medial prefrontal cortex lesions.Psychopharmacology,202
(1–3),295–306.Van der Borght,K.,Wallinga,A. E.,Luiten,P. G.,Eggen,B. J.,& Van der Zee,E. A. (2005). Morris water maze learning in two rat strains increases the expression of the polysialylated form of the neural cell adhesion molecule in the dentate gyrus but has no effect on hippocampal neurogenesis.Behavioral Neuroscience,119
(4),926–932.Wang,Q.,Luo,X. M.,Shao,F.,& Wang,W. W. (2012). Comparative study of the effects of different types of chronic stress model ofdepression
on cortically-mediated cognitive function in rats.Chinese Journal of Nervous and Mental Diseases,38
(8),449–453.[王琼,罗晓敏,邵枫,王玮文. (2012). 两种慢性应激诱导的抑郁模型大鼠前额叶认知功能的比较研究.中国神经精神疾病杂志,38
(8),449–453.]
