苦参生物碱类成分的HPLC指纹图谱研究
易远红,郝月莆(1.成都中医药大学附属医院药剂部,成都 61007;.成都中医药大学中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137)
苦参生物碱类成分的HPLC指纹图谱研究
易远红1*,郝月莆2(1.成都中医药大学附属医院药剂部,成都 610072;2.成都中医药大学中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137)
目的:建立苦参生物碱类成分的高效液相色谱(HPLC)指纹图谱。方法:色谱柱为KromasilNH2(250mm×4.6mm,5μm),流动相为乙腈-乙醇(8∶1,V/V)-3%磷酸水溶液(梯度洗脱),流速为1m l/m in,检测波长为220 nm;采用《中药色谱指纹图谱评价系统》(2004A版)对3批样品进行相似度评价。结果:建立的HPLC指纹图谱中,苦参生物碱类成分各峰分离度较好,一共确定了17个共有峰,并对其中5个峰进行了定位指认;3批样品的相似度均>0.9。结论:该方法可得到精密度、重复性、稳定性较好的苦参生物碱类成分的HPLC指纹图谱,为苦参提取物的质量控制提供另一种检测方法。
苦参;生物碱;指纹图谱;高效液相色谱法
苦参(Sophora flavescensAit.)为豆科槐属植物苦参的干燥根,全国各地均有出产,是我国常用中药。苦参具有清热燥湿、泻火解毒、祛风止痒的功效,同时还具有抗肿瘤[1-2]、抑菌[3]等作用,其主要含有生物碱类、黄酮类和皂苷类成分,发挥疗效的是生物碱类成分。苦参生物碱大多为喹诺里西啶类结构,碱性较强,酸性流动相条件下,它在C18柱色谱峰拖尾严重[4]。目前尚未发现采用正相柱对生物碱类成分进行指纹图谱的系统研究。本研究采用氨基柱为分离柱,以乙腈-乙醇(8∶1,V/V)为有机相,3%磷酸水溶液为水相,梯度洗脱,测定苦参生物碱类指纹图谱,以为苦参生物碱类指纹图谱的测定提供另一种检测方法。
1 材料
1.1 仪器
Agilent1200高效液相色谱(HPLC)仪,包括四元梯度泵、在线真空脱气机、自动进样针、恒温柱箱、DAD二极管阵列检测器、Agilent化学工作站(美国Agilent公司);BS224S型十万分之一型电子天平(德国赛多利斯科学仪器有限公司);SZ-93型自动双重纯水蒸馏器(上海亚荣生化仪器厂)。
1.2 试剂
AB-8大孔吸附树脂购自南开大学化工厂;苦参碱、氧化苦参碱、槐果碱、氧化槐果碱、槐定碱对照品(批号分别为110805-200508、110780-201007、110783-200115、110779-201046、110784-20303)均购自中国食品药品检定研究院;甲醇、磷酸为分析纯,乙腈、乙醇为色谱纯,水为双蒸水。
1.3 药材
苦参药材(批号:101003)购自四川科伦天然药业有限公司,经笔者鉴定为真品。
2 方法与结果
2.1 试液的制备
2.1.1 苦参生物碱的提取 参照文献[5],取苦参药材粗粉适量,渗漉法制备样品,以1 g/m l的适量浓度浓缩后,上样于AB-8大孔吸附树脂(径高比1∶3),用1.5倍体积水洗除杂,再用6倍体积50%乙醇以每小时2倍体积的流速洗脱,收集洗脱液,减压浓缩,真空干燥,即得生物碱类提取物。
2.1.2 供试品溶液的制备 取苦参生物碱类提取物,精密称定0.100 2 g,溶于25m l无水乙醇中,超声处理30min,滤过,定容至50m l容量瓶中,精密吸取1m l,定容至10m l容量瓶中,稀释至刻度,即得供试品。
2.1.3 对照品溶液的制备 取苦参碱、氧化苦参碱、槐果碱、氧化槐果碱、槐定碱,分别精密称定0.011 20、0.01532、0.013 40、0.016 6、0.010 01 g,置于10m l容量瓶中,加乙腈-甲醇溶液(80∶20,V/V)至刻度,精密吸取1m l,置于10m l容量瓶中,稀释至刻度,即得对照品溶液;将槐定碱和氧化苦参碱对照品等量混合,制得混合对照品溶液。
2.2 色谱条件
色谱柱:正相柱KromasilNH2(250mm×4.6mm,5μm);流动相:有机相为乙腈-乙醇(8∶1,V/V),水相为3%磷酸水溶液,梯度洗脱(程序见表1);流速:1m l/m in;检测波长220 nm;进样量:10μl;柱温:30℃。

表1 梯度洗脱程序Tab 1 Gradient dilution procedure
2.3 参照峰的选择
将苦参碱对照品溶液和供试品溶液各进样10μl,对比图谱中保留时间约为32min的色谱峰为苦参碱,因其色谱峰易于辨认、与其他的峰分离良好,且峰形稳定、保留时间适中,故采用此峰为参照峰。
2.4 方法学考察
2.4.1 精密度试验 取苦参生物碱类成分供试品溶液适量,按“2.1.2”项制备,连续进样6次,以苦参碱峰为标准峰,考察色谱峰的相对保留时间和峰面积。结果,各共有峰相对保留时间的RSD<0.15%,峰面积的RSD<2.5%,表明精密度良好。2.4.2 稳定性试验 取“2.4.1”项下供试品溶液适量,从制备到放置0、2、4、8、16 h后,分别测定。结果,各共有峰相对保留时间的RSD<1.97%,峰面积的RSD<5.0%,说明生物碱类成分在室温条件下16 h内稳定。
2.4.3 重复性试验 取苦参生物碱类提取物适量,精密称定0.1002、0.1003、0.1001、0.1003、0.1002、0.1005 g,共6份,按“2.1.2”项下操作法制备供试品溶液,分别进样测定。结果,各共有峰相对保留时间的RSD<1.3%,峰面积的RSD<3.5%,表明此方法重复性良好。
2.5 指纹图谱的建立与分析
2.5.1 样品指纹图谱的测定 分别取3个批次的苦参生物碱类提取物适量,按“2.1.1”项下操作法制备供试品溶液,在HPLC色谱仪中按上述色谱条件进样,记录60m in HPLC色谱峰,以峰出现率100%计,确定17个共有峰。色谱见图1。
2.5.2 共有峰的标定与确认 将3批苦参提取物的色谱数据导入国家药典委员会开发的《中药色谱指纹图谱评价系统》(2004A版)[6],设定匹配模板,进行谱峰多点校正,并生成对照指纹图谱,见图2。确定比较稳定的共有峰17个,3批的相似度均>0.9,平均值为0.997,表明所建立的指纹图谱技术指标稳定,重复性好,见表2。2.5.3 主要色谱峰的指认 根据同一化合物相同色谱分离条件下保留时间相同,紫外光谱图一致的原则,分别指认出5个色谱峰,分别是12号峰(槐果碱)、13号峰(苦参碱)、14号峰(氧化槐果碱)、15号峰(槐定碱)和16号峰(氧化苦参碱)。槐定碱和氧化苦参碱的极性相似,保留时间差异不大,故将槐定碱和氧化苦参碱混匀测定,结果见图3。

图1 高效液相色谱图Fig 1 HPLC chromatogram s

图2 3批苦参生物碱类成分的HPLC指纹图谱Fig 2 HPLC fingerprints of 3 batches of alkaloids from S. flavescens

表2 3批样品指纹图谱中共有峰的保留时间和峰面积Tab 2 The retention time and peak area of the fingerprints of 3 batchesof samp les
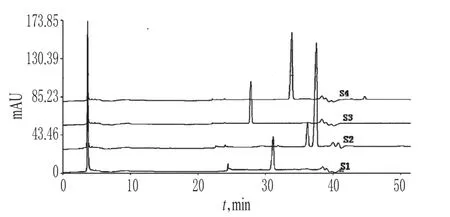
图3 对照品的HPLC图S1.苦参碱对照品;S2.槐定碱与氧化苦参碱的混合对照品;S3.槐果碱对照品;S4.氧化槐果碱对照品Fig 3 HPLC chromatogramsof substance controlS1.matrine control;S2.m ixed control of sophoridine and oxymartrine;S3.sophocarpine control;S4.oxysophocarpine control
3 讨论
黄颖等[7]在对山豆根生物碱的指纹图谱研究中发现,采用C18柱色谱峰易拖尾,加大磷酸和三乙胺的浓度可以使峰形减少拖尾;但随着加入浓度的升高,对仪器和色谱柱的损害也在增大[8]。赵华等[9]在对苦参药材生物碱成分的指纹图谱研究中发现,苦参生物碱碱性较强,酸性流动相条件下,它们在C18柱上的色谱峰拖尾严重。在水相中添加氨水可显著抑制峰拖尾,同时可提高保留强度。可见,使用C18柱对生物碱的指纹图谱研究都存在色谱峰的拖尾问题,而且在流动相中到底是加酸还是加碱能够较有效地抑制拖尾等问题也有待研究。
按照上述实验条件对购买的苦参生物碱类成份进行分析,发现苦参生物碱类成分的色谱峰都集中在25~40min之间,各色谱峰之间分离度较好,也证明了生物碱极性都较大,如果采用C18柱梯度洗脱分离,生物碱类成分都较集中出现在前半段,对色谱峰的分离效果较差。
通过查阅文献,未见采用氨基柱测定生物碱类指纹图谱的报道,故本研究拟在解决C18柱拖尾问题的同时,也为生物碱类成分的指纹图谱研究提供另一种方法,故只对3批苦参生物碱类成分进行了指纹图谱的研究,以后需要增进10批苦参生物碱类成分进行系统的指纹图谱考察。
[1] 张力,李海英,吴式琇,等.苦参碱对人鼻咽癌CNE2细胞增殖的抑制作用研究[J].江西中医药,2009,21(6):75.
[2] 徐广伟,满世军,王志生,等.氧化苦参碱对荷瘤小鼠免疫功能的影响[J].中国肿瘤临床与康复,2001,8(5):10.
[3] 蒋莲芳,蒋亚生.苦参药理研究进展[J].时珍国医国药,2000,11(3):278.
[4] 赵华,宋敏,赵画,等.苦参药材生物碱成分的HPLC指纹图谱[J].中国医科大学学报,2009,40(2):139.
[5] 王莹,向孙敏,王淼,等.苦参生物总碱纯化工艺研究[J].时珍国医国药,2013,24(7):1 634.
[6] 刘文,蒋世云.中药指纹图谱研究与应用进展[J].中国药房,2011,22(19):1 819.
[7] 黄颖,王乃平,陈勇.广西产山豆根HPLC指纹图谱测定[J].中国实验方剂学杂志,2011,17(14):66.
[8] 宋洁瑾,陈涛,李进.梯度洗脱方法在中药指纹图谱中的应用[J].天津药学,2007,19(6):70.
[9] 赵华,宋敏,赵画,等.苦参药材生物碱成分的HPLC指纹图谱[J].中国医科大学学报,2009,40(2):139.
Study on HPLC FingerprintsofA lkaloids fromSophora flavescens
YI Yuan-hong1,HAO Yue-pu2(1.Dept.of Pharmacy,The Affiliated Hospital of Chengdu University of TCM,Chengdu 610072,China;2.Key Lab for Systematic Study and Utilization of TCM Source,Chengdu University of TCM,M inistry of Education,Chengdu 611137,China)
OBJECTIVE:To establish HPLC fingerprint of alkaloids fromSophora flavescens.METHODS:The determ ination was performed on Kromasil NH2(250×4.6 mm,5μm)column w ith mobile phase consisted of acetonitrile-ethanol(8∶1,V/V)-3% phosphoric acid(gradient elution)at the flow rate of 1 m l/m in.The detection wavelength was set at 220 nm.The sim ilarity of 3 batches of samples was evaluated by usingTCM Chromatographic Fingerprint Evaluation System(2004 A edition).RESULTS:In HPLC fingerprints,the chromatographic peaks of alkaloids fromS.flavescenswere well-separated,and there were 17 common peaks,among which 5 peaks were positioned and identified.The sim ilarity of 3 batches was more than 0.9.CONCLUSIONS:HPLC fingerprint of alkaloids fromS.flavescenscan be obtained w ith good precision,reproducibility and stability,providing another detectionmethod for quality control of alkaloids fromS.flavescens.
Sophora flavescens;Alkaloid;Fingerprint;HPLC
R284.1;R917
A
1001-0408(2014)19-1772-03
DOI 10.6039/j.issn.1001-0408.2014.19.14
*主管药师。研究方向:医院药学、中药学。E-mail:895239295 @qq.com
2013-12-09
2014-01-20)
·中药视窗·

