联合检测血清miR-125b和AFP对原发性肝细胞癌的诊断价值*
左 铎 罗 艺 郭 华 张 宁
联合检测血清miR-125b和AFP对原发性肝细胞癌的诊断价值*
左 铎①罗 艺②郭 华②张 宁②
目的:探讨血清中miR-125b作为原发性肝细胞癌(hepatocellular carcinoma,HCC)的血清标志物的可能性和联合检测miR-125b和AFP对HCC的诊断价值。方法:通过实时荧光定量PCR(quantitative real-time polymerase chain reaction,RT-qPCR)检测65例HCC患者和30例健康对照组的血清miR-125b表达量,分析其对HCC的诊断价值,以及与HCC临床病理资料参数间的关系。结果:HCC患者组血清miR-125b表达与对照组相比较低,且两者的差异有统计学意义(P<0.05)。miR-125b的表达与患者性别、年龄、乙肝表面抗原阳性、AFP、ALT和α-GGT的表达水平无关(P>0.05)。miR-125b的表达与患者肝硬化、肿瘤大小和TNM分期有关,且差异有统计学意义(P<0.05)。单独检测miR-125b的ROC曲线下的AUC为0.917(95%CI:0.851~0.960,P<0.001),灵敏性为85.9%,特异性为93.5%,联合miR-125b和AFP检测的ROC曲线下的AUC为0.951(95%CI:0.894~0.982,P<0.001),灵敏性为92.9%,特异性为93.5%,检测AFP<20 μg/L的HCC患者血清miR-125b的ROC曲线下的AUC为0.889(95%CI:0.776~0.957,P<0.001),灵敏性为84.0%,特异性为87.1%。结论:联合检测血清miR-125b和AFP对早期诊断原发性HCC具有重要的临床价值。
原发性 肝细胞癌 微小RNA 甲胎蛋白 诊断 实时荧光定量PCR
肝细胞癌(hepatocellular carcinoma,HCC)在世界恶性肿瘤中排名第6名[1]。亚洲和非洲地区是HCC患者的高发区[2]。由于早期确诊率不高,大多HCC患者发现肿瘤时已经处于肝癌晚期,伴随高死亡率,自临床诊断开始5年总生存率仅有5%~9%,错过了实施肝切除术的最佳时机,且预后较差,具有高复发率,和抗化疗等特点[1-3]。目前主要筛查HCC的检测手段为影像学和血清学检测。由于缺乏有效的预测和诊断的检测手段,患者往往是通过活检及手术探查才得到确诊。血清学诊断HCC以AFP检测为主,其最大问题就是灵敏性和特异性较低,分别只有39%~65%和76%~94%[4]。有研究者预测微小RNA(microRNA,miRNA)可以作为一种肿瘤标志物来对肿瘤的诊断和预后进行估计[5]。本研究联合检测HCC患者血清AFP和miR-125b可能有效地达到早期诊断HCC高灵敏性和高特异性的目的。Liang等[6]发现miR-125b在原发性HCC组织表达下调,并确定癌基因LIN28B是miR-125b的直接下游靶基因,miR-125b参与调控LIN28B和下游分子p21Cip1/ Waf1、c-myc和E-cadherin来抑制HCC细胞的生长和转移。Au等[7]发现HCC组织中的EZH2基因表达上调与miR-125b表达下调显著相关,并通过一系列的细胞学实验发现EZH2通过Wnt信号通路和MAPK/ ERK信号通路抑制miR-125b抗HCC转移功能,这两个通路与肿瘤的转移密切相关。这些文献报道均是在组织学和细胞学水平上研究HCC中的miR-125b,是否在循环血液中同样也有类似的临床价值,本研究采用实时荧光定量PCR(quantitative real-time polymerase chain reaction,RT-qPCR)检测miR-125b在中国人群中原发性HCC患者与健康人的血清中的表达,分析比较之间的差异,并分析miR-125b与HCC临床病理特征之间的相关性,联合检测HCC患者血清miR-125b和AFP提高早期诊断原发性HCC的灵敏性和特异性。
1 材料与方法
1.1 材料
收集2011年5月至2012年12月期间本院肝胆外科经病理确诊为原发性HCC的患者血清标本65例,患者男性48例,女性17例,年龄27~79岁,男性中位数年龄56岁,女性中位数年龄51岁;健康对照组男性17例,女性13例,年龄24~80岁,男性中位数年龄52岁,女性中位数年龄年龄49岁,两组性别和年龄比较均差异无统计学意义(P>0.05)。患者入院前均未进行手术或放化疗治疗。HCC患者病理资料完整,按照UICC(第7版)TNM标准对HCC进行临床病理分期(表1)。患者和健康人均空腹静脉抽血,用非抗凝剂的试管采集2~3 mL的血液标本,分离血清。
1.2 方法
1.2.1 试剂与仪器 miR-125b主要试剂购自美国ABI有限公司,分别为mirVanaTMPARISTM提取miRNA试剂盒,Taqman®miRNA逆转录试剂盒,Taqman®miRNA qPCR试剂盒,TaqMan®Universal PCR混合试剂Ⅱ(不含UNG),TaqMan®small RNA引物(5×),Taq-Man®small RNA引物(20×)。采用的仪器分别为美国Beckman Coulter公司Allegra 64R高速冷冻离心机,美国BIO-RAD公司S1000 Thermal Cycler普通PCR仪,美国BIO-RAD公司CFX96实时荧光定量PCR仪。AFP试剂购自Roche诊断产品(上海有限公司),采用Roche E170全自动电化学发光分析仪检测。ALT、α-GGT试剂购自美国Beckman Coulter有限公司,采用Beckman Coulter AU5821全自动生化分析仪检测。
1.2.2 实验方法 用非抗凝剂的试管采集血液标本后,3 000 r/min离心5 min,分离出血清。-80℃保存血清标本。取200 μL血清,按照mirVana™PARIS™提取miRNA试剂说明书进行提取miRNA。按照Taq-Man®miRNA逆转录试剂说明书将提取的RNA逆转录合成cDNA,按比例配制RT混合液,分别加入Taq-Man®hsa-miR-125b引物(5×)或内参TaqMan®U6 sn-RNA引物(5×),使用RT-PCR仪进行逆转录。合成cDNA后,按照TaqMan®miRNA qPCR试剂说明书进行实时荧光定量PCR检测,混合加入TaqMan®Universal PCR混合试剂Ⅱ(不含UNG),分别加入Taq-Man®hsa-miR-125b引物(20×)或内参TaqMan®U6 snRNA引物(20×),miR-125b和内参U6的特异引物序列见表2。根据miRNA的扩增曲线和溶解曲线进行数据分析。
1.2.3 数据处理 血清中miRNA的相对表达水平[8]:公式=2-△△Ct,△Ct=目标基因Ct-内参基因Ct,目标基因Ct和内参基因Ct来自同一标本中的目标基因Ct值和内参基因Ct值。△△Ct=△Ct实验组-△Ct对照组。
1.3 统计学分析
所有统计学计算均使用SPSS 19.0软件完成。miR-125b相对表达水平采用中位数和四分位间距表示,Mann-Whitney U检验分析血清miR-125b水平的临床意义。MedCalc 11.4软件构建ROC(receiver operating characteristic)曲线,确定血清miR-125b诊断HCC的临界值(cutoff value)并计算AUC(area under the ROC curve)。采用Mann-Whitney U检验(两组间比较)和KrusKal-Wallis H检验(多组间比较)分析血清miR-125b与HCC临床病理特征各参数之间的相关性。P<0.05为差异有统计学意义。
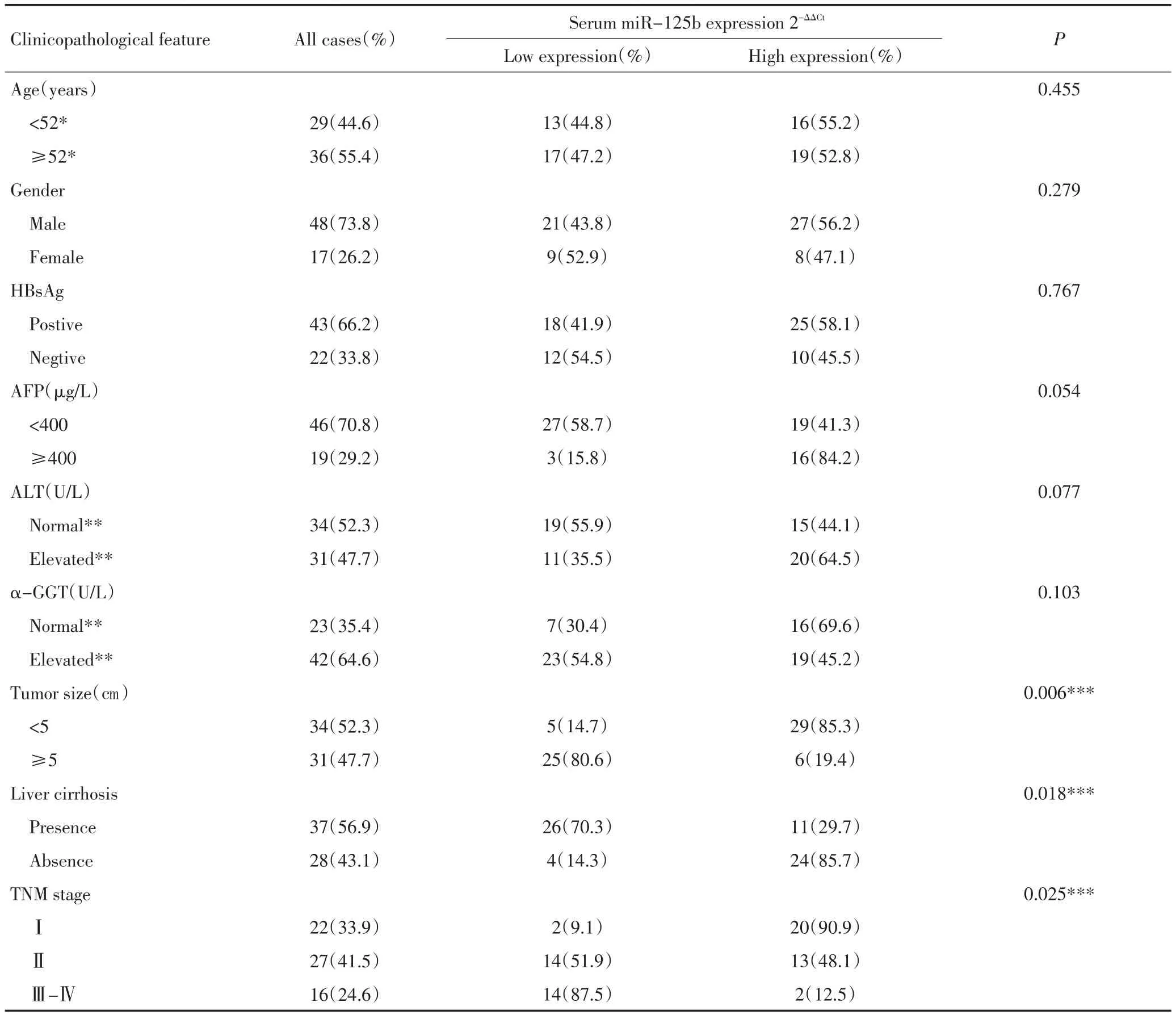
表1 65例HCC患者miR-125b表达与临床病理资料的相关性 %Table 1 miR-125b expression in 65 HCC patients and its correlation with clinical pathologic data %

表2 miR-125b与内参基因U6特异引物序列Table 2 Specific primer sequences of target miR-125b and reference gene U6
2 结果
2.1 HCC患者血清miR-125b表达水平与临床资料的关系
HCC组血清miR-125b相对表达水平0.494(0.276~0.591),对照组血清miR-125b相对表达水平为1.446(1.085~1.701),HCC组血清miR-125b相对表达水平是健康对照组的0.342倍,HCC组中miR-125b表达明显低于健康对照组(P<0.001)。将HCC组分为两组,其中血清miR-125b相对表达水平<0.494作为低表达组,血清miR-125b相对表达水平>0.494作为高表达组。HCC患者56.9%(37/65)肝硬化,HCC患者47.7%(31/65)肿瘤>5 cm,HCC患者TNM分期33.9%(22/65)Ⅰ期、41.5%(27/65)Ⅱ期、24.6%(16/65)Ⅲ~Ⅳ期。HCC患者血清miR-125b表达水平与肝硬化、肿瘤大小、TNM分期有关(P<0.05),而与性别、年龄、HBsAg、AFP、ALT、α-GGT等均无关(P>0.05)。
2.2 HCC患者血清miR-125b表达的灵敏性和特异性
单独检测HCC组和健康对照组的血清miR-125b和AFP,miR-125b灵敏性为85.9%,特异性为93.5%,AUC为0.917(95%CI:0.851~0.960,P<0.001),其临床诊断临界值(cutoff value≤0.690),而AFP灵敏性仅为43.5%,特异性为93.3%,AUC为0.715(95%CI:0.623~0.795,P<0.001)。联合检测HCC组和健康人对照组血清miR-125b和AFP,其灵敏性提高至92.9%,特异性为93.5%,AUC为0.951(95%CI:0.894~0.982,P<0.001,图1)。即使AFP<20 μg/L的HCC患者也能通过检测血清miR-125b诊断HCC,其灵敏性为84.0%,特异性为87.1%,AUC为0.889(95%CI:0.776~0.957,P<0.001,图2)。分别对AFP<20 μg/L、AFP为20 μg/L~400 μg/L和AFP>400 μg/L三组HCC患者血清miR-125b的灵敏性和特异性进行分析(表3)。
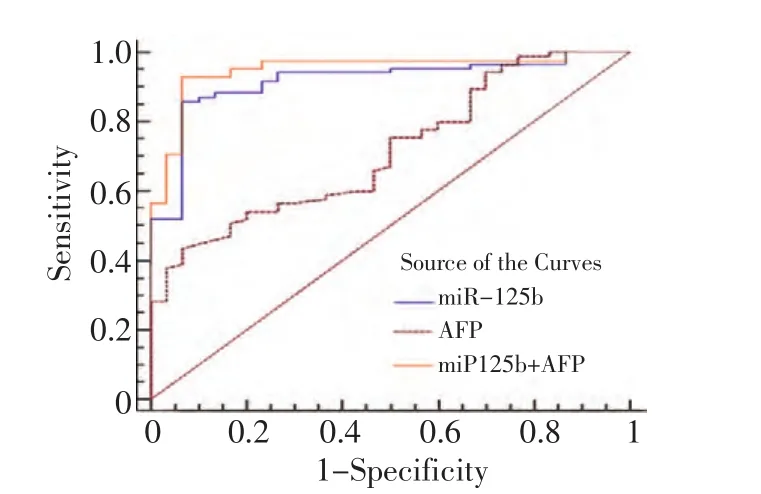
图1 血清miR-125b,AFP及联合血清miR125b和AFP诊断HCC的ROC曲线分析Figure 1 ROC curve analysis of serum miR-125b,AFP,and combination of serum miR-125b and AFP for the diagnosis of HCC
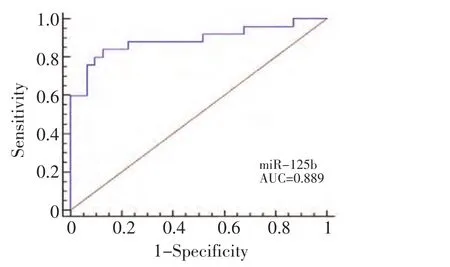
图2 AFP<20 μg/L的患者血清miR-125b诊断HCC的ROC曲线分析Figure 2 ROC curve analysis of serum miR-125b for the group(AFP<20 μg/L)of HCC

表3 三组患者血清miR-125b作为诊断HCC的标志物的性能预测Table 3 Predictive performance of serum miR-125b as biomarker for detection of HCC in three groups
3 讨论
目前,诊断HCC的临床手段还是影像技术(腹部超声、MRI、加强CT),血清AFP检测,以及创伤性较大的活检病理学分期。血清AFP检测可便捷应用于HCC的初步诊断,欧洲肿瘤内科学会(ESMO)指南建议AFP>400 μg/L可以代替肝穿刺细胞学检查[9],但AFP升高也存在于良性肝脏疾病中。大约有1/3的小肿瘤(直径<3 cm)的HCC患者不能通过腹部超声得到确诊,特别是肥胖或有潜在肝硬化的患者可能会错过检查出小病变的机会[4]。miRNA与靶基因mRNA的3'UTR区特定碱基互补配对结合,导致靶基因mRNA被降解或翻译被抑制,从而对靶基因转录后的表达起负调控作用[10]。miRNA参与细胞增殖、分化、代谢和凋亡等过程,在肿瘤的形成过程中发挥着类似癌基因或抑癌基因的作用[11]。近几年文献报道已经确定miR-125b作为抑癌基因在HCC组织中表达下调[6-7]。随着研究发现循环血中存在的miRNA稳定性高,不易被RNA降解[12]。进而有研究发现miR-125b在非小细胞肺癌[13]和乳腺癌患者[14]血清中表达异常,但在中国人群中HCC患者血清miR-125b的临床研究还少有人报道。本研究首次提出联合血清miR-125b和AFP提高早期诊断原发性HCC的灵敏性和特异性。
本研究通过血清学检测提示miR-125b是分泌型miRNA,不仅在HCC患者组织和HCC细胞株中存在[6-7],在HCC患者血清中也同样存在,且表达下调。本研究通过分析血清miR-125b与HCC临床病理特征的关系,发现HCC患者血清中的miR-125b的表达与TNM分期显著相关(P=0.025)。通过miR-125b检测有望预测TNM分期提示HCC患者区域淋巴结受累和远处转移的可能性。肿瘤直径≥5 cm和肿瘤直径<5 cm分两组分析发现肿瘤直径大小与血清miR-125b表达显著相关(P=0.006),提示可有助于腹部超声检查肿瘤大小。有肝硬化和无肝硬化分两组分析发现患者血清中的miR-125b的表达与肝硬化显著相关(P=0.018)。在血清学诊断HCC方面,单独检测miR-125b灵敏性为85.9%,特异性为93.5%,AUC= 0.917(P<0.001),通过ROC曲线确定血清miR-125b表达的临床诊断临界值(cutoff value≤0.690),即当miR-125b相对表达水平2-ΔΔCt≤0.690可考虑患有HCC的可能。单独检测AFP灵敏性仅为43.5%,特异性为93.3%,AUC为0.715(P<0.001),通过miR-125b与AFP联合检测,早期诊断HCC的灵敏性可提高至92.9%,与单独检测AFP特异性相比略有提高至93.5%,AUC为0.951(P<0.001)。在AFP<20 μg/L的HCC患者血清miR-125b诊断HCC的灵敏性为84.0%,特异性为87.1%,AUC为0.889(P<0.001),提示通过对HCC患者血清中miR-125b的检测有望可以降低血清AFP<20 μg/L的HCC患者通过血清学筛查的漏检率。
综上所述,联合血清miR-125b和AFP检测可提高诊断原发性HCC的灵敏性和特异性,对早期诊断原发性HCC具有潜在的临床价值。本研究将在接下来的工作中继续增加标本量进一步验证本研究得出的结论,并通过观察HCC患者治疗前后血清中的miR-125b表达水平是否有差异,进一步确定其是否可以作为治疗患者的监测指标。通过HCC患者预后情况来进一步评估其是否为患者预后不良因素。miR-125b作为HCC的抑癌基因的机制较为复杂且不明确,也将进一步探讨miR-125b在HCC发生发展中的作用,希望miR-125b对HCC的诊断、监测及治疗方面发挥积极的作用。
1 Verslype C,Rosmorduc O,Rougier P,et al.Hepatocellular carcinoma:ESMO-ESDO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2012,23(7):41-48.
2 Chen CJ,Lee MH.Early diagnosis of hepatocellular carcinoma by multiple microRNAs:validity,efficacy,and cost-effectiveness[J].J Clin Oncol,2011,29(36):4745-4747.
3 Schwartz M,Roayaie S,Konstadoulakis M.Strategies for the management of hepatocelluar carcinoma[J].Nat Clin Pract Oncol,2007, 4(7):424-432
4 Collier J,Sherman M.Screening for hepatocellular carcinoma[J]. Hepatology,2003,27(1):273-278
5 Lei L,Chenhai L,Qiang H.MicroRNA and tumor immunity[J]. Chin J Clin Oncol,2012,39(1):52-55.[刘 磊,刘臣海,黄 强.microRNAs与肿瘤免疫关系的研究进展[J].中国肿瘤临床,2012,39(1): 52-55.]
6 Liang L,Wong CM,Ying Q,et al.MicroRNA-125b suppressesed human liver cancer cell proliferation and metastasis by directly targeting oncogene LIN28B[J].Hepatology,2010,52(5):1731-1740.
7 Au SL,Wong CC,Lee JM,et al.Enhancer of zeste homolog 2 epigenetically silences multiple tumor suppressor microRNAs to promote liver cancer metastasis[J].Hepatology,2012,56(2):622-631.
8 Xueying Z,Linlin Z,Xuedong H,et al.Expression of three microRNAs in plasma of breast cancer patients[J].Chin J Clin Oncol, 2012,39(3):136-140.[张学营,甄林林,韩学东,等.乳腺癌患者血浆中三种microRNA的表达水平分析[J].中国肿瘤临床,2012,39(3): 136-140.]
9 Jelic S,Sotiropoulos GC.Hepatocelluar carcinoma:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2010,21(5):59-64
10 Farazi TA,Hoell JI,Morozov P,et al.microRNAs in Human Cancer[J].Adv Exp Med Biol,2013,774:1-20.
11 Xiaoqiu MA,Jianchun CAI.Advances in the research on the microRNAs related to tumorous epigenetic modifications[J].Chin J Clin Oncol,2012,39(4):237-240.[马筱秋,蔡建春.microRNAs在肿瘤表观遗传调控中的研究进展[J].中国肿瘤临床,2012,39(4): 237-240.]
12 Jiong S,Fanqing M.Progress of circulating microrna in the diagnosis and prognosis of hepatocellular carcinoma or liver diseases[J]. Chin J Clin Oncol,2011,38(17):1048-1051.[史 炯,孟凡青.循环miRNA在肝癌诊断及预后预测中的研究进展[J].中国肿瘤临床, 2011,38(17):1048-1051.]
13 Cui EH,Li HJ,Hua F.Serum microRNA 125b as a diagnostic or prognostic biomarker for advanced NSCLC patients receiving cisplatin-based chemotherapy[J].Acta Pharmacol Sin.,2013,34(2): 309-313.
14 Mar-Aguilar F,Mendoza-Ramírez JA,Malagón-Santiago I.Serum circulating microRNA profiling for identification of potential breast cancer biomarkers[J].Dis Markers,2013,34(3):163-169.
(2014-01-20收稿)
(2014-04-27修回)(本文编辑:周晓颖)
The diagnosis value of combined detection of serum mir-125b and alpha-fetoprotein for primary hepatocellular carcinoma
Duo ZUO1,Yi LUO2,Hua GUO2,Ning ZHANG2
Ning ZHANG;E-mail:nzhangchina@yahoo.com
1Department of Laboratory,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center of Cancer, Key Laboratory of Cancer Prevention and Therapy,Tianjin,National"863"Plan Clinical Research Laboratory Tianjin 300060,China;2Laboratory of Cancer Cell Biology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center of Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin,Tianjin 300060,China
This work was supported by the National Basic Research Program 973 of China(Grant No:2011CB933100),The National High Technology Research and Development Program 863 of China(Grant No:2011AA02A111),and Tianjin Medical University Cancer Institute and Hospital Level Program(Grant No:Y1302)
Objective:To investigate the possibility of miR-125b in serum as a novel tumor marker for primary hepatocellular carcinoma(HCC)and the diagnosis value of combined detection of miR-125b and alpha-fetoprotein(AFP)for HCC.Methods:We detected serum miR-125b expression of 65 cases of HCC patients and 30 cases of healthy controls by real-time quantitative PCR.Moreover,we analyzed the significance of miR-125b and explored the relationship between miR-125b and clinical pathological factors.Results:The level of miRNA-125b was down regulated in serum of HCC patients compared with healthy controls which showed significant differences(P< 0.05).Furthermore,the expression of miRNA-125b has no distinct correlation with sex,age,HbsAg,AFP,ALT and α-GGT,which had no significant differences(P>0.05).The expression level of miRNA-125b correlated the difference with liver Cirrhosis,tumor size and tumor node metastasis(TNM)stages,which were considered significant differences(P<0.05).The receiver operating characteristic(ROC)curve analysis of serum miR-125b for the diagnosis of HCC yielded AUC of 0.917(95%CI:0.851~0.960,P<0.001)with 85.9%sensitivity and 93.5%specificity.The ROC curve analysis of combined miR-125b andAFPfor HCC detection yieldedAUC of 0.951(95%CI:0.894~0.982, P<0.001)with 92.9%sensitivity and 93.5%specificity.The ROC curve analysis of serum miR-125b as biomarkers for the group(AFP<20 μg/L)of HCC yielded AUC of 0.889(95%CI:0.776~0.957,P<0.001)with 84.0%sensitivity and 87.1%specificity.Conclusion:Serum miRNA-125b combined withAFP has considerable clinical value for the early diagnosis of primary HCC
primary,hepatocellular carcinoma,micro-RNA,alpha-fetoprotein,diagnosis,quantitative real-time polymerase chain reaction
10.3969/j.issn.1000-8179.20140337
①天津医科大学肿瘤医院检验科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,国家“863”计划临床研究实验室(天津市300060);②肿瘤细胞生物学实验室
*本文课题受国家重大科学研究计划973项目(编号:2011CB933100)、国家高技术研究发展计划863项目(编号:2011AA02A111)和天津医科大学肿瘤医院院级课题(编号:Y1302)资助
张宁 nzhangchina@yahoo.com

左铎 技师,硕士在读研究生。研究方向为生物化学与分子生物学。
E-mail:13752126767@163.com

