牙周慢性炎症对牙周膜干细胞生物学特性的影响
刘亚丽,刘文佳,胡成虎,丁 寅,金 岩
(1.昆明医科大学口腔医学院,云南昆明 650031;2.第四军医大学口腔医学院,陕西西安 710032)
牙周慢性炎症对牙周膜干细胞生物学特性的影响
刘亚丽1,刘文佳2,胡成虎2,丁 寅2,金 岩2
(1.昆明医科大学口腔医学院,云南昆明 650031;2.第四军医大学口腔医学院,陕西西安 710032)
目的:探讨牙周慢性炎症对牙周膜干细胞(periodontal ligament stem cells,PDLSCs)生物学特性的影响。方法:体外有限稀释法克隆化培养健康个体和慢性牙周炎患者牙周膜干细胞(H-PDLSCs和P-PDLSCs),免疫荧光染色法分析细胞表面分子;克隆形成和Edu染色检测细胞增殖能力;并通过体外成骨、成脂、成软骨诱导培养,比较两组PDLSCs多向分化能力。结果:慢性牙周炎患者牙周膜组织中可分离培养出PDLSCs,与分离自牙周健康者的H-PDLSCs相比,其增殖能力升高,但分化能力减弱(P<0.05)。结论:牙周慢性炎症微环境可降低PDLSCs的分化潜能。
牙周膜干细胞;慢性牙周炎;微环境
[牙体牙髓牙周病学杂志,2014,24(1):21]
[Chinese Journal of Conservativedentistry,2014,24(1):21]
牙周病是一种慢性炎症性骨吸收疾病,影响全世界高达90% 以上的人口,是导致成人牙齿丧失最主要的原因[1]。牙周病治疗的关键是消除局部刺激因素、控制感染并诱导牙周支持组织的修复和再生[2]。近年来,组织工程学利用牙周膜干细胞(periodontal ligament stem cell,PDLSCs)修复和再生病变牙周组织已成为牙周病治疗的新手段[3-4]。组织工程学再生理论认为:引起组织再生失败的主要原因是由于种子细胞的数量及其生物学特性的缺陷,同时局部的微环境也影响种子细胞功能的发挥。所以深入了解 PDLSCs在不同微环境中生物学特性的差异,对牙周膜干细胞所介导的炎性骨破坏性疾病的治疗具有重要的意义。患慢性牙周炎时,其组织的形成和再生均受到抑制,这可能与炎症微环境影响了干细胞的分化功能有关。因此,本实验分别从牙周健康和牙周炎症个体的牙周膜组织中分离、培养牙周膜干细胞(H-PDLSCs和P-PDLSCs),通过比较两者在增殖和分化能力方面的差异,探讨炎症微环境对 PDLSCs生物学特性的影响。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养基、谷氨酰胺、青链霉素(Gibco,美国);胎牛血清(杭州四季青公司);I型胶原酶、2.5g/L胰蛋白酶、甲苯胺蓝、抗坏血酸、地塞米松、β-甘油磷酸钠、TGF-β1、茜素红、油红 O(Sigma,美国);鼠抗人STRO-1、CD 146/MUC 18单克隆抗体(R&D Systems,美国);罗丹明山羊抗小鼠 IgG(中杉金桥);倒置相差显微镜以及照相系统(O-lympus,日本)。
1.2 人牙周膜干细胞的培养和分离
1.2.1 取材和原代培养
收集29~38岁志愿者因正畸需要拔除的牙体牙周组织健康前磨牙或第三磨牙8个,同时收集31~42岁因慢性牙周病(X线示牙槽骨吸收>牙根2/3,牙周袋深度>5 mm)而拔除的牙周病患牙7个。牙齿拔除后立即用含双抗(青链霉素)的PBS液和α-MEM培养液反复交替冲洗,体视显微镜下修剪去除上皮组织和炎性肉芽组织后,用锐利的刀片剥离牙根表面的牙周膜组织并剪成1 mm×1 mm×1 mm的小块,分别接种于6孔培养板内;组织块上轻置无菌盖玻片并加入少量 α-MEM培养液,37℃,50 mL/L二氧化碳孵箱中培养。每3d换液 1次,待细胞从组织块边缘爬出并生长达80% 汇合时,胰酶消化传代。
1.2.2 有限稀释法克隆化培养人牙周膜干细胞
取对数生长期的第1代牙周膜细胞,用α-MEM培养液重悬并调整细胞密度至10~15/mL后,接种于96孔培养板(每孔100 μL),37℃ CO2孵箱中培养过夜,标记单个细胞孔后继续培养;待克隆达孔底面积的1/3~1/2时,胰酶消化单克隆细胞,将多个单克隆来源的细胞悬液混合,形成多克隆PDLSCs,继续扩大培养。取第2~4代牙周健康组和慢性牙周病组的牙周膜干细胞(H-PDLSCs和P-PDLSCs)用于以下实验。
1.3 两种PDLSCs生物学特性的比较观察
1.3.1 克隆形成能力观察
分别取第 3代 H-PDLSCs和 P-PDLSCs,以1×106/mL密度接种于9 cm培养皿中常规培养。第14天时终止培养,弃培养液,PBS浸洗2次,用40g/L多聚甲醛液固定15 min;PBS浸洗2次,显微镜下观察两种细胞的克隆形成情况。以>50个细胞的集落记为一个克隆,并按以下公式计算克隆形成率:

1.3.2 免疫荧光法检测细胞表面分子CD146和STRO-1
分别取第3代 H-PDLSCs和 P-PDLSCs,以3×103/mL的密度接种于24孔培养板,常规培养过夜后,用40g/L多聚甲醛液固定20 min,PBS洗3遍,加羊血清封闭30 min;直接加鼠抗人CD146和STRO-1单克隆抗体,4℃孵育过夜;PBS洗3次,加山羊抗小鼠IgG二抗,37℃孵育40 min;PBS洗3遍,Hochest胞核衬染,洗净后荧光显微镜下避光观察并拍照。
1.3.3 Edu染色检测细胞的增殖能力
分别 取第3代 H-PDLSCs和 P-PDLSCs,以3×103/mL的密度接种于 24孔培养板,常规培养过夜后,更换无血清的培养液饥饿培养12 h;更换含100 mL/L FBS的新鲜培养液继续培养过夜;40g/L多聚甲醛液固定 20 min,PBS洗3遍,按照Edu染色试剂盒操作指南进行 Edu染色,镜下观察染色阳性细胞数并拍照。
1.3.4 两种PDLSCs分化能力的比较观察
1.3.4.1 成骨分化能力的观察
分别取第 3代 H-PDLSCs和 P-PDLSCs,以1×106/mL的密度接种于6孔培养板,常规培养至细胞生长达60%以上融合时,更换矿化诱导液(含10 mol/L 地 塞 米 松、50 μg/mL 维 生 素 C、10 mmol/L β-甘油磷酸钠的α-MDM)进行成骨诱导培养。21d后,弃培养液,40g/L多聚甲醛液固定;茜素红染色,镜下观察、拍照;并用图像分析软件 Image-Pro Plus 5.0(Media Cybernetics,美国)计算矿化结节面积。
1.3.4.2 成脂分化能力的观察
分别取上述两种第3代细胞,以1×106/mL的密度接种于6孔培养板,常规培养至细胞扩增达90%以上时,更换成脂诱导液(含0.25 μmol/L地塞米松、100 mmol/L吲哚美辛、0.5 mmol/L IBMX、10 mg/L胰岛素的α-MEM)进行成脂诱导培养14d后,弃培养液,40g/L多聚甲醛液固定;油红O染色,镜下观察、拍照;并用图像分析软件计算脂滴面积。
1.3.4.3 成软骨分化能力的观察
分别取上述两种第3代细胞,制成密度为6×106/mL的细胞悬液,经高速离心成细胞团后,加入成软骨诱导液(含上述两种10 nmol/L地塞米松、10 ng/mL TGF β1、10 μg/mL 胰 岛 素 的α-MEM)进行成软骨诱导培养。21d后取细胞团包埋并制作切片,HE和甲苯胺蓝染色,镜下观察、拍照;并用图像分析软件计算软骨面积。
1.4 统计学分析
使用SPSS 17.0软件进行统计分析,两独立样本均数比较用t检验,检验水准α=0.05。
2 结果
2.1 两种PDLSCs形态和克隆形成率比较
组织块法原代培养3~7d,组织块周围即有细胞爬出。传代培养的两种PDLSCs均为典型的纺锤形,成簇螺旋生长,培养3d后细胞可达到90%汇合。有限稀释单克隆挑选培养14d后,P-PDLSCs的克隆形成率约为40%(图1a~c),高于H-PDLSCs的28%(图1d~f),差异有统计学意义(P <0.05)。
2.2 两种PDLSCs细胞表面分子的比较
纯化后的H-PDLSCs和 P-PDLSCs,均表达间充质干细胞特有的表面标志物STRO-1和 CD-146(图2),两组差异无统计学意义(P>0.05)。
2.3 两种PDLSCs细胞增殖能力的比较
Edu染色显示核红染的细胞为阳性细胞,即为正在增殖的细胞。经计数,P-PDLSCs的阳性率为35%,H-PDLSCs的阳性率为20%,两组差异有统计学意义(P <0.05)(图3)。
2.4 两种PDLSCs成骨分化能力的比较
两种细胞经成骨诱导培养7d后,复层生长的PDLSCs基质中可见褐色结节,随着诱导时间的延长,褐色结节的数量逐渐增多。于培养21d时,茜素红染色定量分析显示,P-PDLSCs所形成矿化结节的数目明显少于H-PDLSCs(图4),两组差异具有统计学意义(P<0.05)。
2.5 两种PDLSCs成脂分化能力的比较
两种细胞经成脂诱导培养7d后,即可见细胞中有黄色小脂滴出现,主要集中于细胞核周围。诱导14d时,油红 O染色可见脂滴呈橘红色;其中P-PDLSCs形成的脂滴颗粒小且分散,而H-PDLSCs形成的脂滴较大且多(图5);成脂量化分析显示,两组差异具有统计学意义(P<0.05)。
2.6 两种PDLSCs成软骨分化能力的比较
两种细胞经成软骨诱导培养21d时HE和甲苯胺蓝染色显示,细胞体积变大,形态由长梭形变为类圆形,即为软骨样细胞(图6);成软骨量化分析显示,H-PDLSCs软骨形成的面积多于P-PDLSCs,差异具有统计学意义(P <0.05)。
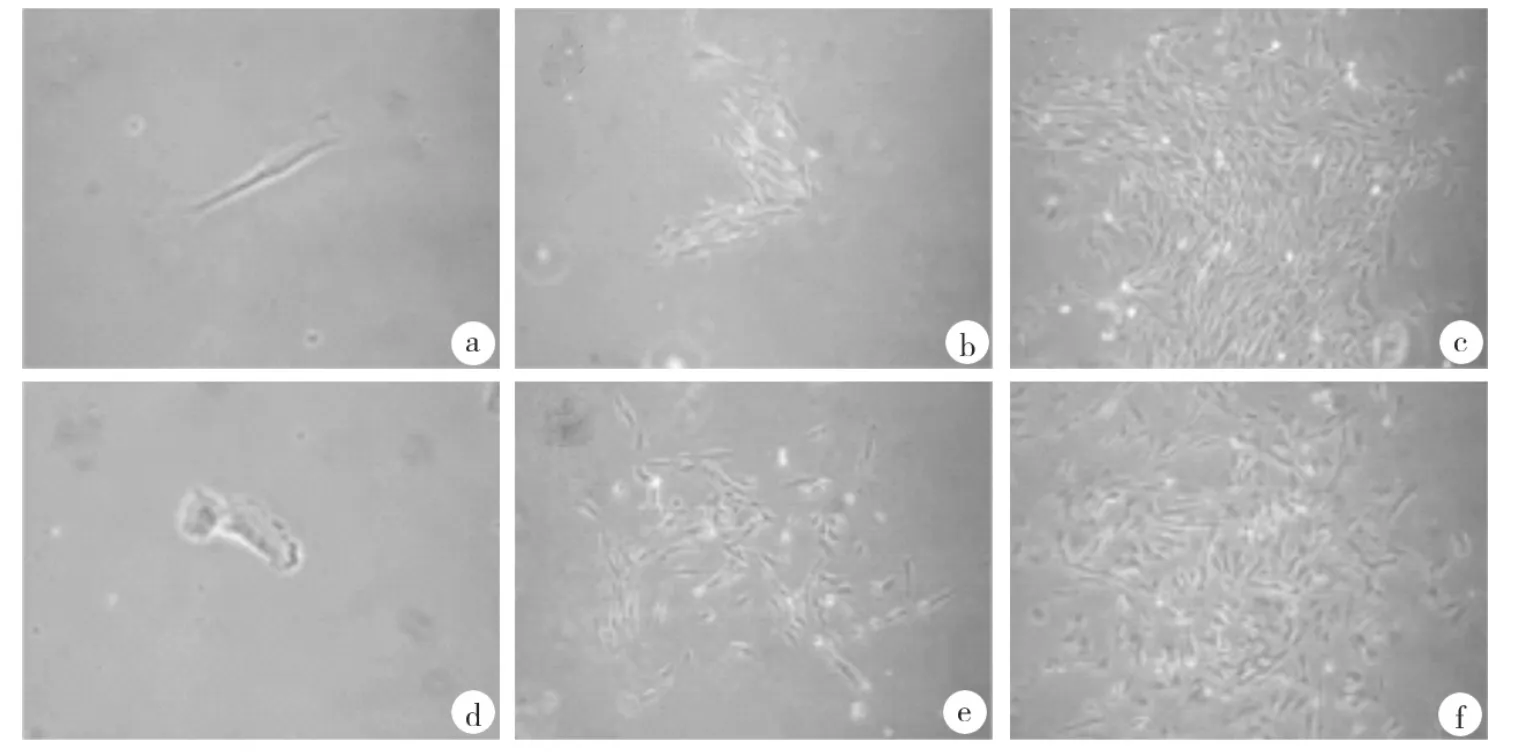
图1 两种PDLSCs形态及克隆形成情况(×20)
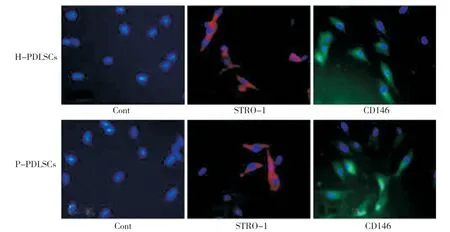
图2 两种PDLSCs STRO-1和CD146的表达情况比较(细胞免疫荧光,×40)
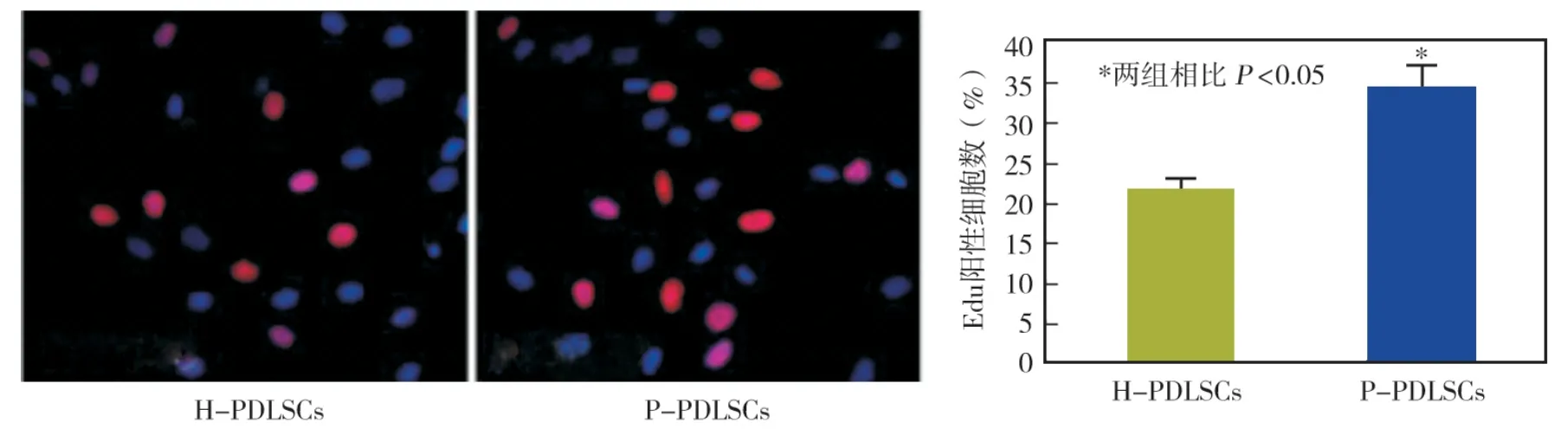
图3 两种PDLSCs增殖能力的比较(Edu染色,×40)
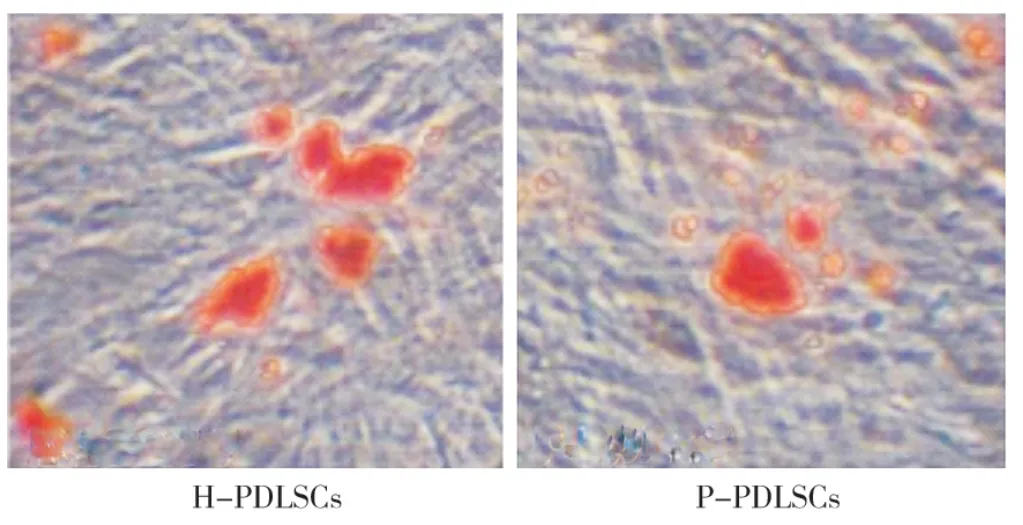
图4 两种PDLSCs成骨能力比较(茜素红染色,×100)

图5 两种PDLSCs成脂能力比较(油红O染色,×100)
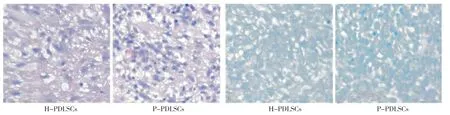
图6 两种PDLSCs成软骨能力的比较(HE、甲苯胺蓝染色,×40)
3 讨论
PDLSCs是存在于牙周组织中的成体干细胞,具有自我更新和多向分化的潜能。当牙周组织受到损伤时,PDLSCs能大量增殖并分化使牙周组织得以再生和修复。然而,慢性牙周炎患者的牙周组织受炎性破坏后,PDLSCs则不完全具备足够的对抗病变的增殖和再生能力。研究证实,干细胞周围局部微环境(即干细胞巢)对干细胞的定位、数目和生物学功能都具有重要的调控作用[5]。Schneider等[6]研究发现,分离自老年个体的骨髓基质干细胞(BMMSCs)的增殖和分化能力均低于分离自年轻个体的干细胞。另有研究表明,微环境异常会导致干细胞的功能缺陷,从而引起疾病的发生[7]。慢性炎症微环境中存在的各种炎性因子均会影响内源性干细胞的生物学特性。有研究显示,外伤引起的炎症能降低神经干细胞的分化能力,如通过控制炎症的发展则能恢复神经干细胞的再生潜能[8-9]。另有研究表明,持续性的慢性炎症环境可使干细胞的增殖和迁移能力下降,并通过改变干细胞内在分子通路抑制其组织再生修复的潜能[10-11]。
本实验结果显示:慢性牙周病患者的牙周膜中亦存在PDLSCs,并具有与H-PDLSCs相同的细胞形态;而且也表达间充质干细胞特有的表面标志物STRO-1和CD-146。通过对两种细胞增殖能力的比较发现,P-PDLSCs的增殖能力明显高于H-PDLSCs,但其多向分化潜能则低于H-PDLSCs。该结果提示PDLSCs生物学特性的变化可能与牙周炎症微环境中炎症因子的改变密切相关。Kastrinaki MC等[12]报道,从风湿性关节炎患者分离出的BMMSCs,其多向分化能力低于从正常个体分离出的BMMSCs,与本实验结果一致。但本研究只是从现象上观察了慢性牙周炎症微环境对其PDLSCs增殖和分化能力的影响,其具体影响机制尚不清楚,有待更深入的研究。
[1]Pihlstrom BL,Michalowicz BS,Johnson NW.Periodontaldiseases[J].Lancet,2005,366(9499):1809-1820.
[2]Löoe H.Principles of aetiology and pathogenesisgoverning the treatment of periodontaldisease[J].Intdent J,1983,33(2):119-126.
[3]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149-155.
[4]Liu Y,Zheng Y,Dingg,et al.Periodontal ligament stem cell-mediated treatment for periodontitis in miniature swine[J].Stem cells,2008,26(4):1065-1073.
[5]Li L,Xie T.Stem cell niche:structure and function[J].Annu Rev Celldev Biol,2005,(21):605-631.
[6]Schneider EL,Mitsui Y.The relationship between in vitro cellular aging and in vivo human age[J].Proc Natl Acad Sci USA,1976,73(10):3584-3588.
[7]Sun LY,Zhang HY,Feng XB,et al.Abnormality of bone marrow-derived mesenchymal stem cells in patients with systemic lupus erythematosus[J].Lupus,2007,16(2):121-128.
[8]Monje ML,Mizumatsu S,Fike JR,et al.Irradiation induces neural precursor-celldysfunction[J].Nat Med,2002,8(9):9559-9562.
[9]Monje ML,Toda H,Palmer TD.Inflammatory blockade restores adult hippocampal neurogenesis[J]. Science,2003,302(5651):1760-1765.
[10]Pluchino S,Muzio L,Imitola J,et al.Persistent inflammation alters the function of the endogenous brain stem cell compartment[J].Brain,2008,131(10):2564-2578.
[11]Wang Y,Imitola J,Rasmussen S,et al.Paradoxicaldysregulation of the neural stem cell pathway sonic hedgehog-Gli1 in autoimmune encephalomyelitis and multiple sclerosis[J].Ann Neurol,2008,64(4):417-427.
[12]Kastrinaki MC,Sidiropoulos P,Roche S,et al.Functional,molecular and proteomic characterisation of bone marrow mesenchymal stem cells in rheumatoid arthritis[J].Ann Rheumdis,2008(67):741-749.
The effects of chronic inflammation in periodontal microenvironment on the characteristics of human periodontal ligament stem cells
LIU Ya-li*,LIU Wen-jia,HU Cheng-hu,DIN Yin,JIN Yan
(*School of Stomatology,Kunming Medical University,Kunming 650031,China)
AIM:To investigate the effects of chronic periodontal inflammatory microenvironment on the biological characteristics of periodontal ligament stem cells(PDLSCs).METHODS:PDLSCs were isolated by the limiteddilution technique from the periodontal ligament tissue of healthy individuals and the patients with periodontitits respectively(H-PDLSCs and P-PDLSCs).The proliferation and clone formation of the cells were studied by Edu staining and clone formation assay,the osteogenic,adipogenic and chondrogenicdifferentiation wasdetermined by multi-directionaldifferentiation assay.RESULTS:PDLSCs were successfully obtained from the periodontal ligament tissue of both healthy individuals and the patients with periodontitis.P-PDLSCs exhibiteddecreased multipotentdifferentiation potential and increased proliferation ability compared with H-PDLSCs(P <0.05).CONCLUSION:The chronic inflammatory microenvironment may inhibite thedifferentiation potential of PDLSCs.
periodontal ligament stem cells(PDLSCs);chronic periodontal inflammation;microenvironment
R781.4
A
1005-2593(2014)01-0021-05
2013-02-17
国家自然科学基金资助项目(31030033)
刘亚丽(1978-),女,汉族,云南人。博士,副教授
丁 寅,E-mail:dingyin@fmuu.edu.cn
金 岩,E-mail:yanjin@fmmu.edu.cn

