肝硬化急性肾损伤诊治进展
于乐成,汪茂荣,何长伦
急性肾损伤(acute kidney injury,AKI)是肝硬化最严重的并发症之一,在肝硬化住院患者中的发病率约为19%[1],是预后不良的重要征兆和死亡的独立预测参数[2-3]。近年来推出了肝硬化AKI 的诊断新标准,对其分类、进展规律、预后及防治等也有了不少新认识。本文对此进行综述。
1 肝硬化AKI的定义、病因及分类
1.1 定义和病因 肝硬化AKI 是指肝硬化时由多种原因引起的AKI,可分为功能性AKI 和结构性AKI[2]。据估计,肝硬化AKI 约68%为功能性AKI,归因于多种原因引起的急性肾脏低灌注,或在慢性肾脏低灌注的基础上出现低灌注急性加剧,严重时可发生肝肾综合征(hepatorenal syndrome,HRS);约32%为结构性AKI,主要是多种原因导致的急性肾小管坏死(acute tubular necrosis,ATN)[1]。肝硬化背景下诱发AKI 的病因主要为①血容量不足:绝对不足见于大出血、腹泻、过度利尿和大量放腹水等,相对不足见于严重肝硬化门脉高压的特殊血流动力学异常,以及不适当应用非利尿性降压药物等;②感染:包括自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP)在内的各种脓毒症;③其他原因引起的严重全身反应综合征;④肾毒性药物的应用:如非甾体抗炎药、氨基糖苷类药物及放射造影剂等[2,4-6]。
1.2 分类 肝硬化高排低阻的特殊血流动力学改变可引起肾前性AKI、Ⅰ型HRS 和ATN 这3 种类型的AKI[6]。其中,Ⅰ型HRS 是一种特殊形式的AKI,是肝硬化失代偿期(尤其是伴利尿剂抵抗性腹水)和急性肝衰竭最严重的并发症之一[4,6-7]。肝硬化失代偿期患者全身特别是内脏小动脉扩张,外周阻力降低,心输出量代偿性增加。当心输出量不能代偿时,出现动脉充盈不足,反射性引起体内缩血管系统激活,导致强烈的肾血管收缩,引起肾灌注降低及肾小球滤过率(glomerular filtration rate,GFR)下降,出现HRS。HRS 对扩容缺乏应答,即使给予特利加压素、人血白蛋白和透析等治疗,预后也极差[7]。区分上述3 种异常血流动力学相关的AKI 对肝硬化的预后和治疗具有重要意义,但因临床上表现多相似,且相互间可转化或共存,因此鉴别常较困难。
HRS 通常分为Ⅰ型和Ⅱ型[5,8],有建议增列Ⅲ型HRS[6]。Ⅰ型HRS 的特点是2 周内肾功能迅速恶化,伴血清肌酐(Scr)自基线升高超过100%至>2.5 mg/dl(220 μmol/L)。Ⅰ型HRS 可有或无Ⅱ型HRS 基础[6]。Ⅱ型HRS 属于慢性肾衰竭,发生于肝硬化顽固性腹水患者,呈相对稳定的中度肾衰竭(1.5 mg/dl≤Scr<2.5 mg/dl)[6,8]。进展期肝硬化确诊后1年和5年HRS 的发病率分别约为18%和40%,未经治疗的Ⅰ型和Ⅱ型HRS 患者的中位生存时间分别为2 周和4~6 个月[5]。此外,虽然HRS 理论上被定义为功能性而非结构性病变,但经颈静脉肾活体组织检查(活检)显示,相当一部分临床诊断为HRS 的患者其肾脏存在固有的急性或慢性结构性改变,特别是由并存病或慢性缺血引起的肾小管间质性损伤[9]。即使肝移植后这些结构性改变也不能完全消失[7]。因此有建议将此类HRS 列为Ⅲ型[6]。这类HRS 患者在肝移植后仍可出现不可逆转的肾衰竭,因此有必要考虑肝肾联合移植[7]。
为了更合理地区分肝硬化背景下的各种肾损伤,近年提出分为AKI、慢性肾病(chronic kidney disease,CKD)和慢加急性肾病(acute-on-chronic kidney disease,AOCKD),AOCKD 指在原有CKD 的基础上叠加AKI[10]。这种新的分类方法已逐渐得到认可。肝硬化时可能伴有的CKD 包括低灌注引起的Ⅱ型HRS、HCV/HBV 相关的肾小球肾炎、糖尿病肾病、IgA 肾病及其他免疫性肾病等[6]。国际急性透析质量倡议协会(Acute Dialysis Quality Initiative,ADQI)建议采用美国肾病/透析临床实践指南推荐的标准诊断肝硬化背景下的CKD[5,10]。伴CKD 的肝硬化患者可能更易发生肾损伤急性恶化[11]。
新近由肝病、肾病及重症监护专家组成的工作小组建议使用“肝病伴肾病(hepatorenal disorder,HRD)”一词来描述肝硬化背景下任何类型的肾疾病[5,7]。在诊断未明确前,统称为HRD。这种策略有助于保持警惕,以便对肝硬化肾损伤的病因和种类进一步鉴别[12](图1)。同时应注意同一患者可能混杂存在多种肾损伤[9]。
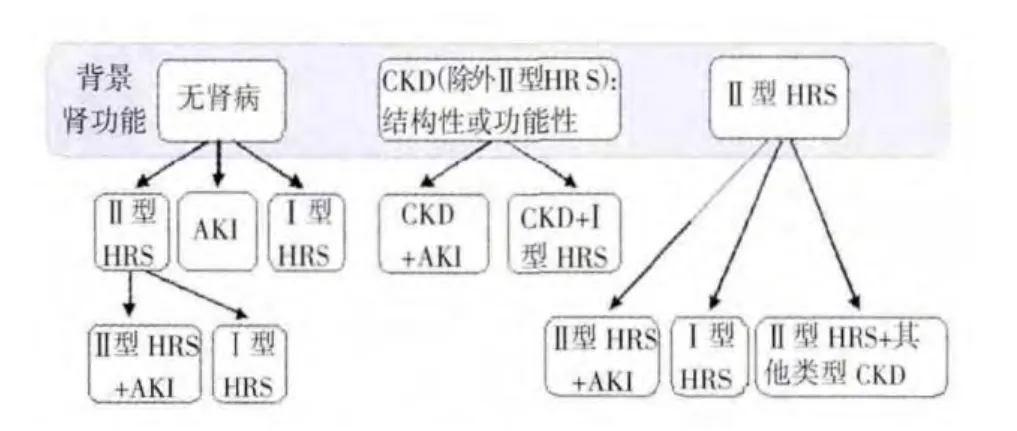
图1 进展期HRD 疾病谱[12]Figure1 Spectrum of HRD under the background of advanced liver cirrhosis[12]
临床研究中还发现许多肝硬化患者存在慢性GFR 减低,这是对持续肾脏低灌注的反应。在肾脏灌注恢复后,肾功能可部分恢复[2]。对这种肝硬化相关的“慢性低灌注性GFR 降低”可借用基于Scr测定的CKD 流行病学协作方程式估算GFR,如<90 ml/min 可视为GFR 减低。可通过肾脏B 超、尿沉渣及蛋白尿检查、甚至肾活检等与某些CKD 的“结构性肾损伤”所引起的GFR 降低相鉴别[13]。
2 肝硬化AKI 的诊断和分期
2.1 传统诊断标准及其不足 长期以来,肝硬化AKI 缺乏统一标准的定义,成为制约相关研究最重要的因素之一。Scr 是临床上最常用的判断肾功能的指标,也是计算终末期肝病模型(model for endstage liver disease,MELD)的重要参数之一。因此,既往研究多将肝硬化背景下的肾功能减退定义为Scr 高于正常上限值(upper limit of normal,ULN),即>1.5 mg/dl。以此标准统计的肝硬化AKI 的病死率可达55%~91%[2]。
然而,这种AKI 诊断标准有内在的不敏感性,在反映肝硬化背景下GFR 的改变时更是一大突出问题[14],因为仅在GFR 显著下降后Scr 才能升达上述界值。有证据显示,较小幅度的肾功能递减与不良临床后果相关,因此诊断肝硬化AKI 的Scr 界值应当调低[2]。肝硬化患者常存在肌肉萎缩,肝脏将肌酸转化为肌酐的能力减弱,因此表面的Scr 正常可掩盖潜在但显著的肾功能不全,而这种风险又与肝硬化患者易发生AKI 的特性同时存在。中晚期肝硬化除可诱导功能性肾血流持续减少外,还可削弱肾脏通过“管球反馈”保持肾灌注的能力。在此背景下,与治疗相关的频繁容量改变将加速并加剧AKI发作,而这难以被传统的AKI 定义所诊断。因此,若单纯依赖Scr 高于ULN 来诊断AKI,将导致只有最严重的病例才能被超选(overselection)出来,必然限制对疾病进展影响因素的分析以及AKI 严重程度对疾病后果影响的评估[2]。不过,在获得更理想的替代指标之前,任何改良的AKI 诊断标准仍需基于Scr 的测定[5]。
2.2 最新诊断标准及分期 鉴于上述原因,国际腹水俱乐部(Internatinal Acites Club,IAC)和ADQI 组成的工作小组建议采用急性肾损伤网(AKI network,AKIN)制定的标准诊断肝硬化时所有的急性肾功能恶化,而不管其病因学如何(表1)[2,5,10,15]。根据AKIN 标准,若肝硬化患者迅速(48 h 内)出现Scr较基线升高0.3 mg/dl 或达到基线的1.5 倍,或尿量<0.5 ml/(kg·h)超过6 h,即可诊断AKI[2]。这一改良标准有助于筛选出Scr 正常但GFR 已轻度下降的患者,不仅有助于及早识别AKI 和早期启动特异性治疗,还有助于在肝硬化背景下从AKI、CKD 和AOCKD 等更广的病因谱内鉴别肾损伤类型[5,7]。Ⅰ型HRS 作为一种特殊类型的AKI,IAC/ADQI 工作小组建议仍保留Scr>2.5 mg/dl 为诊断标准[10]。

表1 AKIN 的AKI 分类/分期系统[2,5,10,15]Table1 Classification of AKI designated by AKIN[2,5,10,15]
AKIN 标准实际上是“风险、损伤、衰竭、丧失和终末期肾病(risk,injury,failure,loss,and end stage kidney disease,RIFLE)”诊断标准的改良版(表2)[5,16-17]。二者主要参数完全一致,AKIN 标准的1、2、3 期分别对应RIFLE 标准的R、I、F 期,在评价住院AKI患者的病死率和相关危险因素方面完全等效[18]。
2.3 AKI、CKD 和AOCKD 诊断比较 鉴于肝硬化时的肾损伤不仅可能是AKI,还可能是CKD 和AOCKD,国际上将这三者的诊断标准规定如下(表3)[5,10]。
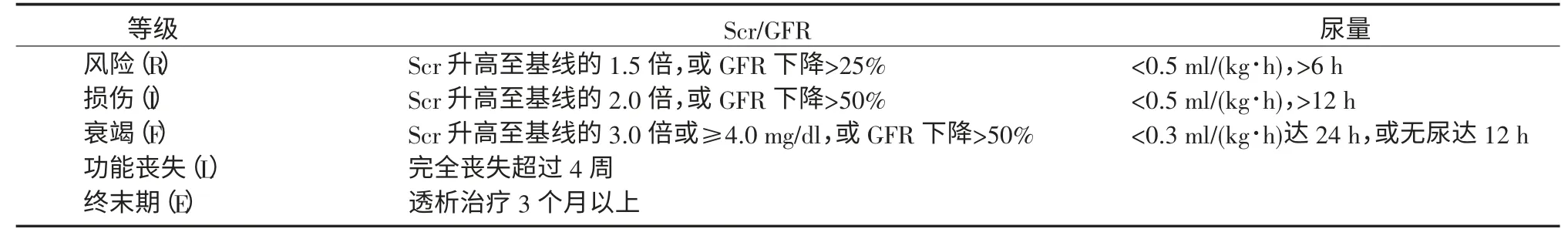
表2 RIFLE 的AKI 诊断标准[7,16-17]Table2 Diagnostic criteria of AKI in the RIFLE system[7,16-17]

表3 肝硬化时不同类型肾损伤的诊断[5,10]Table3 Diagnosis of various types of AKI in the background of liver cirrhosis[5,10]
2.4 HRS 的改良诊断标准 1996年曾提出一套HRS 诊断标准,对扩容缺乏应答是其中心要素。后来发现该标准过于苛刻,例如须排除持续进展的细菌感染,但实际上HRS 常常由细菌感染所触发。因此2007年进行了修订,减少了一些不合理的诊断限制:①肝硬化伴腹水;②Scr>1.5 mg/dl(133 μmol/L);③在停用利尿剂和以人血白蛋白进行扩容治疗至少2 d 后,Scr 无改善(不能降至1.5 mg/dl 以下),人血白蛋白推荐剂量为1 g/(kg·d),最多不超过100 g/d;④没有休克;⑤最近或当前未使用肾毒性药物;⑥无肾脏实质性疾病[肾脏实质性疾病判断标准为蛋白尿>500 mg/d,镜下血尿>50 个红细胞/高倍视野,和(或)肾脏超声检查形态异常][12]。但修订后的标准仍存在与临床事实不符的方面[9]。例如“无肾脏实质性疾病”这一限制就存在争议[6-7,9]。
2.5 诊断肝硬化AKI 的其他参数
2.5.1 碘海醇清除率 Francoz 等[14]对157例肝硬化失代偿期患者进行肝移植术前评估显示,Scr<1 mg/dl 的患者以碘海醇清除率测定的GFR 为每1.73 m2体表面积34~163 ml/min。基于实测GFR 为参数的模型对患者预后判断的准确性高于基于Scr为参数的MELD,基于Scr 计算的GFR 高于实际的GFR,尤其是对年龄<50 岁或有腹水的患者。因此碘海醇清除率对AKI 的诊断价值优于Scr 测定。
2.5.2 胱抑素C(cystatin C,CyC) CyC 是一种反映肾功能变化的新指标。Chung 等[19]分析了53例肝硬化患者的CyC、Scr 和24 h Scr 清除率以判断其肾功能,单变量分析显示CyC 和Scr 均为AKI 的预测因子,诊断准确性分别为0.698(P=0.063)和0.735(P=0.028),多元分析显示仅血清CyC 是AKI 的独立预测因子。CyC>1.23 mg/L 对AKI 诊断的灵敏度和特异度分别为66%和86%,同时也是短期病死率的较好预测指标。血清CyC 水平与MELD 及MELDNa 评分正相关,提示血清CyC 对肝硬化AKI 的发病率及病死率的预测准确度优于Scr。
Slack 等[11]的一项小型前瞻性队列研究也显示,CyC、碘海醇清除率实测的GFR、尿蛋白/尿肌酐比值均能较好地用于诊断肝硬化AKI。
3 肝硬化AKI 及其进展对预后影响
AKI 对肝硬化的预后具有重要价值[2,16,20]。AKI进展对预测死亡的准确度引人注目(血浆药物浓度曲线下面积高达0.74,病死率达到惊人的近4 倍升高),而AKI 早期改善者的病死率下降[2]。
Cholongitas 等[16]的一项大型队列研究提示肝硬化患者的病死率与AKI 分期相关:412例收住重症监护室(intensive care unit,ICU)的肝硬化患者,无AKI 患者的病死率为42.5%,达到RIFLE-R 和RIFLE-I/F 患者的病死率分别为71%和88%;轻度AKI(RIFLE-R)患者病死率的显著升高提示这些敏感的诊断标准有助于判断患者的预后。Jenq 等[20]分析了134例入住ICU 的肝硬化患者,其中无AKI 患者的病死率为32.1%,而达到RIFLE-R、RIFLE-I和RIFLE-F 的病死率分别为68.8%、71.4%和94.8%。这2 项研究仅限于ICU,患者往往有多器官衰竭和严重脓毒症。
新近Belcher 等[2]报道一项多中心、前瞻性、观察性、大样本队列研究,采用AKIN 标准诊断肝硬化AKI,涉及ICU、移植科和肝病科住院病房。入组192例,总病死率为26%,显著低于用传统的不敏感的AKI 定义或局限于单中心ICU 所获得的病死率。AKIN 最高分期(含稳定在某期和进展至某期)达1、2、3 期的患者分别为26%、24%、49%,住院病死率分别为2%、15%、44%。稳定于1、2、3 期的患者,病死率分别为2.1%(1/48)、6.7%(2/30)、21.4%(6/28),而进展至2 期、3 期、需要透析患者的病死率分别为29.4%(5/17)、33.3%(7/21)、62.2%(28/45)。初始符合AKI 诊断标准的患者有83例进展到了更高的AKIN 分期,AKI 无进展、进展1 期、进展2 期、进展至需透析患者的病死率分别为9.3%(10/107)、25.0%(7/28)、50.0%(5/10)、62.2%(28/45)。AKI 的初始级别和进展级别均与病死率独立相关,AKI 最高分期级别在死亡组高于存活组(P<0.0001)。感染(包括SBP)、腹水和肝性脑病等的发病率随AKI 分期的提高而增大。
Pan 等[21]推出一种由4 项独立预测指标构成的评分系统:①平均动脉压(MAP)不足80 mmHg(1 mmHg=0.133 kPa),1 分;②胆红素>80 μmol/L,1 分;③呼吸衰竭,1 分;④脓毒症,1 分。对190例肝硬化AKI 的ICU 患者的研究表明,分值与患者的预后有良好相关性。
4 肝硬化AKI 的防治
肝硬化AKI 患者应尽量避免使用肾损伤药物,积极控制感染,改善肝功能和门脉高压,防止食管胃曲张静脉破裂出血,避免过度利尿和大量放腹水,积极纠正血容量绝对或相对不足,维持血流动力学稳定,改善肾脏低灌注状态[12]。如处理得当,有望预防或缓解AKI 的进展和ATN 的发生[2]。
对HRS 患者推荐给予人血白蛋白1 g/(kg·d),最大剂量为100 g/d,连续2 d;之后改为20~40 g/d[12,22];同时联用血管收缩剂,首选特利加压素(表4)[12,23-24]。若不接受肝移植,建议避免肾替代治疗,以防加重血流动力学紊乱。当前尚缺乏有力的循证医学数据证明人工肝治疗对Ⅰ型HRS 的有效性,因此不建议临床用于救治Ⅰ型HRS(实验研究除外)。对于病程不超过4 周的Ⅰ型HRS,可考虑肝移植;若经评估发生顽固性肾衰竭的风险极大,可考虑肝肾联合移植[12,22]。对于Ⅱ型HRS 伴顽固性腹水须持续放腹水治疗者,可考虑经颈静脉肝内门体分流术[12]。
有资料显示,开始治疗时Scr 水平越高,对特利加压素的应答越低[22]。因此,只要发现肝硬化患者Scr 较基线升高并达到AKI 诊断标准,即可考虑尽早应用人血白蛋白┼特利加压素,而不必等到Scr超过ULN(>1.5 mg/dl)时才开始治疗[2,25]。若无明确的ATN 或其他内在肾相关疾病的证据,所有AKI进展的患者均应接受血管收缩剂治疗[2]。
5 总结和展望
总之,肝硬化时肾损伤的病因和种类复杂多样,须要加以认真鉴别。肝硬化AKI 的存在及其进展与病死率密切相关。对肝硬化AKI 应采用AKIN或RIFLE 标准进行诊断,并在今后出现比Scr 更灵敏、更准确的新参数时进行修订。及早识别肝硬化AKI 并针对病因和发病机制给予积极治疗,有望减缓病情进展,改善临床结果。今后有必要在统一诊断标准下对肝硬化AKI 开展进一步的多中心、大样本、前瞻性临床研究,以期更好地甄别肝硬化AKI的种类、优化诊断标准和探索个性化防治方案。

表4 HRS 时血管收缩剂的应用[12]Table4 Application of vasoconstrictors in patients with HRS[12]
[1] Garcia-Tsao G,Parikh CR,Viola A.Acute kidney injury in cirrhosis[J]. Hepatology,2008,48(6):2064-2077.
[2] Belcher JM,Garcia-Tsao G,Sanyal AJ,et al. Association of AKI with mortality and complications in hospitalized patients with cirrhosis[J].Hepatology,2013,57(2):753-762.
[3] Tandon P,Garcia-Tsao G. Renal dysfunction is the most important independent predictor of mortality in cirrhotic patients with spontaneous bacterial peritonitis[J].Clin Gastroenterol Hepatol,2011,9(3):260-265.
[4] Fukazawa K,Lee HT. Updates on Hepato-Renal Syndrome[J]. J Anesth Clin Res,2013,4(9):352.
[5] Nadim MK,Kellum JA,Davenport A,et al. Hepatorenal syndrome:the 8th International Consensus Conference of the Acute Dialysis Quality Initiative(ADQI)Group[J].Crit Care,2012,16(1):R23.
[6] Hartleb M,Gutkowski K. Kidneys in chronic liver diseases[J].World J Gastroenterol,2012,18(24):3035-3049.
[7] Francoz C,Durand F.A new look at renal dysfunction in the cirrhotic patient[J].Crit Care,2012,16(2):118.
[8] Ginès P,Schrier RW. Renal failure in cirrhosis[J].N Engl J Med,2009,361(13):1279-1290.
[9] Trawalé JM,Paradis V,Rautou PE,et al. The spectrum of renal lesions in patients with cirrhosis: a clinicopathological study[J].Liver Int,30(5):725-732.
[10] Wong F,Nadim MK,Kellum JA,et al.Working Party proposal for a revised classification system of renal dysfunction in patients with cirrhosis[J].Gut,2011,60(5):702-709.
[11] Slack AJ,McPhail MJ,Ostermann M,et al. Predicting the development of acute kidney injury in liver cirrhosis--an analysis of glomerular filtration rate,proteinuria and kidney injury biomarkers[J].Aliment Pharmacol Ther,2013,37(10):989-997.
[12] Salerno F,Gerbes A,Ginès P,et al. Diagnosis,prevention and treatment of hepatorenal syndrome in cirrhosis[J].Gut,2007,56(9):1310-1318.
[13] Levey AS,Stevens LA,Schmid CH,et al.A new equation to estimate glomerular filtration rate[J]. Ann Intern Med,2009,150(9):604-612.
[14] Francoz C,Prié D,Abdelrazek W,et al. Inaccuracies of creatinine and creatinine-based equations in candidates for liver transplantation with low creatinine:impact on the model for end-stage liver disease score[J].Liver Transpl,2010,16(10):1169-1177.
[15] Mehta RL,Kellum JA,Shah SV,et al.Acute Kidney Injury Network:report of an initiative to improve outcomes in acute kidney injury[J].Crit Care,2007,11(2):R31.
[16] Cholongitas E,Calvaruso V,Senzolo M,et al. RIFLE classification as predictive factor of mortality in patients with cirrhosis admitted to intensive care unit[J].J Gastroenterol Hepatol,2009,24(10):1639-1647.
[17] Wahrhaftig KM,Correia LC,Matias D,et al. Does the RIFLE Classification Improve Prognostic Value of the APACHE II Score in Critically Ill Patients?[J].Int J Nephrol,2013:406165.
[18] 段绍斌,刘庆,潘鹏,等. RIFLE 和AKIN 标准在评价住院急性肾损伤患者病死率及其相关危险因素中的应用[J].中南大学学报医学版,2013,38(12):1243-1253.
[19] Chung MY,Jun DW,Sung SA. Diagnostic value of cystatin C for predicting acute kidney injury in patients with liver cirrhosis[J].Korean J Hepatol,2010,16(3):301-307.
[20] Jenq CC,Tsai MH,Tian YC,et al.RIFLE classification can predict short-term prognosis in critically ill cirrhotic patients[J].Intensive Care Med,2007,33(11):1921-1930.
[21] Pan HC,Jenq CC,Tsai MH,et al.Risk models and scoring systems for predicting the prognosis in critically ill cirrhotic patients with acute kidney injury: a prospective validation study[J]. PLoS One,2012,7(12):e51094.
[22] Hiremath SB,Srinivas LD.Survival benefits of terlipressin and nonresponder state in hepatorenal syndrome: a meta-analysis[J].Indian J Pharmacol,2013,45(1):54-60.
[23] Moreau R,Lebrec D. Acute kidney injury: new concepts. Hepatorenal syndrome: the role of vasopressors[J]. Nephron Physiol,2008,109(4):p73-p79.
[24] 刘海霞,李娟,姚勤伟,等.特利加压素治疗肝硬化失代偿期并发肝肾综合征疗效观察[J]. 传染病信息,2010,23(2):90-92,107.
[25] Boyer TD,Sanyal AJ,Garcia-Tsao G,et al. Predictors of response to terlipressin plus albumin in hepatorenal syndrome(HRS) type 1:relationship of serum creatinine to hemodynamics[J]. J Hepatol,2011,55(2):315-321.

