花生根乙醇提取物对大鼠前列腺增生抑制作用及对Bcl-2,Bax蛋白表达影响的研究
闫学红,罗晓冰,卑占宇△,马永超
(1.河南省漯河市召陵区人民医院,河南漯河 462002;2.漯河医学高等专科学校药学系,河南漯河 462002)
花生根乙醇提取物对大鼠前列腺增生抑制作用及对Bcl-2,Bax蛋白表达影响的研究
闫学红1,罗晓冰2,卑占宇2△,马永超2
(1.河南省漯河市召陵区人民医院,河南漯河 462002;2.漯河医学高等专科学校药学系,河南漯河 462002)
目的探讨花生根乙醇提取物对丙酸睾酮(TP)诱导未去势成年大鼠前列腺增生的抑制作用及其机制。方法 将60只SD大鼠随机分为对照组、模型组及花生根乙醇提取物高、中、低剂量治疗组,其中对照组大鼠正常喂饲,不用药;模型组及各治疗组皮下注射TP 5mL•kg-1•d-1,高、中、低剂量治疗组同时灌胃不同剂量的花生根乙醇提取物(剂量分别为10mL•kg-1•d-1、5mL•kg-1•d-1、1mL•kg-1•d-1),连续14d。各组均于第15d处死,取前列腺、精囊和睾丸组织并称重,计算各腺体指数[腺体湿质量(mg)/体质量(g)];采用免疫组织化学法检测各组大鼠前列腺组织Bcl-2和Bax蛋白的表达。结果花生根乙醇提取物高、中剂量治疗组与模型组比较,前列腺指数差异均有统计学意义(P0.01);低剂量组与模型组比较,差异无统计学意义(P0.05),花生根乙醇提取物抑制前列腺增生作用具有量效关系。花生根乙醇提取物高、中、低剂量组与模型组比较,睾丸指数、精囊指数、体质量变化差异无统计学意义(P0.05)。花生根乙醇提取物高、中、低剂量治疗组Bcl-2和Bax蛋白表达率与模型组比较,差异有统计学意义(P0.05);与对照组Bcl-2和Bax蛋白表达比较,差异无统计学意义(P0.05)。结论花生根乙醇提取物具有良好的抑制前列腺增生作用,其机制可能是通过调节凋亡基因的Bcl-2和Bax蛋白比例平衡关系,促进良性前列腺增生(BPH)的细胞凋亡达到治疗的效果。
植物提取物;花生根;前列腺增生;大鼠;细胞凋亡;Bcl-2;Bax
良性前列腺增生(benign prostatic hyperplasia,BPH)是老年男性常见疾病、多发病,随着全球人口的老龄化,其发病率不断增高。迄今为止,BPH的发病机制尚不完全清楚[1]。有研究认为,BPH的发生除与增殖基因、凋亡基因及抗凋亡基因的异常表达有关之外。很可能还与雄、雌激素的失衡和各种生长因子的相互作用有关[2]。老年人雄激素水平下降后抗凋亡基因Bcl-2的高表达致使前列腺细胞凋亡下降很可能是发生BPH的主要因素[2]。目前,手术治疗BPH疗效显著,但给患者造成一定的损伤。寻求药物治疗,特别是植物药治疗,以其注重整体、治补兼具、不良反应小、疗效稳定持久的优势备受人们的关注。民间有“单方一味——花生根”中药单方治愈男性前列腺肥大,效果良好[3]。本文探讨花生根乙醇提取物对大鼠前列腺增生抑制作用及对前列腺组织Bcl-2和Bax蛋白表达的影响,现报道如下。
1 材料与方法
1.1 材料 (1)花生根乙醇提取物的制备:将刚刚采收后弃置田间的新鲜花生根(采自赣州市赣县)洗净晾干粉碎,取500g,加体积分数60%的乙醇1 000mL作为提取剂,煮沸回流30min,冷却抽滤,得到滤液。滤液经减压蒸馏回收乙醇,得无醇味的浓缩提取物。提取物加双蒸水至50mL使药液(灌胃时注意震荡摇匀)相当于生药10.0g/mL,置冰箱中备用。(2)试验动物:雄性SD大鼠60只,体质量180~200g,SPF级,由江西中医学院动物中心提供。(3)药物与试剂:丙酸睾酮(TP)注射液25mg/mL,购自上海通用药业股份有限公司。羊抗兔SABC试剂盒、DAB显色试剂盒,兔抗大鼠Bcl-2及Bax单克隆抗体,由武汉博士德生物工程有限公司提供。
1.2 方法
1.2.1 动物分组及模型制备 将大鼠按体质量随机分为5组,即对照组、模型组及花生根乙醇提取物高、中、低剂量治疗组,每组12只。对照组:正常喂饲,不用药。模型组及各治疗组大鼠皮下注射TP 5mL•kg-1•d-1,每周3次(周一、三、五),连续14d。治疗组于模型第1天起开始给药,灌饲花生根乙醇提取物(高、中、低剂量组给药剂量分别为:10mL•kg-1•d-1、5mL•kg-1•d-1、1mL•kg-1•d-1)。模型组第15天禁食10h,各组动物予过量的苯巴比妥钠(100mg/kg)处死,分离大鼠前列腺、精囊腺和睾丸组织,分别用分析天平称取各组织湿质量,计算前列腺、睾丸、精囊腺指数[腺体湿质量(mg)/体质量(g)]。
1.2.2 Bcl-2及Bax蛋白检测 称重完毕后迅速将前列腺组织固定于4%多聚甲醛溶液中,石蜡包埋,切片,厚4μm,严格按照试剂盒说明进行免疫组织化学法检测Bcl-2和Bax蛋白的表达。医学真彩色计算机图像全自动分析处理系统(HPIAS-1000型)观察并计算阳性细胞。显微镜下,前列腺组织中上皮细胞层中有棕黄色颗粒者为阳性细胞,每张切片中随机选择10个视野,计算Bcl-2及Bax蛋白的光密度,然后进行数字处理,计算平均光密度。
1.3 统计学处理 所有数据采用SPSS12.0统计软件进行分析,计量资料采用±s表示,组间比较采用t检验,检验水准α=0.05,以P0.05为差异有统计学意义。
2 结 果
2.1各组大鼠前列腺湿质量及指数比较 与对照组比较,模型组前列腺湿质量及指数增大,差异有统计学意义(P0.01);与模型组比较,花生根乙醇提取物高、中剂量治疗组前列腺质量及指数明显降低,差异有统计学意义(P0.01)。各组大鼠前列腺湿质量及指数比较,见表1。
表1 各组大鼠前列腺湿质量及指数比较(±s)
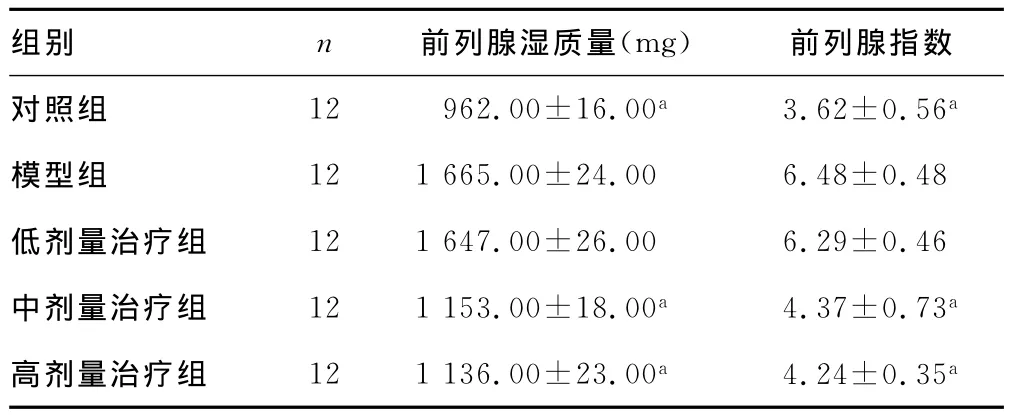
表1 各组大鼠前列腺湿质量及指数比较(±s)
a:P 0.01,与模型组比较。
组别 n 前列腺湿质量(mg) 前列腺指数对照组 12 962.00±16.00a 3.62±0.56a模型组 12 1 665.00±24.00 6.48±0.48低剂量治疗组 12 1 647.00±26.00 6.29±0.46中剂量治疗组 12 1 153.00±18.00a 4.37±0.73a高剂量治疗组 12 1 136.00±23.00a 4.24±0.35a
2.2 各组大鼠精囊腺湿质量及指数比较 模型组精囊指数较对照组增大,差异有统计学意义(P0.01)。花生根乙醇提取物各剂量治疗组精囊腺指数与模型组比较,差异无统计学意义(P0.05),见表2。
2.3 各组大鼠睾丸湿质量及指数比较 花生根乙醇提取物各剂量治疗组、模型组和对照组的睾丸湿质量和指数比较,差异无统计学意义(P0.05),见表3。
表2 各组大鼠精囊腺湿质量及指数比较(±s)
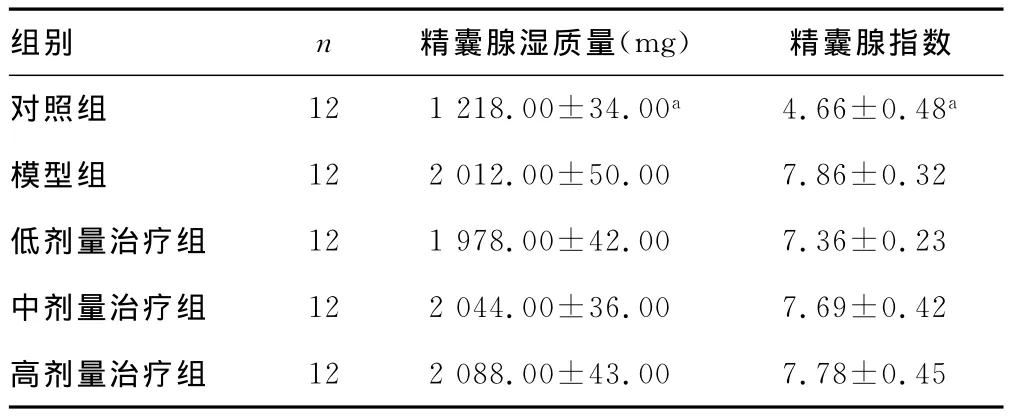
表2 各组大鼠精囊腺湿质量及指数比较(±s)
a:P 0.01,与模型组相比。
组别 n 精囊腺湿质量(mg) 精囊腺指数对照组 12 1 218.00±34.00a 4.66±0.48a模型组 12 2 012.00±50.00 7.86±0.32低剂量治疗组 12 1 978.00±42.00 7.36±0.23中剂量治疗组 12 2 044.00±36.00 7.69±0.42高剂量治疗组12 2 088.00±43.00 7.78±0.45
表3 各组大鼠睾丸湿质量及指数比较(±s)
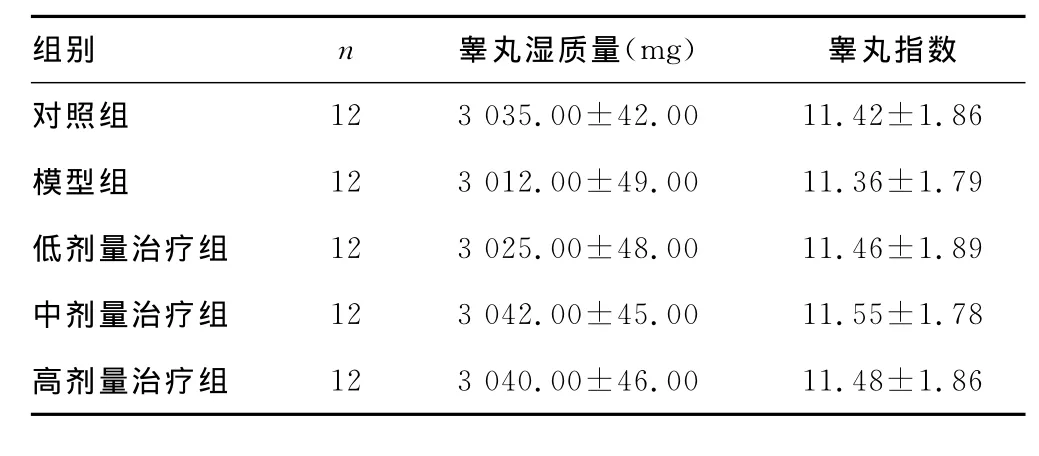
表3 各组大鼠睾丸湿质量及指数比较(±s)
组别 n 睾丸湿质量(mg) 睾丸指数对照组12 3 035.00±42.00 11.42±1.86模型组 12 3 012.00±49.00 11.36±1.79低剂量治疗组 12 3 025.00±48.00 11.46±1.89中剂量治疗组 12 3 042.00±45.00 11.55±1.78高剂量治疗组12 3 040.00±46.00 11.48±1.86
2.4 各组大鼠干预前、后体质量比较 花生根乙醇提取物各剂量治疗组大鼠体质量增长正常,与模型组、对照组比较,差异无统计学意义(P0.05),见表4。
表4 各组大鼠干预前、后体质量比较(±s)

表4 各组大鼠干预前、后体质量比较(±s)
组别 n 干预前体质量(g)干预后体质量(g)体质量变化率(%)对照组12 191.46±7.28 266.38±20.60 39.18±12.28模型组 12 191.64±10.02 266.86±18.88 38.24±10.85低剂量治疗组 12 189.46±8.65 262.43±19.22 38.16±11.34中剂量治疗组 12 190.47±7.86 264.77±21.06 39.12±12.06高剂量治疗组12 191.07±11.01 268.46±21.25 40.08±10.04
2.5 各组大鼠前列腺组织Bcl-2和Bax蛋白表达率比较 对照组大鼠前列腺组织中上皮细胞层Bcl-2蛋白有弱阳性表达,模型组有较强阳性表达,高、中剂量治疗组为弱阳性表达,高剂量组最弱,与对照组接近。对照组Bax蛋白上皮细胞层有较强阳性表达,而模型组表达最弱,高、中剂量治疗组阳性表达强于模型组,高剂量组阳性表达最强,接近对照组,见表5。
表5 各组大鼠前列腺组织Bcl-2和Bax表达率比较(±s)

表5 各组大鼠前列腺组织Bcl-2和Bax表达率比较(±s)
a:P0.05,b:P 0.01,与模型组比较。
组别 n Bcl-2(%) Bax(%) Bcl-2/Bax对照组 12 7.98±1.45b 11.46±2.88b 0.86±0.44b模型组 12 13.25±2.86 8.23±2.42 1.48±0.52低剂量治疗组 12 11.86±2.64a 8.48±2.62a1.26±0.36a中剂量治疗组 12 8.24±1.36b 10.84±2.68b 1.08±0.34b高剂量治疗组 12 8.03±1.26b 11.25±2.48b 0.90±0.24b
3 讨 论
建立BPH模型必须具备睾丸存在和年龄增长两个重要条件[4]。花生根乙醇提取物高、中剂量治疗组的前列腺指数较模型组减少,显示花生根乙醇提取物能抑制TP所致大鼠前列腺增生;但花生根乙醇提取物低剂量治疗组其前列腺指数与模型组比较,差异无统计学意义(P0.05),未见有抑制前列腺增生作用。花生根乙醇提取物抑制前列腺增生作用具有量效关系。花生根乙醇提取物各剂量治疗组、模型组和对照组大鼠的精囊腺、睾丸湿质量和指数比较,差异无统计学意义(P0.05),说明花生根乙醇提取物和TP对大鼠精囊腺、睾丸生长无明显影响。花生根乙醇提取物各剂量治疗组大鼠体质量增长正常,与模型组、对照组比较,差异无统计学意义(P0.05),说明花生根乙醇提取物对大鼠体质量无明显影响。
Bcl-2及Bax基因在Bcl-2基因家族中是极重要的成员。通过转基因动物和基因转染实验研究发现,Bcl-2基因对细胞凋亡具有明显的抑制作用[5]。张学军等[6]运用转基因技术培育出Bcl-2前列腺组织特异性转基因小鼠,该小鼠前列腺组织过量表达Bcl-2蛋白,并伴有前列腺增生的病理学改变。Bcl-2蛋白在转基因鼠的前列腺体内的过量表达,能够引发前列腺良性增生[6]。Kyprianou等[7]也发现 Bcl-2蛋白在前列腺增生组织中表达较前列腺正常组织中明显升高。Bcl-2是程序性细胞凋亡的抑制基因,有研究表明,人BPH的组织标本中Bcl-2蛋白的表达明显增加[8]。
细胞的增殖和死亡保持动态平衡是保证器官细胞总数目衡定的前提。正常前列腺的大小得以保持衡定也是由增殖的细胞数目和凋亡的细胞数目相当所决定。BPH时各种因子的表达水平发生改变,使这一平衡被打破,表现为细胞的复制增加或细胞的凋亡数目减少,从而引起总的细胞数目增加,导致前列腺体积的增大[9]。
Bax和Bcl-2蛋白的作用完全相反,Bax蛋白具有对抗Bcl-2蛋白抑制凋亡的作用。有研究发现,Bcl-2/Bax蛋白之间比例是决定对细胞凋亡抑制作用强弱的关键因素,因此Bax是极重要的促细胞凋亡基因[9]。细胞凋亡(apoptosis)亦称为细胞程序死亡(programmed cell death)是一种选择性的生理死亡,在正常组织中,细胞增殖速率和细胞死亡速率间存在着平衡,一旦不平衡发生,无论是通过细胞复制速率的增加还是细胞死亡速率的减少,其结果都是前列腺细胞的大量堆积及与之相应的前列腺的生长[10]。细胞的增殖与凋亡在前列腺的发生、发展中均有重要的地位,抑制细胞凋亡因子Bcl-2是内源性抑制剂,能防止细胞凋亡,该因子的过量表达可促使前列腺增生组织中细胞凋亡减少。增殖速率增加与凋亡速率减缓最终的结果都是造成前列腺内细胞绝对数目的增加,从而形成BPH。因此,BPH的产生与Bax和Bcl-2蛋白有很重要的关系。
综上所述,花生根乙醇提取物对前列腺增生有明显的治疗作用,治疗组睾丸、精囊及体质量与对照组相比无明显影响。免疫组织化学结果检测显示,模型组Bcl-2表达率显著高于对照组,Bax表达率显著低于对照组,表明前列腺增生是由前列腺组织中Bcl-2和Bax调控失衡所致,灌服花生根乙醇提取物后,Bcl-2和Bax恢复到正常水平,使 Bcl-2/Bax比值恢复至平衡状态,说明花生根乙醇提取物可通过调节凋亡基因的平衡而抑制前列腺的增生。
[1] 吴阶平.吴阶平泌尿外科学[M].济南:山东科技出版社,2004:112-113.
[2] 蔡文清,秦同文,黎玮,等.Bcl-2、Bax和c-myc基因在前列腺增生症中表达的意义[J].中华实验外科杂志,2000,17(5):433-434.
[3] 康宁世.花生根中药单方治愈男人前列腺肥大[M/CD].(2012-06-07)[2013-01-20].http:// www.360doc.com/content/12/0607/20/156649_216694136.shtml.
[4] 盛树东.治疗良性前列腺增生症的植物药研究进展[J].山东医药,2011,51(39):112-114.
[5] Marx J.Cell death studies yield cancer clues[J].Science,1993,259(5096):760-761.
[6] 张学军,马腾骧.bcl-2基因在良性前列腺增生中的作用[J].中华泌尿外科杂志,1997,18(2):97-99.
[7] Kyprianou N,Tu H,Jacobs SC.Apoptotic versus proliferative activities in human benign prostatic hyperplasia[J].Hum Patholy,1996,27(7):668-675.
[8] Sensibar JA.Analysis of cell death and cell proliferation in embryonic stages,normal adult,and aging prostates in human and animals[J].Microsc Res Tech,1995,30(4):342-350.
[9] Krajewski S,Krajewska M,Shabaik A,et al.Immunohistochemical determination of in vivo distribution of Bax,a dominant inhibitor of Bcl-2[J].Am J Pathol,1994,145(6):1323-1336
[10]李祥光.前列舒通对丙酸睾酮诱导的去势大鼠前列腺增生的作用机制[D].北京:中国中医科学院,2008.
Inhibiting effect of ethanol extract from peanut root on rat prostate hyperplasia andits influence on Bcl-2 and Bax protein
ObjectiveTo explore the inhibitory effect of the ethanol extract from peanut root on the non-castration adult rat prostate hyperplasia induced by testosterone propionate and its mechanism.Methods60SD rats were randomly divided into the control,model and high,middle and low dose of peanut root ethanol extract treatment groups,among them,the control group was normally fed without medication;the model group was subcutaneously injected by testosterone propionate(TP,5mL/kg/d)and simultaneously gavaged subcutaneous injection with peanut root ethanol extract(10mL/kg/d,5mLg/kg/d or 1mL/kg/d)for successive 14d.The rats in various groups were killed on 15dand their prostate,spermatophore and testicle tissues were separated and weighed.The ratio of gland/body-weight(mg/g)was calculated.The expressions of Bcl-2and Bax proteins in the prostate tissues were detected by immunohistochemistry.ResultsThere was statistical difference in the indexes of prostate between the treatment groups(high and middle dose)and the model group(P0.01),while there was no statistical difference between the low dose group and the model group(P0.05).This result showed that there was a dose-effect relationship between the inhibition effect on rat prostate hyperplasia and the ethanol extracts from peanut root.There was no statistical differences between the model group and the treatment groups in the indexes of testicle,spermatophore or the change of weight(P0.05).There was statistical difference between the control group or model group and the treatment group in the expression of Bcl-2or Bax protein(P0.05),while no statistical difference between the treatment group and the control group(P0.05).ConclusionEthanol extract from peanut root has good inhibiting effect on prostate hyperplasia and its mechanism could reach the curative effect by regulating the balance relation between apoptosis gene Bcl-2and Bax protein proportion and promoting apopitosis of benign prostatic hyperplasia.
plant extracts;peanut root;prostatic hyperplasia;rats;apoptosis;Bcl-2;Bax
10.3969/j.issn.1671-8348.2014.11.020
A
1671-8348(2014)11-1338-03
闫学红(1968-),副主任药师,本科,主要从事中药制剂和中药药理研究。△
,Tel:15803953817;E-mail:beizhanyu@sina.com。
2013-10-23
2013-12-10)
论著•临床研究

