HPLC法测定长春碱亲水基修饰阳离子脂质体中主药含量及脂质体的包封率Δ
李学涛,喻荣平,贾连群,郭小瑞,程岚
(辽宁中医药大学药学院,辽宁大连 116600)
HPLC法测定长春碱亲水基修饰阳离子脂质体中主药含量及脂质体的包封率Δ
李学涛*,喻荣平,贾连群,郭小瑞,程岚#
(辽宁中医药大学药学院,辽宁大连 116600)
目的:建立测定长春碱亲水基修饰阳离子脂质体中主药含量及脂质体的包封率的方法。方法:采用高效液相色谱法。色谱柱为迪马C18柱,流动相为乙腈-甲醇-二乙胺(13∶53∶34,V/V/V),检测波长为281nm,流速为1.0ml/min,柱温为30℃,进样量为10μl。采用葡聚糖凝胶柱分离法分离长春碱亲水基修饰阳离子脂质体游离药物以测定包封率。结果:长春碱检测质量浓度在0.02~0.30mg/ml范围内与峰面积积分值呈良好的线性关系(r=0.9996);精密度、稳定性、重复性试验的RSD≤1.88%;低、中、高浓度的平均加样回收率为99.82%,RSD=0.15%(n=9);所测脂质体的平均包封率为86.40%。结论:该方法准确可靠、简单快速、重复性好,可用于脂质体的药物含量及包封率的测定。
长春碱;脂质体;含量;包封率;测定
长春碱(Vinblastine,VLB)是一种双吲哚型生物碱,存在于夹竹桃科植物长春花中。VLB能干扰增殖细胞纺锤体的形成,使有丝分裂停止于中期。研究表明,VLB有免疫抑制作用,对霍杰金氏病、绒毛膜上皮癌疗效较好,对急性白血病、乳腺癌、卵巢癌、睾丸癌、头颈部癌、口咽部癌、单核细胞白血病均有一定疗效[1-2]。VLB在水中的溶解度小,临床应用过程中表现出明显的刺激性和毒副作用。为提高药物的抗肿瘤效果,降低药物的毒副作用,拟将VLB制备成亲水基修饰阳离子脂质体。笔者以高效液相色谱(HPLC)法测定该脂质体中VLB的含量,并通过葡聚糖凝胶柱分离法测定VLB脂质体的包封率,为该制剂的进一步开发提供理论依据。
1 材料
1.1 仪器
安捷伦LC-1100HPLC仪(G21771AA-UV检测器、安捷伦色谱工作站);KQ3200超声波清洗器(昆山市超声仪器有限公司);AY220电子分析天平(日本岛津公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);DF2101S磁力搅拌器(巩义市予华仪器厂);JY92-2D超声波细胞捣碎机(宁波新芝生物科技股份有限公司);MiniExtruder脂质体挤出仪(美国Avanti Polar Lipids公司)。
1.2 药品与试剂
VLB(武汉金诺化工有限公司,批号:GPC-JNHG20110921,质量分数:98.2%);VLB对照品(贵州迪大科技有限公司,批号:GZDD-0329,质量分数:99.7%);VLB亲水基修饰阳离子脂质体(辽宁中医药大学自制,批号:120511、120512、120513);3β-[N-(N’,N’-二甲基胺乙基)胺基甲酰胺基]-胆固醇(美国Avanti Polar Lipids公司,缩写:DC-Chol,分子质量:495.18);二棕榈酰磷脂酰胆碱(日本精化株式会社,缩写:DPPC,分子质量:734.04);聚乙二醇-二硬脂酰磷脂酰乙醇胺(日本精化株式会社,缩写:PEG2000-DSPE,分子质量:2800.5);Sephadex G-50(上海华蓝化学科技有限公司);甲醇、乙腈为色谱纯,其他试剂均为分析纯,水为纯净水。
2 方法与结果
2.1 VLB亲水基修饰阳离子脂质体的制备
结合课题的前期研究,设计VLB亲水基修饰阳离子脂质体的制备方法[3]:称取 DPPC 0.0370g、DC-Chol 0.0252g、PEG2000-DSPE 0.0010g,精密称定,加氯仿20ml使其溶解,于旋转蒸发器中除去氯仿,制备磷脂薄膜。加pH 3.0的柠檬酸缓冲液30ml,水化磷脂薄膜,缓慢振摇,60℃水浴,磁力搅拌30min,超声波处理30min,制备空白脂质体。将所得脂质体依次通过0.45、0.22μm微孔滤膜滤过,加入0.2mol/L VLB溶液4.44ml,并用l mol/L磷酸氢二钠将pH调至7.5,于55℃水浴保温10min,冷却至室温,即得。
2.2 脂质体中主药含量的测定
2.2.1 色谱条件[4]色谱柱:迪马C18柱(200mm×4.6mm,5μm);流动相:乙腈-甲醇-二乙胺(13∶53∶34,V/V/V);柱温:30℃;检测波长:281nm;流速:1.0ml/min;进样量:10μl。
2.2.2 溶液的制备 (1)供试品溶液的制备:精密量取VLB亲水基修饰阳离子脂质体1.0ml,加甲醇9.0ml,超声处理(功率:250W,频率:40kHz)10min,破乳,0.22µm微孔滤膜滤过,取续滤液适量,即得。(2)对照品溶液的制备:取VLB对照品30.0mg,精密称定,加甲醇溶解并定容至100ml,得质量浓度为0.30mg/ml的对照品溶液。(3)空白溶液的制备:制备不含VLB的空白脂质体,再按供试品溶液方法制备,即得。
2.2.3 系统适应性试验 取对照品溶液、空白溶液和供试品溶液各10μl,按“2.2.1”项下色谱条件进样分析,记录色谱图,详见图1。对照品色谱峰的保留时间约为8.4min,空白在此位置没有色谱峰,对VLB的测定无干扰。理论板数按VLB计不低于3000。
2.2.4 线性关系考察 精密量取“2.2.2”项下对照品溶液适量,用甲醇稀释成质量浓度分别为0.02、0.05、0.10、0.15、0.20、0.30mg/ml的系列溶液,按“2.2.1”项下色谱条件进样测定。以峰面积(y)为纵坐标,VLB检测质量浓度(x)为横坐标,进行线性回归,得回归方程y=5481.4x+80.571(r=0.9996)。结果表明,VLB检测质量浓度在0.02~0.30mg/ml范围内与峰面积积分值呈良好的线性关系。
2.2.5 精密度试验 取“2.2.4”项下线性范围内的3种质量浓度(0.02、0.15、0.30mg/ml)的对照品溶液适量,每种浓度3份,按“2.2.1”项下色谱条件进样,测定峰面积。结果,RSD=1.88%,说明仪器精密度良好。
2.2.6 稳定性试验 取批号为120511的样品适量,在常温放置下分别于0、2、4、6、8、12h按“2.2.1”项下色谱条件进样,测定峰面积。结果,RSD=0.64%,表明样品溶液在12h内质量稳定。
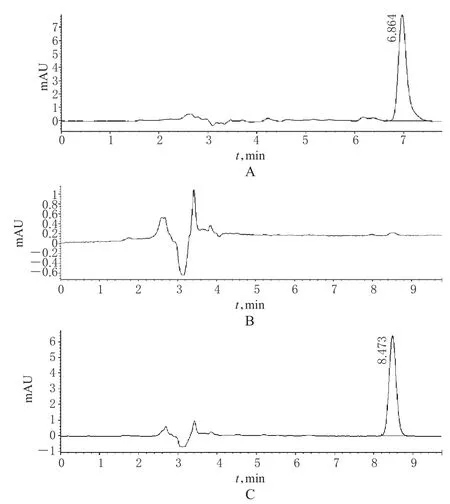
图1 高效液相色谱图A.对照品;B.空白;C.供试品Fig1 HPLC chromatogramsA.substance control;B.blank;C.test sample
2.2.7 重复性试验 取批号为120511的样品适量,按“2.2.2”项下方法制备供试品溶液,并按“2.2.1”项下色谱条件进样,平行测定6次。结果,样品的平均质量浓度为0.2514mg/ml,RSD=1.86%,表明本方法重复性良好。
2.2.8 加样回收率试验 精密量取批号为120511的样品1.0ml,共9份,分别加入对照品溶液(0.05mg/ml)4.0、5.0、6.0ml,按“2.2.2”项下供试品溶液的制备方法进行制备,并按“2.2.1”项下色谱条件进样测定,计算加样回收率,结果见表1。
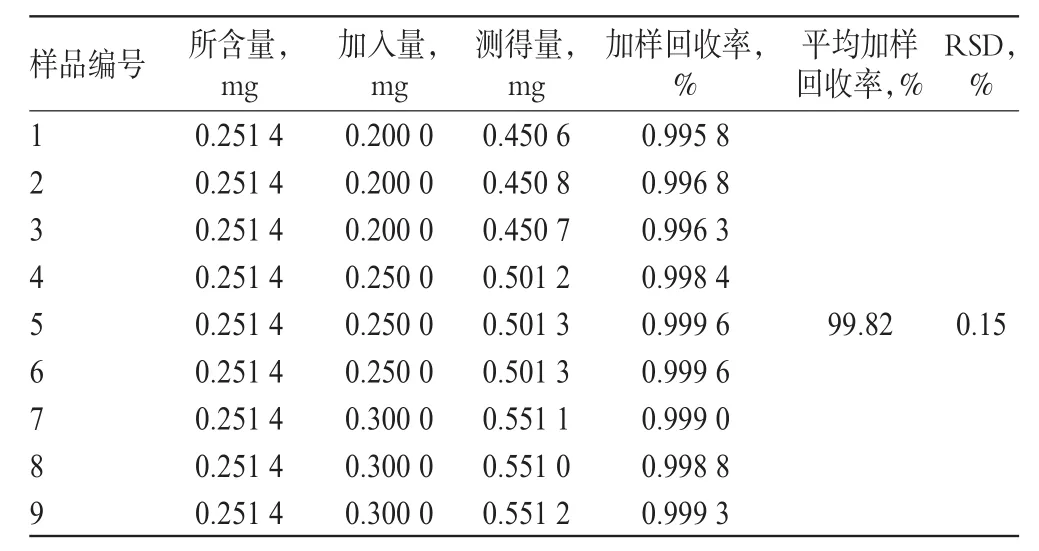
表1 加样回收率试验结果(n=9)Tab1 Results of recovery tests(n=9)
2.2.9 样品含量测定 精密量取不同批号的样品1.0ml,各3份,按“2.2.2”项下条件制备供试品溶液,并按“2.2.1”项下色谱条件进样测定和计算含量,结果见表2。
2.3 VLB脂质体包封率的测定
2.3.1 洗脱曲线的绘制[5-6]称取Sephadex G-502.0g,加pH 7.6磷酸盐缓冲液,浸泡24h,湿法装柱。精密吸取样品(批号:120511)0.5ml,加至凝胶柱(1.0cm×12cm)上方,用蒸馏水进行洗脱,洗脱速度1.0ml/min,收集洗脱液,每份2ml,分别吸取1ml,加蒸馏水1ml,混匀,超声使其澄清,以洗脱溶液为空白,于281nm波长处测定吸光度A,结果见图2。
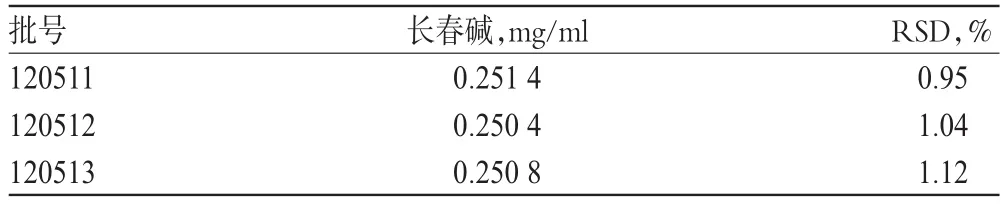
表2 样品含量测定结果(n=3)Tab2 Results of content determination of samples(n=3)
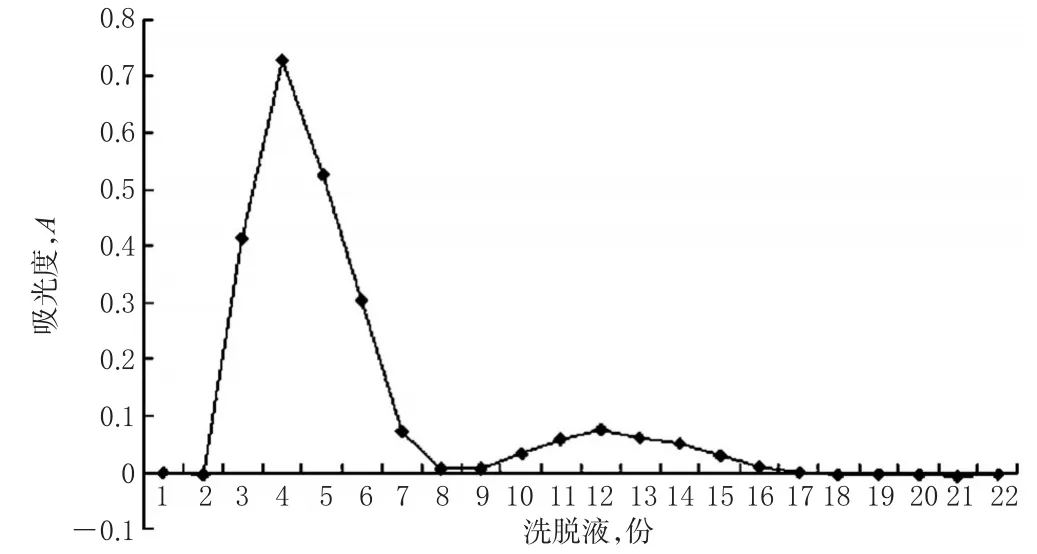
图2 洗脱曲线Fig2 Plot of elution of curves
2.3.2 上柱回收率的测定 吸取3种质量浓度的对照品溶液(0.02、0.15、0.30mg/ml)各0.5ml,按照“2.3.1”项下方法进行分离,合并游离组分,测定VLB含量。结果,VLB柱回收率=102.5%,RSD=1.41%(n=3)。取质量浓度为0.02、0.15、0.30mg/ml的对照品溶液各适量,分别加入空白脂质体,混合均匀,精密移取0.5ml,上柱,洗脱,收集游离药物,测定含量。结果,平均加样回收率为100.4%,RSD=1.75%(n=3)。
2.3.3 包封率的测定 取不同批号VLB脂质体各3份,分别精密吸取0.5ml,按“2.3.1”项下方法操作,收集游离药物,合并,混匀,水浴蒸干,残渣用甲醇溶解,滤过,滤液定容至5ml,以0.22µm微孔滤膜滤过,取滤液10μl测定,计算VLB的质量浓度,按照以下公式计算脂质体的包封率:
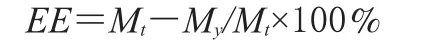
式中,Mt为VLB总量,My为未被脂质体包封的VLB的量。3批VLB脂质体包封率的测定结果详见表3。

表3 包封率的测定结果(%%,n=3)Tab3 Result of encapsulation rate(%%,n=3)
3 讨论
3.1 包封率测定方法的选择
分离脂质体中游离药物的方法有葡聚糖凝胶柱分离法(凝胶滤过色谱分离法)、鱼精蛋白沉淀法、透析法、反透析法、微柱离心法[7-10]等。在预试验中发现,鱼精蛋白沉淀法在沉淀脂质体时,鱼精蛋白对游离的药物有一定的吸附沉淀作用;采用透析法测定脂质体的包封率,透析过程操作时间过长;反透析法虽然可以弥补透析法的不足,但需要将透析袋置于脂质体溶液中,所耗脂质体较多,成本较高;微柱离心法在离心过程中可能发生脂质体变形或破裂而导致包封率下降。故笔者采用葡聚糖凝胶柱分离法测定脂质体的包封率。结果表明,本法操作简单、快捷、药物分离效果较好。
3.2 影响脂质体包封率的因素
影响脂质体包封率的因素主要为药物本身的性质。脂溶性或水溶性较好的药物的包封率较高,药物的荷电性、分子质量及其浓度等对包封率也有影响。在制备脂质体时,类脂膜的组成对包封率也有影响,加入适量的胆固醇可以提高包封率。另外,脂质体的制备方法对包封率也有很大的影响。
3.3 含量测定时检测波长的选择
根据笔者前期对VLB亲水基修饰阳离子脂质体的研究发现,VLB在264nm波长处有最大光谱吸收,因此本试验选择HPLC检测波长为264nm。VLB测定中所用的流动相为乙腈-甲醇-二乙胺溶液(取二乙胺14ml,加水986ml,混匀,磷酸调pH至7.5)的混合液,分别考察不同体积比(13∶53∶34,10∶50∶40,7∶47∶46)对VLB保留时间的影响。结果,流动相体积比为34∶66时VLB的保留时间为10.9min,峰形对称,故确定流动相乙腈-甲醇-二乙胺体积比为13∶53∶34。
综上所述,本研究确定的HPLC测定方法结果准确可靠、简单快速、重复性好。采用葡聚糖凝胶柱分离法测定脂质体的包封率,方法操作简单、快捷、药物分离效果较好,可用于制剂包封率的测定。
[1] 高正航,李卫东.长春花生物碱类药物研究概述[J].贵州农业科学,2005,33(6):94.
[2] 祖元刚,罗猛.长春花生物碱成分及其药理作用研究进展[J].天然产物研究与开发,2006,18(2):325.
[3] 陈彤,侯世祥,王永炎,等.pH梯度法制备抗癌复方硫酸长春新碱脂质体[J].中国中药杂志,2007,32(8):678.
[4] 林巧平,郭仁平,许向阳,等.注射用姜黄素脂质体的制备及其质量评价[J].中国天然药物,2007,5(3):207.
[5] 李海刚,王东凯.注射用克拉霉素脂质体的制备及其包封率的测定[J].中国抗生素杂志,2006,31(10):635.
[6] 鲁会侠,冯锁民.紫杉醇脂质体药物包封率的测定[J].中国新药杂志,2007,16(10):778.
[7] 平其能.现代药剂学[M].北京:中国医药科技出版社,1998:461.
[8] 熊非,朱家壁,王维.灯盏花素纳米脂质体包封率测定方法研究[J].药学学报,2004,39(9):755.
[9] 鞠静红,张志荣,韩静.穿琥宁脂质体包封率的测定[J].中国医药工业杂志,2008,39(7):514.
[10] 姚亚红,张立伟.黄芩素脂质体的制备及体外释放的研究[J].中医药学报,2006,34(3):31.
Determination of the Content of Main Component and Entrapment Efficiency of Vinblastine Hydrophilic Group Modified Cationic Liposome by HPLC
LI Xue-tao,YU Rong-ping,JIA Lian-qun,GUO Xiao-rui,CHENG Lan
(School of Pharmacy,Liaoning University of TCM,Liaoning Dalian 116600,China)
OBJECTIVE:To establish a method for the content determination of main component and the entrapment efficiency of Vinblastine hydrophilic group modified cationic liposomes.METHODS:HPLC method was adopted.The determination was carried out on C18column with mobile phase consisted of acetonitrile-methanol-diethylamine(13∶53∶34,V/V/V)at the flow rate of 1.0ml/min.The column temperature was at 30℃ and the sample size was 10μl.The free drug of Vinblastine hydrophilic group modified cationic liposomes was separated by sephadex column so as to detect the encapsulation rate.RESULTS:The linear range of vinblastine were 0.02-0.30mg/ml(r=0.9996)with an average recovery of 99.82%(RSD=0.15%,n=9).RSDs of precision,stability,and repeatability tests were all≤1.88%.The average encapsulation rate was 86.40%.CONCLUSIONS:The method is accurate,reliable,simple,rapid and reproducible,and it can be used for the determination of the content and encapsulation rate of liposomes.
Vinblastine;Liposome;Content;Encapsulation rate;Determination
R979.1
A
1001-0408(2014)04-0369-03
DOI10.6039/j.issn.1001-0408.2014.04.27
国家自然科学基金资助项目(No.81102822);辽宁中医药大学优秀青年药学人才基金(No.yxrc0911)
*副教授。研究方向:新型给药系统。E-mail:lixuetao1979@163.com
#通信作者:教授,硕士研究生导师。研究方向:新药开发。电话:0411-87586010。E-mail:sychenglan@163.com
2013-05-22
2013-11-24)
