肾上腺髓质素2的降压作用及其机制*
谢 静,崔 屹,耿 彬,唐朝枢,曾 强△
(1.中国人民解放军总医院国际医学中心,北京100853;2.北京大学基础医学院生理学与病理生理学系,北京100191)
肾上腺髓质素 2(adrenomedullin 2,ADM2)是一种具有心血管保护作用的小分子活性肽,归属于降钙素基因相关肽超家族。已知该家族成员中肾上腺髓质素(adrenomedullin,ADM)是心肾系统重要的保护因子,降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是迄今发现的最强舒血管物质,而ADM2能够发挥类似甚至更强于ADM和CGRP的生物学作用[1]。尽管诸多研究表明ADM2可以扩张外周血管阻力、降低血压[2,3],但其对动脉血压影响的具体机制目前仍不清楚。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)过度激活是高血压形成的重要机制之一,效应分子血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)可诱发血管内皮发生氧化应激反应,导致血管内皮功能紊乱、血管舒张障碍[4]。本实验拟通过研究ADM2对AngⅡ的拮抗作用,探讨ADM2可能的降压机制和病理生理意义。
1 材料与方法
1.1 材料
SD大鼠由北京大学医学部实验动物中心提供。1002型微量渗透泵购自美国Alzet公司。EA.hy 926购自中国科学院上海生命科学研究院细胞资源中心。ADM2购自美国Phoenix Pharmaceutical INC,AngⅡ购自美国 Sigma公司。一氧化氮 (nitric oxide,NO)、一氧化氮合酶 (nitric oxide synthase,NOS)试剂盒购自南京建成生物工程研究所。二氢乙啶(dihydroethidium,DHE)购自北京威格拉斯生物技术有限公司。活细胞活性氧检测试剂盒购自北京普利莱基因技术有限公司。
1.2 动物分组与给药方法
18只6周龄雄性 SD大鼠,180~200 g,18只,随机分为 3组(n=6):对照组、AngⅡ组和 AngⅡ +ADM2组。将AngⅡ和ADM2溶于100μl生理盐水后注入微量渗透泵,用1%戊巴比妥钠(3μl/g)腹腔注射将大鼠麻醉后,于其颈后部正中位置做一长约1 cm的纵行切口,将泵置入皮下,泵开口背对切口,持续皮下给药,AngⅡ剂量为 150 ng/(kg·min),ADM2剂量为 500 ng/(kg·h),对照组以等量生理盐水注入微量渗透泵,同法埋于皮下,各组给药时间为14 d[5]。
1.3 大鼠动脉血压和心率的测定
应用BL-420E生物机能试验系统(成都泰盟科技有限公司)测定大鼠动脉血压。用1%戊巴比妥钠(3μl/g)腹腔注射将大鼠麻醉后,固定、剪毛。于颈前部正中做1 cm的纵行切口,分离出左侧颈总动脉,将动脉导管向心脏方向插入1.5 cm(导管至换能器圆帽内充满0.3%肝素),结扎并固定导管,记录大鼠动脉血压和心率的变化。
1.4 大鼠心重/体重指数的计算
实验开始前,给大鼠称重并记录。大鼠脱臼处死后,开胸取出心脏,在 Krebs液(118 mmol/L NaCl、4.7 mmol/L KCl、1.18 mmol/L KH2PO4、1.17 mmol/L MgSO4、25 mmol/L NaHCO3、2.5 mmol/L CaCl2、11 mmol/L Glucose,pH 7.4)中轻轻挤压心脏,漂洗净心腔内血液,用滤纸吸干水分后称重并记录。按公式计算:心重/体重指数 =心脏重量(mg)/体重(g)。
1.5 血浆中NO和eNOS的测定
经动脉导管的三通管取血,滴入含有肝素的离心管中,4℃,3 500 r/min,离心 10 min,取上层血浆分装,-80℃冻存待用。NO含量测定用硝酸还原酶法,eNOS活性测定用化学比色法。实验操作均按照试剂盒说明书进行。
1.6 大鼠动脉活性氧的检测
大鼠处死后,迅速分离胸主动脉、腹主动脉和肠系膜上动脉,置于4℃Krebs液中,小心修剪动脉周围脂肪和结缔组织后,切成长约1 cm的动脉条,用滤纸吸干表面水分后包埋于OCT中。用冰冻切片机将动脉按6μm厚度切片,1μmol/L DHE常温避光孵育30 min后,于倒置荧光显微镜下观察ROS荧光强度并拍照,进行定量分析。
1.7 离体血管环的制备及张力测定
另取6只正常SD大鼠脱臼处死后,迅速分离胸主动脉、肠系膜上动脉、尾动脉,置于4℃预冷的Krebs液中,去除管周脂肪和结缔组织。胸主动脉和肠系膜上动脉剪成两段长约4 mm的血管环,尾动脉制成两个长约1.5 mm的血管条,各血管环分别取出一段用与血管内径相适的表面粗糙的细铜丝穿过并捻动以去除内皮。动脉环用两根不锈钢微型挂钩贯穿血管管腔,水平悬挂在10 ml浴槽内,下方固定,上方以一细钢丝连于张力换能器(JS-101型),经计算机生物信号采集分析系统记录血管张力变化。浴槽内通以95%O2+5%CO2混合气体饱和处理的37℃的Krebs液10 ml。主动脉、肠系膜上动脉、尾动脉血管环悬挂于浴槽后,将基础张力分别调至2 g、1.5 g、0.7 g,平衡 1 h,每 20 min换一次营养液。在使用一段血管环时,其余血管环保留在95%O2+5%CO2混合气体饱和处理的37℃恒温灌流槽中以保持其活力。所有动脉环用100 mmol/L KCl反复多次刺激,当连续2次同样的刺激所引起的收缩幅度差别<5%时表明标本对刺激稳定,可开始正式实验。加入乙酰胆碱(10-5mol/L)使血管环舒张,观察其舒张幅度,小于 KCl收缩幅度的10%时,认为内皮去除完全;大于KCl收缩幅度的80%表明内皮完整。观察并记录AngⅡ(10-6mol/L)诱发血管环收缩后加入不同浓度 ADM2(10-9~10-7mol/L)对动脉环收缩曲线的影响。动脉环张力曲线经chart软件处理,计算升高幅度(升高幅度%=(最高值-基础值)/基础值×100%)。
1.8 活细胞活性氧的检测
取生长状态良好的人脐静脉内皮细胞EA.hy 926细胞接种于预先放有无菌玻片的24孔板中,待细胞融合达50%时,将细胞孔分4组,分别给予500 nmol/L AngⅡ和 0 nmol/L、50 nmol/L、100 nmol/L、500 nmol/L ADM2。联合孵育4 h后,培养基中加入终浓度为10μmol/L荧光探针 DCFH-DA,避光孵育30 min。倒掉培养基,PBS轻轻洗涤培养孔3次,取出玻片,滴加20μl抗荧光淬灭封片剂,置于载物片上,于倒置荧光显微镜下观察ROS荧光强度并拍照,进行定量分析。
1.9 统计学分析
2 结果
2.1 ADM2对大鼠血压、心率和心重/体重指数的影响
与正常对照组相比,AngⅡ组大鼠收缩压和舒张压均显著升高,心重/体重指数亦升高(P<0.05,P<0.01,表1)。而与 AngⅡ组相比,AngⅡ +ADM2组大鼠的收缩压、舒张压和心重/体重指数均有显著改善(P<0.05,P<0.01,表 1)。
2.2 ADM2对大鼠血浆中NO含量和eNOS活性的影响
检测大鼠血浆发现,与正常对照组相比,AngⅡ组NO含量显著减少,eNOS活性降低(P<0.05,P<0.01,表 2)。而 AngⅡ +ADM2组 NO含量和 eNOS活性均恢复至正常水平(P<0.01,表2)。
2.3 ADM2对大鼠动脉管壁超氧化物生成量的影响
AngⅡ和ADM2干预14 d后,取大鼠胸主动脉、腹主动脉和肠系膜上动脉,检测管壁原位超氧化物水平,正常对照组平均荧光强度分别为1.04±0.05、1.13±0.17和 1.05±0.09;AngⅡ组平均荧光强度分别为3.17±0.42、2.74±0.41和4.01±0.40,明显高于正常对照组(P<0.01);AngⅡ +ADM2组平均荧光强度较AngⅡ组明显减弱,分别为1.11±0.31、0.99±0.20和 0.95±0.15(P<0.01)。

Tab.1 Effect of ADM2 on blood pressure,heart rate and HW/BWof AngⅡ-induced hypertension rat(¯x±s,n=6)

Tab.2 Plasma NO contents and eNOSactivity in rat(¯x±s,n=6)
2.4 不同浓度ADM2对大鼠血管环紧张度(%)的影响
分别取大鼠主动脉、肠系膜上动脉和尾动脉制成血管环,用 AngⅡ(10-6mol/L)预收缩血管,可见在内皮完整的情况下,10-9mol/L、10-8mol/L、10-7mol/L ADM2使主动脉血管环紧张度从(24.96±1.62)%分别下降至(15.33±3.02)%、(13.00±4.65)%、(5.04±3.87)%;使肠系膜上动脉血管环紧张度从(19.95±1.60)%分别降至(10.20±1.96)%、(6.75±1.82)%、(2.95±0.94)%;使尾动脉血管环紧张度从(30.70±2.88)%分别降至(16.65±3.27)%、(10.25±2.85)%、(2.85±2.01)% (P<0.05,表3)。去除内皮后,虽ADM2仍可使血管环呈浓度依赖性舒张,但舒张程度较内皮完整组显著下降。主动脉血管环紧张度从(39.94±0.85)%分别下降至(35.26±0.81)%、(34.19±1.31)%、(27.13±2.82)%;肠系膜上动脉血管环紧张度从(29.38±1.23)%分别降至 (24.81±0.88)%、(21.69±1.53)%、(18.69±1.25)%;尾动脉血管环紧张度从(40.31±1.45)%分别降至(39.20±0.10)%、(37.56±0.24)%、(37.25±0.29)%(P<0.05,表 3)。
2.5 ADM2对内皮细胞活性氧生成的影响
选取人脐静脉内皮细胞系EA.hy 926检测血管内皮细胞活性氧的产生。以500 nmol/L AngⅡ作对照,用不同浓度的 ADM2(50、100和 500 nmol/L)与AngⅡ联合孵育细胞4 h,镜下可见随着ADM2浓度的升高,绿色荧光数量逐渐减少、亮度逐渐减弱(图1A),细胞活性氧的产生明显减少,平均荧光强度分别为 7.18±0.87、4.21±0.30、1.93±0.36、1.16±0.15(P<0.05,图 1B)。500 nmol/L ADM2几乎完全拮抗了500 nmol/L AngⅡ引发的活性氧的产生。

Tab.3 Effect of different concentrations of ADM2 on the change of tension(%)in rat arteries preconstricted by AngⅡ(¯x±s,n=6)
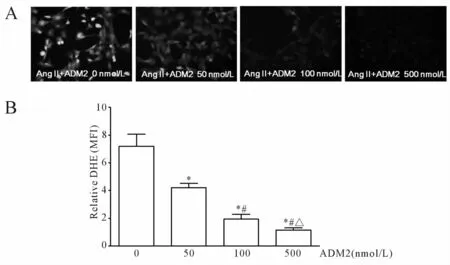
Fig.1 Inhibitory effect of ADM2 on AngⅡ(500 nmol/L)-induced intracellucular ROSgeneration produced within EA.hy 926(n=3,×100)
3 讨论
血管细胞旁/自分泌的小分子活性物质调节紊乱是高血压发病的新机制。自发现ADM2十年来,已被证实其在心脏和血管均有表达[6,7],是心血管系统的保护因子[8]。本研究通过给大鼠皮下埋植微量渗透泵的方法,恒速持续外源性给予AngⅡ和ADM2,观察AngⅡ诱导的高血压大鼠模型中,ADM2对血压的影响。给药AngⅡ14 d后,大鼠收缩压和舒张压均有较温和的升高,心重/体重指数增加,这表明AngⅡ成功诱导了大鼠高血压的形成并伴有大鼠心脏的肥厚,符合压力负荷增加导致心脏结构适应性改变的特点。联合给予ADM2组大鼠血压虽没有完全恢复至正常对照组水平,但与单纯给予AngⅡ组大鼠相比,其血压有所回落且组间差异明显,提示ADM2可以部分拮抗AngⅡ的作用,降低AngⅡ升高的血压。
覆盖在血管内膜面的内皮细胞能生成、激活和释放多种生物活性因子调节血管功能。收缩因子与舒张因子之间平衡失调会导致内皮功能障碍,表现为血管舒张功能降低。正常情况下,内皮细胞在eNOS催化作用下不断合成并释放NO到血浆和血管平滑肌中,激活血管平滑肌内的鸟苷酸环化酶,使cGMP浓度升高,游离钙的浓度降低,维持外周阻力血管正常舒张状态,稳定血压。而AngⅡ可诱导血管内皮发生氧化应激反应,使eNOS活性降低,NO生成减少且消耗增加,导致内皮依赖性血管扩张能力减弱,血压升高。研究发现ADM2可显著提高eNOS活性,增加血浆NO含量,提示血浆中NO含量的增加可能介导了ADM2的降血压作用,而ADM2可能通过提高eNOS活性改善血管内皮功能。这与杨等[9]对孵育的血管组织的研究结论是一致的。观察不同浓度ADM2对大鼠离体血管环紧张度的影响,进一步证实ADM2呈浓度依赖性舒张血管环并具有内皮依赖性,去除内皮后,ADM2舒血管作用显著降低。这表明血管内皮细胞是ADM2的重要作用靶点,ADM2通过改善内皮对NO的合成和释放发挥舒张血管的功能。另外,在大鼠血管壁冰冻切片和培养的人脐静脉内皮细胞荧光染色实验中,结果均表明ADM2能够拮抗AngⅡ引发的氧化应激反应,具有强大的抗氧化能力。因此,我们推断ADM2可能通过拮抗AngⅡ诱导的血管内皮氧化应激效应,改善血管内皮功能,发挥舒张血管、降低血压的作用。
[1] Wimalawansa SJ.Amylin,calcitonin gene-related peptide,calcitonin,and adrenomedullin:a peptide superfamily[J].Crit Rev Neurobiol,1997,11(2-3):167-239.
[2] Taylor MM, Bagley SL, Samson WK.Intermedin/adrenomedullin-2 acts within central nervous system to elevate blood pressure and inhibit food and water intake[J].Am J Physiol Regul Integr Comp Physiol,2005,288(4):R919-927.
[3] Yuan Y,Wang X,Zeng Q,et al.Effects of continuous intermedin infusion on blood pressure and hemodynamic function in spontaneously hypertensive rats[J].J Geriatr Cardiol,2012,9(1):17-27.
[4] Turoni CJ,Maranon RO,Proto V,et al.Nitric oxide modulates reactivity to angiotensin II in internal mammary arterial grafts in hypertensive patients without associated risk factors[J].Clin Exp Hypertens,2011,33(1):27-33.
[5] 陈紫薇,李冬冬,史向党,等.一种体内恒速持续给药的方法:微量渗透泵[J].中国应用生理学杂志,1997,13(3):278-280.
[6] Roh J,Chang CL,Bhalla A,et al.Intermedin is a calcitonin/calcitonin gene-related peptide family peptide acting through the calcitonin receptor-like receptor/receptor activitymodifying protein receptor complexes[J].J Biol Chem,2004,279(8):7264-7274.
[7] Takei Y,Inoue K,Ogoshi M,et al.Identification of novel adrenomedullin in mammals:a potent cardiovascular and renal regulator[J].FEBSLett,2004,556(1-3):53-58.
[8] Bell D,McDermott BJ.Intermedin(adrenomedullin-2):a novel counter-regulatory peptide in the cardiovascular and renal systems[J].Br J Pharmacol,2008,153(Suppl 1):S247-262.
[9] 杨靖辉,贾月霞,任永生,等.中叶素1-53对大鼠动脉血压的影响及其作用机制 [J].中华高血压杂志,2005,13(11):711-715.

