鸡卵类黏蛋白结构与性质研究进展
王 帅,吴子健,*,刘建福,胡志和,王连芬
鸡卵类黏蛋白结构与性质研究进展
王 帅1,吴子健1,*,刘建福1,胡志和1,王连芬2
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.北京食品科学研究院,北 京 100068)
鸡卵类黏蛋白是鸡蛋中最 主要也是过敏原性最强的过敏原蛋白。本文总结该蛋白的结构,包括氨基酸序列、糖基组成、二硫键位置、二级结构以及组成该蛋白的3 个结构域,并描述其理化性质,最后着重分析讨论其 过敏原性,特别是其分子结构中二硫键、糖基和结构域等因素与过敏原性之间的内在联系。
鸡卵类黏蛋白;过敏原性;二硫键;糖基;结构域
鸡蛋具有营养全面且营养素配比平衡的特点[1],可提供均衡的蛋白质、脂类、糖类、矿物质和维生素等营养物质,还含有大量磷脂类物质(包括卵磷脂、脑磷脂、神经磷脂),是一种重要的食品,利于婴幼儿、儿童、发育期青少年的成长发育,特别是利于其大脑和神经系统的发育;同时鸡蛋也是重要的食品加工原料,具有优良的凝胶性、乳化性、起泡性等加工特性,已经被广泛应用于肉制品、糕点、面条、饼干等食品[2-3]。
然而,鸡蛋也是一种主要的食物过敏原来源[4-6],鸡蛋的广泛应用也使得鸡蛋过敏者无法通过规避的方式来解决其食用安全的问题,其对儿童和青少年的潜在危害尤其突出。例如:Cooke等[7]利用双盲安慰剂对照食物激发实验(double-blind placebo-controlled food challenges,DBPCFC)检测出470 例青少年过敏情况中有约66.7%的青少年是对鸡蛋过敏。鸡蛋过敏反应涉及多种器官和系统,包括皮肤、胃肠道、呼吸及中枢神经系统,可引起神经性水肿、湿疹、腹痛、哮喘等[8]。目前已知鸡蛋中过敏原主要有鸡卵类黏蛋白(hen’s egg ovomucoid,HOVM)、卵白蛋白(ovalbumin,OVA)、卵转铁蛋白(ovotransferrin,OTF)和溶菌酶4 种[3],其中HOVM是鸡蛋过敏反应中致敏性最普遍、最强的蛋白,早在1950年,Miller等[9]就通过对342 名鸡蛋过敏患者的皮肤测试发现这4 种蛋白的致敏性依次为:HOVM>OVA>OTF>溶菌酶。因此分析研究HOVM的结构与性质,特别是其结构与其过敏源性的关系具有十分重要的意义,同时也是研究如何有效消减其致敏性的先决条件。
1 HOVM的结构
1.1 HOVM的一级结构
HOVM是一种单亚 基糖蛋白。其蛋白部分含量占75%~80%,由186个氨基酸残基组成,其氨基酸残基序列如图1所示[10],其中N末端为丙氨酸残基,C末端为苯丙氨酸残基[11];整个蛋白中亲水性残基约占50.00%,包括天冬氨酸残基、谷氨酸残基、苏氨酸残基、天冬酰胺残基、赖氨酸残基等;疏水性残基约占32.26%,包括缬氨酸残基、脯氨酸残基、酪氨酸残基、亮氨酸残基、苯丙氨酸残基等;但不含色氨酸残基;其他氨基酸残基约为17.74%,包括15 个甘氨酸残基,18 个半胱氨酸残基,这18 个半胱氨酸残基两两配对形成了9 个二硫键,其位置如表1所示。

图1 HOVM亚基的一级结构的氨基酸序列[10]Fig.1 Amino acid residues sequence of primary structure from HOVM[10]
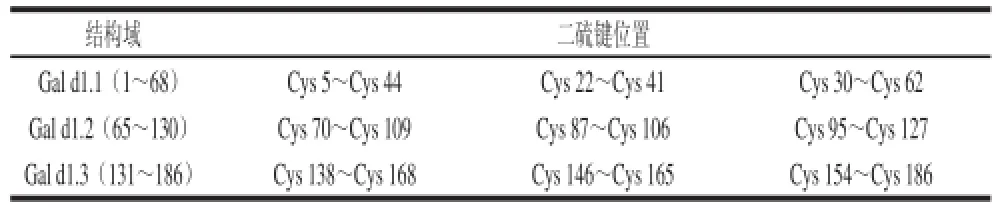
表1 二硫键在结构域中的位置[12]Table 1 Locations of disulfide bonds in each domain[12]

图2 HOVM糖链结构[15]Fig.2 Structure of sugar chains from HOVM[15]
HOVM分子约含有20%~25%的糖基(carbohydrate moiety),通常包含14.00%~16.00%的N-乙酰葡萄糖胺、6.50%~8.50%的甘露糖、0.50%~4.00%的半乳糖以及0.04%~2.20%的唾液酸等单糖残基[13]。该蛋白分子一级序列含有5个N-连接糖基化位点,分别位于结构域1的Asn10和Asn53、结构域2的Asn69和Asn75以及结构域3的Asn175[10],这些位点都具有Asn-X-Thr/Ser序列[14],其中结构域3中的Asn175位点结合糖基概率约为50%,即该结构域有两种,一种含有糖基(糖基分子质量约为3 ku),另一种不含糖基。由于糖链生物合成的差异,HOVM分子的糖基具有高度的微观不均一性[15],含有不同类型的糖基[16-17]。Yamashita等[18]研究指出HOVM所含糖基以三甘露糖五糖核心(即Manα1→6(Manα1→3)Manβ1→4GlcNAcβ1→4GlcNAc)为基础,演化形成了3类五触角杂合型N-连接的糖链基团(penta-antennary complex-type asparagine-linked sugar chains),分别为N-1、N-2和N-3b,N-3b型糖基是这些糖链 共有的结构(图2a),约占整个糖蛋白分子的14%;而N-1型和N-2型是两类N-3b型糖基的衍生物,其中N-1型由二个半乳糖残基通过β1→4糖苷键分别与N-3b型2、3、4位触角的N-乙酰葡萄糖胺共价结合,形成两种同质异构分子(图2b),而N-2型由一个半乳糖残基通过β1→4糖苷键与N-3b型2、3、4位触角的N-乙酰葡萄糖胺共价结合,形成3 种同质异构分子(图2c)[15]。
1.2 HOVM的二级结构及二级以上结构
通常利用圆二色谱法(circular dichroism,CD)和旋光色散法(optical rotatory dispersion,ORD)来测定并计算HOVM分子中二级结构组成。Tomimatsu[19]和Ikeda[20]等分别利用ORD法和CD法测得去除糖基的HOVM二级结构中α-螺旋的比例分别为27%以及26%,Baig等[21]也利用CD法得出未去除糖基的HOVM二级结构中α-螺旋的比例为30%,这些研究数据基本一致。Watanabe等[22]采用CD法并辅以链霉蛋白酶和内-β-乙酰氨基半乳糖苷酶酶解去除蛋白的糖基的方法,同时测定了无糖基以及含糖基的HOVM二级结构组成,其研究结果如表2所示。糖基部分对于HOVM的二级结构中β-折叠和β-转角组分比例影响较大,而对于α-螺旋以及无规卷曲所占比例几乎没有什么影响。

表2 HOVM二级结构类型的组成[22]Table 2 Composition of secondary structure types of HOVM[22]
Kato等[10]利用胰蛋白酶酶解HOVM分子,将其进一步分割成了3个相对独立的同源结构域,即Gal d1.1(氨基酸残基1~68)、Gal d1.2(氨基酸残基 65~130)和Gal d1.3(氨基酸残基131~186),Gal d1.1 和Gal d1.2有50%的同源性,但 Gal d1.3与Gal d1.1和 Gal d1.2的同源性不足30%[7](表1)。进一步的研究发现这3 个结构域的一级结构组成具有相似的特点:1)约含60 个氨基酸残基(其中有两个为酪氨酸残基)[14];2)每个都具有3 个域内二硫键,而各域间没有二硫键相连[7];3)均含一个抗胰蛋白酶酶解作用的活性位点,位于域内的一个开放环区[14];4)每个域都含有糖链,但是Gal d1.1和Gal d1.2各含有2 个糖链,而Gal d1.3只含有1 个糖链(Gal d1.3结构中的另一半不含糖链结构)[10,23-24]。
Watanabe等[22]通过溴化氰(cyanogen bromide,CNBr)将HOVM分子裂解成Gal d1.1和Gal d1.2+ G a l d 1.3,并通过金黄色葡萄球菌蛋白酶V-8(Staphylococcus aureus protease V-8)将HOVM分子酶解成Gal d1.1+Gal d1.2和Gal d1.3,进而分析各结构域中二级结构组成的含量,其结果如表3所示:其中α-螺旋在Gal d1.1中的含量较高,而在G al d1.2与Gal d1.3中含量较低;β-结构在各个结构域中的组分基本一致,不过β-转角在Gal d1.3中含量较低;无规卷曲在Gal d1.2与Gal d1.3中含量较高,而在Gal d1.1中含量较低。
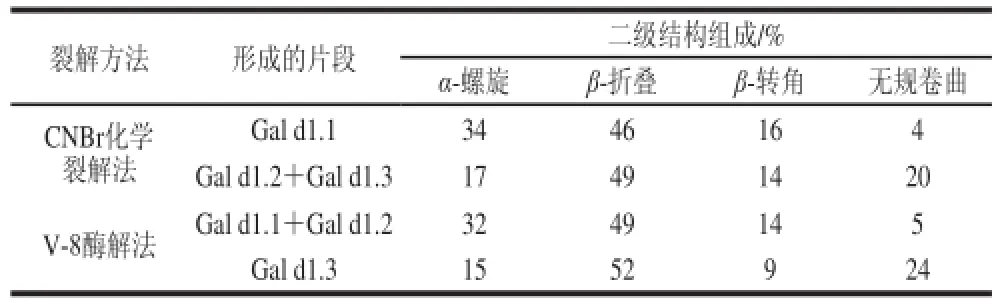
表3 HOVM二级结构组分及其在结构域中的分布[22]Table 3 Secondary structure fractions of HOVM and their distribution in each domain[22]
目前对于HOVM的空间结构还没有直接证据,但不同的禽类卵清卵类黏蛋白具有相同的空间结构组成,因此HOVM的空间模式与源自鹌鹑卵清的卵类黏蛋白十分相似[14]。Weber等[14]指出日本鹌鹑卵清卵类黏蛋白Gal d1.3结构域的空间构型为球形,且大小为3.5 nm×2.7 nm×1.9 nm,包含两条反平行β-折叠(残基Pro22~Gly32)和1 个α-螺旋(残基Asn33~Ser44),同时该结构域内所存在的广泛相互作用使得域内约70%的氨基酸残基形成规正二级结构(β-折叠和α-螺旋)或疏水核心,这些域内稳定的非共价相互作用以及域内含有的3 个二硫键也极大地限制了构象变化,维系着其天然构象的稳定性。
2 HOVM的理化性质
HOVM是鸡卵清中一种较为特殊的蛋白,具有一些独特的理化性质:1)抑制丝氨酸蛋白酶酶解的性能[25],HOVM是一种丝氨酸蛋白酶抑制剂,包括专一性地抑制胰蛋白酶酶解活性,通常1 mg HOVM就可抑制相当于1 mg的胰蛋白酶,特别是对猪和牛的胰蛋白酶具有很强的抑制作用,并且其抑制胰蛋白酶活性也受到加热变性的影响,若将HOVM加热充分,可使其丧失抗胰蛋白酶酶解的活性。但是HOVM对胰凝乳蛋白酶的抑制作用较低,若使其充分加热变性,HOVM可被胰凝乳蛋白酶迅速水解。2)特殊的溶解性能,HOVM具有很好的水溶性能,即使在其等电点处,该蛋白的溶解度也很高,而且HOVM在三氯乙酸盐溶液(约3%~5%)[26]和丙酮溶液(约50%~75%)[27-28]也具有相当高的溶解度,Lineweaver等[25]发现稀释6 倍的鸡蛋清液与热的三氯乙酸钠盐溶液(5%)1∶1混合时,HOVM仍无法沉淀,后来Fredericq等[26]研究发现pH 2.8~4.9、3%~5%范围的三氯乙酸溶液中HOVM溶解度在12.6~16.15 g/L范围内变化不大,而鸡蛋清中其他的蛋白溶解度则变化很大;Lineweaver等[25]还发现即便加热使水溶液中的HOVM变性(即失去对胰蛋白酶酶解的抑制性能),其仍会在pH 4.1处(HOVM的等电点)具有相当的溶解度。因此,选择合适的pH值、丙酮和三氯乙酸盐浓度,可以从蛋清中除去大量的非HOVM[29-30],从而可分离纯化高纯度的HOVM。3)较高的热稳定性,Lineweaver等[25]研究表明HOVM在80 ℃条件下加热30 min后,其对胰蛋白酶酶解抑制活性只损失了约10%;Fraenkel-Conrat等[31]研究发现HOVM置于pH 5.0、7.0溶液中90 ℃加热处理15 min,其活性分别为原来的80%、62%;Fredericq等[26]将HOVM置于pH 3.9溶液中100 ℃加热1 h,其在pH 8.6、离子强度为0.1的二乙基巴比妥酸盐缓冲液的电泳特性没有发生改变。且Deutsch等[30]将HOVM于100 ℃加热1 h后其黏度、电泳和沉降系数结果表明也没有发生变性,但会丧失其生物活性,包括结合特异性抗体能力及其抗胰蛋白酶活性的丧失;Stevens等[27]发现将该蛋白置于pH 6.0、100 ℃加热15 min后其抗胰蛋白酶活性仍为原来的30%;Bleumink等[32]甚至发现煮熟的鸡蛋对鸡蛋过敏患者仍保持过敏原性。4)耐受有机溶剂沉淀或变性的性能,其在中性及偏酸性溶液能够耐受高浓度脲,例如,pH 3.0~7.0条件下将HOVM用9 mol/L尿素25 ℃处理18 h后其胰蛋白酶酶解抑制活性为未处理前的90%,加热至100 ℃处理0.5 h后其活性仍保持66%,但将其置于pH 9.0的碱性条件下80 ℃处理0.5 h后其活性则迅速丧失,不足未处理的10%[25]。
3 HOVM的过敏原性
国内外学者通常通过交叉放射免疫电泳(crossed radioimmunoelectropho-resis,CRIE)[33]、放射性过敏原吸收实验(radioallergo-sorbent test,RAST)[34]、斑点免疫印记(dot-immunoblotting)[35]以及皮肤点刺实验(skinprick test,SPT)[36]检测确定鸡蛋中的过敏原。大量研究表明HOVM是鸡卵清中一种主要的过敏原,如表4所示,其对鸡蛋过敏人群的致敏频率达34%~97%,各个实验所得致敏率的差异可能是由于调查对象个体的不同或者是检测方法有别。由于HOVM自身结构较为稳定,且对蛋白酶(特别是机体消化道蛋白酶)具有抑制性能[39],造成该蛋白过敏原性很难消除,即便利用蛋白酶酶解将其降解 成肽段,这些降解得片段仍保持一定的抗原性和过敏原性,如Matsuda[40]、Gu[41]和Kovacs-Nolan[42]等的研究都发现经胃蛋白酶消化分解得到的HOVM的片段还保留有与整体蛋白相似的抗原性和过敏原性。已有研究表明,HOVM不仅存在一定过敏表位,其蛋白内在结构中的氨基酸残基组成、二硫键、糖基组成等都对其过敏原性的表达具有一定的作用。

表4 HOVM致敏率的测定Table 4 Allergenicity of HOVM
3.1 HOVM中的过敏原表位
目前已知通过热处理或蛋白变性很难消除HOVM过敏原性以及抗原性,这表明引起超敏反应前,抗体(IgE或IgG)与该蛋白结合表位主要是线性表位[40,43]。目前对于该蛋白中的氨基酸残基组成对抗体结合的作用、HOVM与IgE或IgG结合的线性表位以及这些线性表位在3 个结构域中的分布情况已经有了一定的了解:1)氨基酸残基组成对于抗体结合的重要性:Mine等[44]研究指出极性氨基酸残基(丝氨酸残基、苏氨酸残基、酪氨酸残基和半胱氨酸残基)、疏水性氨基酸残基(亮氨酸残基、苯丙氨酸残基和甘氨酸残基)以及侧链带电荷的氨基酸残基(即天冬氨酸残基、赖氨酸残基和谷氨酸残基)对于其与IgG抗体的结合很重要,在参与IgG结合的55 个氨基酸残基中,极性氨基酸 残基占27/55、疏水性氨基酸残基占18/55、侧链带电荷的氨基酸残基占10/55;2)HOVM参与抗体 结合的线性表位及其在结构域中的分布:Cooke等[7]利用合成肽鉴别了5 个IgE结合表位(约7~20 个氨基酸残基长度)和7 个IgG结合表位(约9~34 个氨基酸残基长度);Mine等[44]通过重叠肽膜确定HOVM中有9 个IgE结合表位(约5~16 个氨基酸残基长度)和8 个IgG结合表位(约5~11 个氨基酸残基长度),其在结构域的分布如表5所示。
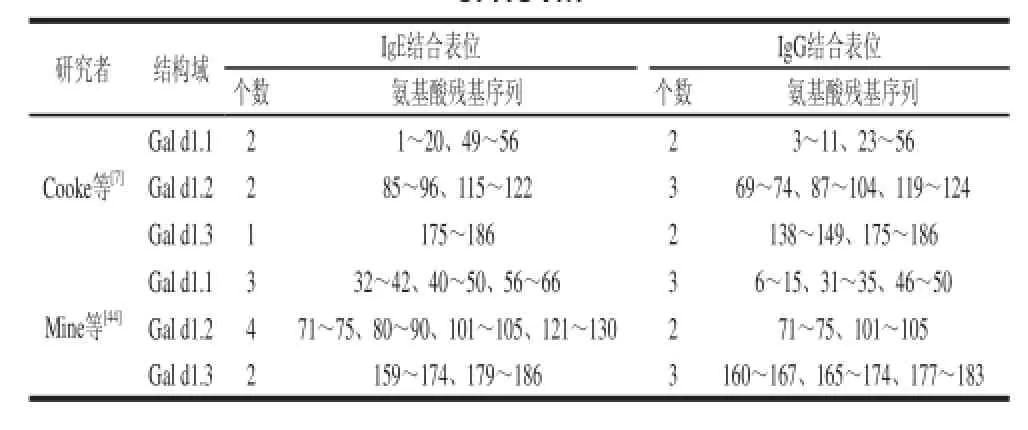
表5 HOVM IgE/IgG结合表位在结构域中的分布Table 5 The distribution of IgE/IgG-binding epitopes in each domain of HOVM
HOVM与IgE或IgG结合引起超敏反应的内在原因不仅由于其线性表位,也有构象表位的原因。Zhang Jiewei等[45]利用CNBr化学裂解法或金黄色葡萄球菌蛋白酶V-8酶解法分别制备得到Gal d1.1或Gal d1.2与Gal d1.3,并通过酶联免疫反应(enzyme-linked immunosorbent assay,ELISA)测定各个结构域与鸡蛋过敏患者血清之间的过敏反应性,发现各个结构域中的IgE和IgG的结合表位主要是线性结构,但还存在构象表位,因为3个结构域与IgE反应性的加和只占到HOVM与IgE总反应性的55%~75%,同样,3个结构域与IgG反应性的加和只占到HOVM与IgG总反应性的50%~60%。HOVM与抗体结合总反应性与这些结构域与抗体结合反应性加和之间的差异主要在于[45-46]:1)连接结构域Gal d1.1与Gal d1.2之间以及结构域Gal d1.2与Gal d1.3之间的氨基酸残基存在着过敏原表位,但在制备各个结构域时被酶解切除了;2)在制备各个结构域的过程中,天然状态的HOVM所具有的过敏原构象表位也许被破坏。
3.2 二硫键对HOVM过敏原性的影响
研究二硫键对HOVM过敏原性作用时,首先将HOVM中的二硫键断裂[7](通常利用的两种方法:过氧甲酸氧化或经二硫苏糖醇等还原剂还原再烷基化)。然后,采用ELISA法检测并比较二 硫键断裂前后的HO VM与IgE或IgG的结合活性。Djurtoft等[35]发现二硫键经方法二断裂后,HOVM与许多鸡蛋过敏者血清中IgE和IgG的结合活性几乎丧失,但也有少量过敏者血清中的IgE和IgG与之结合活性保持不变。Co oke等[7]采用鸡蛋过敏患者血清并按照抑制-ELISA技术研究发现该蛋白中二硫键经方法一断裂后没有显著影响HOVM结合IgE的活性,但显著减少了其与IgG的特异性结合;同时发现二硫键经方法二断开后,HOVM结合IgE的活性显著降低,但其与IgG的结合能力几乎没有变化。Zhang Jiewei等[45]发现该蛋白中二硫键经还原再羧甲基化后,并没有影响HOVM及其各结构域与HOVM特异性IgG抗体结合的数量;但还原二硫键再羧甲基化的Gal d1.3与IgE的结合活性提高(由27.4%增至40.1%),如表6所示。

表6 鸡蛋过敏患者IgE/IgG抗体与HOVM结构域结合活性的平均 百分比[45]Table 6 The average percent activity of human IgG/IgE antibodies specifically bind to HOVM domains from egg-allergic patients[45]
毋庸置疑,二硫键是稳定HOVM空间结构的重要因素之一。前面所提各实验研究所得结果存在一定差异,间接表明构象改变对不同过敏者血清中IgE与HOVM结合活性的影响是不同:优先与构象表位发生反应的过敏者血清中的IgE与二硫键被还原的HOVM结合活性呈下降趋势;而优先与线性表位反应的过敏者血清中IgE与二硫键被还原的HOVM结合活性呈上升趋势[47-48]。
3.3 糖基对HOVM结合IgE/IgG活性的影响
糖基在整个HOVM分子中占有相当的比重,可稳定分子的结构并使其具有耐热、酸、碱以及抗酶解消化的作用[23,49]。研究糖基与HOVM结 合IgE/IgG活性关系,通常预先去除HOVM中的糖基,然后再对比去除糖基前后其与IgE/IgG结合活性的变化。Gu等[41]发现HOVM经三氟甲磺酸(trifluoromethanesulfonic acid,TFMS)去糖基化(去除外周的半乳糖和内部的甘露糖,但仍保留约40%的N-乙酰氨基葡萄糖)后,其免疫活性未发生改变。Besler等[38]也利用TFMS去除糖基(除糖基率约为98.4%)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)免疫印迹法以及酶联变应原吸附实验(enzyme-allerg osorbent tes t experiments,EAST)测定,结果显示去糖基化后的HOVM结合IgE活性并未发生变化。但是去除糖基后,HOVM的热稳定性和抗酶解性能必定下降,自然也会影响到HOVM结合IgE/IgG活性,Gu等[41]发现去除糖基的HOVM较含有糖基的HOVM更容易热变性,进而致使其与IgE结合活性的下降。
另一些研究则比较了含有糖基和未含糖基 的Gal d1.3(即两种形式的Gal d1.3)结合IgE/IgG活性。如前文所叙,Gal d1.3若含有糖基,则该糖基的分子质量约为3 ku。目前的研究结果 显示了两种现象:1)Matsuda等[50]发现含糖基的Gal d1.3与过敏血清中IgE结合 活性明显高于未含糖基的Gal d1.3,且含糖基的Gal d1.3能与过敏血清中IgG结合,而不含糖基的Gal d1.3几乎不与过敏血清中IgG结合;2)Zhang Jiewei等[45]发现未含糖基的Gal d1.3结合鸡蛋过敏者血清中的IgE/IgG的活性明显高于含糖基的,似乎糖基抑制Gal d1.3与IgE结合活性。
3.4 HOVM各结构域的过敏原性
Matsuda等[50]研究显示HOVM所含的3 个结构域都具有与IgE/IgG结合活性,然而究竟是哪个结构域占主导还存在一定的异议。Eigenmann等[51]利用外周血单核细胞(peripheral blood mononuclear cell,PBMC)增殖测试发现,Gal d1.3对T细胞增殖的作用略大于Gal d1.2,但两者差异并不明显,而Gal d1.1却显著降低T细胞的增殖;另外他们还建立了HOVM特异性T细胞系模型,其产生的细胞因子多为Th2样的因子,如白细胞介素-5(interleukin-5,IL-5)、IL-4、干扰素-γ、IL-13。Holen等[52]报道HOVM可促进T细胞的增殖,而最终CD4+/CD8+T细胞得到了富集,且CD2+含量大于95%,同时HOVM可诱导约1%的B细胞合成IgE。Cooke等[7]研究发现IgE会优先结合Gal d1.2,而在数量上3 个结构域结合IgG并无区别,另外PBMC增殖实验结果表明HOVM各个结构域均会提高T细胞增殖,但是Gal d1.1的作用要远远小于Gal d1.2和Gal d1.3。Zhang Jiewei等[45]的研究结果表明IgE/IgG结合活性最高的是Gal d1.3,且HOVM特异性结合IgE抗体以及IgG抗体的比例几乎相同。
4 结 语
HOVM是鸡蛋中最主要的过敏原蛋白,且所引起的过敏反应也是最强烈,严重影响鸡蛋过敏症患者的生活质量甚至是生命安全,因此如何消减该蛋白的过敏原性已成为食源性过敏蛋白的热点问题。目前研究者对其结构、性质以及分子结构与组成对其过敏原性的影响等都有较深入的研究。但 如何利用物理法(加热法和非加热法)、化学法(化学修饰)、酶法以及基因工程法加工HOVM并消减其过敏原性,开发制备安全、低致敏性的鸡蛋类食品仍亟待进一步的研究。
[1] LEE Y H. Food-processing approaches to altering allergenic potential of milk-based formula[J]. The Journal of Pediatrics, 1992, 121(5): S47-S50.
[2] 迟玉杰. 蛋制品加工技术[M]. 北京: 中国轻工业出版社, 2009: 1-3.
[3] 李灿鹏, 吴子健. 蛋品科学与技术[M]. 北京: 中国标准出版社, 2013: 1-2.
[4] HILL D J, HOSKING C S, HEINE R G. Clinical sp ectrum of food allergy in children in Austra lia and South-East Asia: identification and targets for treatment[J]. Annals of Medicine, 1999, 31(4): 272-281.
[5] EGGESBØ M, HALVORSEN R, TAMBS K, et al. Prevale nce of parentally perceived adverse reactions to food in young children[J]. Pediatric Allergy and Immunology, 1999, 10(2): 122-132.
[6] BOCK S A. Prospective appraisal of complaints of adverse reactions to foods in children during the first 3 years of life[J]. Pediatrics, 1987, 79(5): 683-688.
[7] COOKE S K, SAMPSON H A. Allergenic properties of ovomucoid in man[J]. The Journal of Immunology, 1997, 159(4): 2026-2032.
[8] PATRIARCA G, SCHIAVINO D, NUCERA E, et al. Food allergy in children: results of a standardized protocol for oral desensitization[J]. Hepato Gastroenterology-Current Medical and Surgical Trends, 1998, 45(19): 52-58.
[9] MILLER H, CAMPBELL D H. Skin test reactions to various chemical fractions of egg white and their possible clinical significance[J]. Journal of Allergy, 1950, 2 1(6): 522-524.
[10] KATO I, SCHRODE J, KOHR W J, et al. Chicken ovomucoid: determination of its amino acid sequence, determination of the trypsin reactive site, and preparation of all three of its domains[J]. Biochemistry, 1987, 26(1): 193-201.
[11] WAHEED A, SALHUDDIN A. Isolation and characterization of a variant of ovomucoid[J]. Biochemical Journal, 1975, 147: 139-144.
[12] KATO I, KOHR W J, LASKOWSKI JR M. Evolution of avian ovomucoids[J]. FEBS Letters, 1978, 47: 197-206.
[13] BEELEY J G. The isolation of ovomucoid variants differing in carbohydrate composition[J]. Biochemical Journal, 1971, 123: 399-405.
[14] WEBER E, PAPAMOKOS E, BODE W, et al. Crystallization, crystal structure analysis and molecular mo del of the third domain of Japanese quail ovomucoid, a Kazal type inhibitor[J]. Journal of Molecular Biology, 1981, 149(1): 109-123.
[15] PARENTE J P, WIERUSZESKI J M, STRECKER G, et al. A novel type of carbohydrate structure present in hen ovomucoid[J]. Journal of Biological Chemistry, 1982, 257(22): 13173-13176.
[16] 王克夷. 糖蛋白的糖形[J]. 生命的化学, 1 996, 16(5): 6-8.
[17] 李隽群. 糖蛋白中糖链结构的不均一性与信息传递的关系[J]. 黔西南民族师范高等专科学校学报, 1997(3): 67-71.
[18] YAMASHITA K, KAMERLING J P, KOBATA A. Structural study of the carbohydrate moiety of hen ovomucoid. Occurrence of a series of pentaantennary complex-type asparagine-linked sugar chains[J]. Journal of Biological Chemistry, 1982, 257(21): 12809-12814.
[19] TOMIMATSU Y, GAFFIELD W. Optical rotatory dispersion of egg proteins. I. Ovalbumin, conalbumin, ovomucoid, and lysozyme[J]. Biopolymers, 1965, 3(5): 509-517.
[20] IKEDA K, HAMAGUCHI K, YAMAMOTO M, et al. Circular dichroism and optical rotatory dispersion of trypsin inhibitors[J]. Journal of Biochemistry, 1968, 63(4): 521-531.
[21] BAIG M A, SALAHUDDIN A. Occurrence and characterization of stable intermediate state(s) in the unfolding of ovomucoid by guanidine hydrochloride[J]. Biochemistry, 1978, 171: 89-97.
[22] WATANABE K, MATSUDA T, SATO Y. The secondary structure of ovomucoid and its domains as studied by circular dichroism[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure, 1981, 667(2): 242-250.
[23] MINE Y, YANG M. Recent advances in the understanding of egg allergens: basic, industrial, and clinical perspectives[J]. Journal of Agricultural and Food Chemistry, 2008, 56(13): 4874-4900.
[24] BENEDÉ S, LÓPEZ-FANDIÑO R, RECHE M, et al. Influence of the carbohydrate moieties on the immunoreactivity and digestibility of the egg allergen ovomucoid[J]. PLoS One, 2013, 8(11): e80810. doi: 10.1371/journal.pone.0080810.
[25] LINEWEAVER H, MURRAY C W. Identification of the trypsin inhibitor of egg white with ovomucoid[J]. Journal of Biological Chemistry, 1947, 171(2): 565-581.
[26] FREDERICQ E, DEUTSCH H F. Studies on ovomucoid[J]. Journal of Biological Chemistry, 1949, 181(2): 499-510.
[27] STEVENS F C, FEENEY R E. Chemical modification of avian ovomucoids[J]. Biochemistry, 1963, 2(6): 1346-1352.
[28] 史晓霞. 蛋清卵类黏蛋白分离纯化, 结构表征及其过敏原性的研究[D].武汉: 华中农业大学, 2012: 18-24.
[29] MATSUDA T, WATANABE K, NAKAMURA R. Immunochemical studies on thermal denaturation of ovomucoid[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1982, 707(1): 121-128.
[30] DEUTSCH H F, MORTON J I. Immunochemical properties of heated ovomucoid[J]. Archives of Biochemistry and Biophysics, 1956, 64(1): 19-25.
[31] FRAENKEL-CONRAT H, BEAN R C, DUCAY E D, et al. Isolation and characterization of a trypsin inhibitor from lima beans[J]. Archives of Biochemistry and Biophysics, 1952, 37(2): 393-407.
[32] BLEUMINK E, YOUNG E. Studies on the atopic allergen in hen’s egg[J]. International Archives of Allergy and Immunology, 1969, 35(1): 1-19.
[33] LANGELAND T. A clinical and immunological study of allergy to hen’s egg white[J]. Clinical & Experimental Allergy, 1983, 13(4): 371-382.
[34] HOFFMAN D R. Immunochemical identification of the allergens in egg white[J]. Journal of Allergy and Clinical Immunology, 1983, 71(5): 481-486.
[35] DJURTOFT R, PEDERSEN H S, AABIN B, et al. Studies of food allergens: soybean and egg proteins[M]// FRIEDMAN M. Nutritional and Toxicological Consequences of Food Processing. Springer US, 1991: 281-293.
[36] BERNHISEL-BROADBENT J, DINTZIS H M, DINTZIS R Z, et al. Allergenicity and antigenicity of chicken egg ovomucoid (Gal d III) compared with ovalbumin (Gal d I) in children with egg allergy and in mice[J]. Journal of Allergy and Clinical Immunology, 1994, 93(6): 1047-1059.
[37] AABIN B, POULSEN L K, EBBEHØJ K, et al. Identification of IgE-binding e gg white proteins: comparison of results obtained by different methods[J]. International Archives of Allergy and Immunology, 1996, 109(1): 50-57.
[38] BESLER M, ST EINHART H, PASCHKE A. Allergenicity of hen’s eggwhite proteins: IgE binding of native and deglycosylated ovomucoid[J]. Food and Agricultural Immunology, 1997, 9(4): 277-288.
[39] 唐传核, 彭志英. 低过敏以及抗过敏食品研究进展[J]. 食品与发酵工业, 2000, 26(4): 44-49.
[40] MATSUDA T, GU J, TSURUTA K, et al. Immunoreactive glycopeptides separated from peptic hydrolysate of chicken egg white ovomucoid[J]. Journal of Food Science, 1985, 50(3): 592-594.
[41] GU J, MATSUDA T, NAKAMURA R, et al. Chemical deglycosylation of hen ovomucoid: protective effect of carbohydrate moiety on tryptic hydrolysis and heat denaturation[J]. Journal of Biochemistry, 1989, 106(1): 66-70.
[42] KOVACS-NOLAN J, ZHANG Jiewei, HAYAKAWA S, et al. Immunochemical and structural analysis of pepsin-digested egg white ovomucoid[J]. Journal of Agricultural and Food Chemistry, 2000, 48(12): 6261-6266.
[43] KURISAKI J, KONISHI Y, KAMINOGAWA S, et al. Studies on the allergenic structure of hen ovomucoid by chemical and enzymic fragmentation[J]. Agricultural and Biological Chemistry, 1981, 45(4): 879-886.
[44] MINE Y, ZHANG Jiewei. Identification and fine mapping of IgG and IgE epitopes in ovomucoid[J]. Biochemical and Biophysical Research Communications, 2002, 292(4): 1070-1074.
[45] ZHANG Jiewei, MINE Y. Characterization of IgE and IgG epitopes on ovomucoid using egg-white-allergic patients’ sera[J]. Biochemical and Biophysical Research Communications, 1998, 253(1): 124-127.
[46] KONISHI Y, KURISAKI J, KAMINOGAWA S, et al. Localization of allergenic reactive sites on hen ovomucoid[J]. Agricultural and Biological Chemistry, 1982, 46: 305-307.
[47] BESLER M, PETERSEN A, STEINHART H, et al. Identification of IgE-binding peptides derived from chemical and enzymatic cleavage of ovomucoid (Gal d 1)[C]//Internet Symposium on Food Allergens, Hamburg: Institute of Biochemistry and Food Chemistry, 1999: 1-12.
[48] BESLER M, MINE Y. The major allergen from hen’s egg white: ovomucoid (Gal d 1)[J]. Internet Symposium on Food Allergens, 1999, 1(4): 137-146.
[49] BREITENEDER H, MILLS E N. Molecular properties of food allergens[J]. Journal of Allergy and Clinical Immunology, 2005, 115(1): 14-23.
[50] MATSUDA T, NAKASHIMA I, NAKAMURA R, et al. Specificity to ovomucoid domains of human serum antibody from allergic patients: comparison with anti-ovomucoid antibody from laboratory animals[J]. Journal of Biochemistry, 1986, 100(4): 985-988.
[51] EIGENMANN P A, HUANG S K, SAMPSON H A. Characterization of ovomucoid-specific T-cell lines and clones from egg-allergic subjects[J]. Pediatric Allergy and Immunology, 1996, 7(1): 12-21.
[52] HOLEN E, ELSAYED S. Specific T cell lines for ovalbumin, ovomucoid, lysozyme and two OA synthetic epitopes, generated from egg allergic patients’ PBMC[J]. Clinical & Experimental Allergy, 1996, 26(9): 1080-1088.
Recent Advances in Understanding the Structure and Characteristics of Hen’s Egg Ovomucoid
WANG Shuai1, WU Zi-jian1,*, LIU Jian-fu1, HU Zhi-he1, WANG Lian-fen2
(1. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China; 2. Beijing Academy of Food Sciences, Beijing 100068, China)
Hen’s egg ovomucoid (HOVM) is the most dominant allergic protein with the strongest allergenicity in egg. In this paper, the structure and characteristics of HOVM are reviewed with respect to amino acid sequences, carbohydrate moieties, disulfide bond positions and three tandem domains. Meanwhile, the physicochemical properties of HOVM are also described. The emphasis is put on discussing its allergenicity, especially its intrinsic relationships with structural features such as disulfide bonds, carbohydrate moieties and three domains
hen’s egg ovomucoid; allergenicity; disulfide bond; carbohydrate moiety; domain
R392.1
A
1002-6630(2014)17-0326-06
10.7506/spkx1002-6630-201417061
2014-05-26
天津市应用基础与前沿技术研究计划面上项目(14JCYBJC30900)
王帅(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:wswangshuaiws@126.com
*通信作者:吴子健(1973—),男,副教授,硕士,研究方向为食品生物技术。E-mail:wzjian@tjcu.edu.cn

