18F-FDG PET/CT评估体部伽玛刀治疗非小细胞肺癌的疗效研究*
康静波 方恒虎 杜 锐 赵向飞 梁英魁 赵文锐
18F-FDG PET/CT评估体部伽玛刀治疗非小细胞肺癌的疗效研究*
康静波①方恒虎①杜 锐①赵向飞①梁英魁②赵文锐②

目的:通过对比实体瘤治疗疗效PET评价标准(PERCIST)与目前广泛应用的传统实体瘤疗效评价标准(RECIST)在评估体部伽玛刀治疗非小细胞肺癌(NSCLC)疗效上的差异,探讨18F-FDG PET/CT在评估体部伽玛刀治疗NSCLC中的价值。方法:82例NSCLC患者伽玛刀治疗后未行任何抗肿瘤治疗,于伽玛刀治疗前及治疗后3个月行CT及18F-FDG PET/CT检查,分别用RECIST1.1和PERCIST1.0评价标准进行近期疗效评价,并分析两者与总生存期(OS)的相关性。结果:应用RECIST1.1和PERCIST1.0标准评价近期疗效存在显著差异(P=0.0001);单因素方差分析显示,TNM分期、ΔSUL及PERCIST是体部伽玛刀治疗NSCLC过程中与OS显著相关的因素,而ΔV、RECIST、肿瘤位置、年龄、KPS评分以及病理学类型则与OS不相关;多变量Cox比例风险回归分析显示,PERCIST1.0(CMR与非CMR)是预测OS最显著的独立预后因素。结论:应用18F-FDG PET/CT对进行体部伽玛刀治疗的NSCLC患者进行近期及远期疗效评价可能较CT更准确。
氟-18-氟代脱氧葡萄糖;PET/CT;体部伽玛刀;非小细胞肺癌
[First-author’s address] Department of Radiation Oncology, Navy General Hospital, Bejing 100048, China.
氟-18-氟代脱氧葡萄糖(Fluorine-18-fluorodeoxyglucose,18F-FDG)PET/CT作为肿瘤诊断和临床分期的重要方法,已被国内外广泛接受。目前已有证据表明18FDG-PET还可以作为评价肿瘤治疗疗效的重要临床工具[1]。本研究旨在探索使用18F-FDG-PET/CT评估立体定向放射治疗非小细胞肺癌(non-small-cell carcinoma,NSCLC)的疗效及相关影响因素。
18F-FDG PET/CT的显像原理:恶性肿瘤中肿瘤组织代谢增强、细胞增殖加快,其在分子水平表现为葡萄糖转运蛋白的mRNA和葡萄糖转运蛋白水平的提高,使得葡萄糖的类似物FDG在高代谢部位和恶性肿瘤组织内异常浓聚,因此在肿瘤病变的定性上有较高的特异性和准确性,能够在分子代谢水平而非肿瘤体积显现出更加明显的变化[2]。所以,治疗后肿瘤体积的缩小程度不是反映治疗疗效的最好指标,而FDG的摄取量的变化应该是更为可靠的指标。PET/CT是功能代谢显像和解剖影像的融合,可以更好地评价治疗效果。
体部伽玛刀治疗NSCLC的疗效评价尚无统一标准。近年来,实体瘤治疗疗效PET标准(PERCIST)已被提议作为一种新的标准化的方法来从代谢水平定量评估放射治疗的疗效。本研究旨在通过对比PERCIST标准与目前广泛应用的传统的实体瘤疗效评价标准(RECIST)在评估体部伽玛刀治疗NSCLC疗效上的差异,探讨18F-FDG PET/CT在评估体部伽玛刀治疗NSCLC疗效中的价值。
1 资料与方法
1.1 一般资料
选取2008年3月至2010年2月在海军总医院肿瘤诊疗中心住院、经伽玛刀治疗的有完整的病案记录及随访资料的NSCLC患者82例,其中男性44例,女性38例;年龄47~79岁,平均年龄64岁;腺癌40例,鳞癌37例,其他5例。
患者入选条件:①经组织学或细胞学病理确诊的NSCLC患者;②2002年国际抗癌联盟(UICC)NSCLC的TNM分期标准分期为Ⅱa期(16例)、Ⅱb期(20例)、Ⅲa期(26例)和Ⅲb期(20例);③预期总生存期(overall survival,OS)>3个月;④血常规、凝血功能大致正常,心脏、肺、肝脏及肾功能基本正常,无伽玛刀治疗禁忌证;⑤KPS评分≥60分;⑥治疗前签署知情同意书。82例患者在接受此次立体定向放射治疗前可以行手术治疗、化疗或放射治疗等综合抗肿瘤治疗,但此次伽玛刀治疗后未再行任何手术及放化疗。
1.2 治疗方法
(1)立体定向放射治疗方法。采用设备为OURQGD型立体定向体部γ射线放射治疗系统。患者仰卧或俯卧于三维立体定向体架中,体架内置负压袋,抽真空固定躯体,CT3~5 mm层距扫描病灶,记录N型尺值、重复定位尺值及患者体表标记点的X、Y、Z坐标参数并仔细核准后,将获得的图像资料和相关数据输入治疗计划系统进行三维立体重建,勾画肿瘤靶区及计划靶区,并根据临床需要调整靶点及进行几何优化。用55%~70%的等剂量线包绕计划靶区,3.0~4.5 Gy/次,治疗次数为10~13次。治疗计划完成后,将治疗计划传输至立体定向放射治疗控制台,由2名以上技师核对X、Y、Z坐标值进行治疗。根据患者身体情况决定每日或隔日治疗。
(2)PET/CT及CT检查方法。18F-FDG由美国GE公司生产的RDS-11型回旋加速器和热室合成,放化纯度>95%。显像仪器为GE Discovery ST PET/ CT。所有患者均在治疗前和治疗后3个月接受PET/ CT检查。检查前禁食6 h以上,常规检测血糖,如果血糖水平高于正常给予相应剂量胰岛素,待血糖正常后再注射18F-FDG。平静状态下经三通管静脉注射18F-FDG 222~444 MBq,休息40~60 min后饮水及排尿,然后行胸部憋气PET/CT检查。检查中CT扫描条件为:管电压140 kV、管电流120~150 mA、螺距0.75 cm,PET扫描时间为2.5~4.0 min/床位,全部采集时间约15~20 min。采集后进行图像重建,获得横断位、矢状位和冠状位图像。最后将PET和CT图像分别传送到AW工作站和Xeleris工作站进行融合图像处理。CT扫描采用64排螺旋CT扫描,管电压120 kV,管电流250 mAs,扫描层厚2.5 mm,间隔2.5 mm,AW工作站进行图像处理。
(3)图像分析。根据图像的横断面、冠状面及矢状面3个不同截面确定异常18F-FDG摄取灶的位置,在CT图像所示的病灶部位勾划感兴趣区(region of interest,ROI);在病灶放射性摄取最高的横断面根据受检者体重、注射剂量、注射时间和ROI放射性计数自动计算出标准瘦体重摄取值SUL(SUV lean,standardized uptake value lean)。SUL=每克组织平均放射性活度÷(注射核素的放射性活度÷瘦体重)。计算治疗前及治疗3个月后的SUL变化率(ΔSUL)[(治疗前SUL-治疗后SUL)÷治疗前SUL]。计算治疗前及治疗3个月后的V变化率(ΔV),V=肿瘤体积[(治疗前V-治疗后V)÷治疗前V]。
由2名核医学科医生和2名放射科医师对所有病灶的18F-FDG PET/CT图像及CT图像进行评价分析。
(4)分别采用RECIST1.1和PERCIST1.0评价标准[3-4]进行近期疗效评价。RECIST1.1评价标准包括:①完全缓解(CR),病灶消失;②部分缓解(PR),基线病灶长径缩小30%;③进展(PD),基线病灶长径增加≥20%或出现新病灶;④稳定(SD),基线病灶长径有缩小但未达PR或有增加但未达PD。
PERCIST1.0评价标准包括:①完全代谢缓解(CMR),可测量靶病灶18F-FDG摄取完全消失,低于平均摄取值,且不能与周围血池本底相区别。所有其他病灶消失,摄取值与血池本底水平相当。需记录可测量区域SUL降低的百分比及治疗后的时间;②部分代谢缓解(PMR),可测量靶病灶18F-FDG SUL峰值降低至少30%。SUL绝对值下降至少0.8倍SUL单位。不要求肿瘤18F-FDG摄取范围减少,无新病灶出现;③代谢恶化(PMD),18F-FDG SUL峰值增加30%,且肿瘤峰值SUL较基线增加0.8倍SUL单位,有典型肿瘤影像表现,需除外炎症或治疗效应,或18F-FDG肿瘤摄取的可见范围扩大,或出现新病灶,有高摄取,具备肿瘤影像,除外炎症或治疗效应;④代谢无变化(SMD),不是CMR、PMR或PMD。
1.3 统计学方法
所有数据均在SPSS 13.0统计软件包进行统计分析,对可能影响OS的各种临床因素作偏相关分析、单因素方差分析、多变量Cox比例风险回归与相关分析,数据统计均以P<0.05为差异有统计学意义。
2 结果
所有患者在伽玛刀治疗前和治疗后3个月行PET/ CT检查时的血糖水平均低于8.31 mmol/L。伽玛刀治疗前后PET/CT检查中的18F葡萄糖摄取时间无显著性差异。伽玛刀治疗前及伽玛刀治疗后3个月两次行PET/CT检查的时间间隔为(140±13)d。通过患者的身高和体重计算出瘦体重。
2.1 RECIST和PERCIST的疗效评价
在RECIST疗效评价中,肿瘤直径的退缩率为(75.52±28.75)%。根据RECIST 1.1标准的疗效评价结果为:37例CR,35例PR,5例SD和5例PD。在PERCIST疗效评价中,肿瘤SUL峰的减低率为(63.57±28.40)%。根据PERCIST1.0标准的疗效评价结果为:27例CMR,30例PMR,13例SMD和12例PMD。在分别以RECIST和PERCIST为标准的疗效分级评估中,结果差异显著(见表1)。

表1 应用PERCIST和RECIST进行疗效评价的对比
2.2 单因素方差分析
OS与各临床病理因素(如伽玛刀治疗反应,包括ΔSUL,ΔV;TNM分期;病理学类型;年龄;KPS评分;肿瘤大小;肿瘤位置)之间的关系见表2。在本研究中,TNM分期、ΔSUL及PERCIST是与OS显著相关的因素。而ΔV、RECIST、肿瘤位置、年龄、KPS评分以及病理学类型均不与OS显著相关。

表2 影响体部伽玛刀治疗NSCLC患者OS的各因素单变量分析
2.3 多变量Cox比例风险回归分析
在诸多疗效评估参数中(如ΔSUL,ΔV,RECIST 1.1,PERCIST1.0等),PERCIST1.0(CMR与非CMR)是多变量Cox比例风险回归分析中能预测OS最显著的独立预后因素(见表3)。
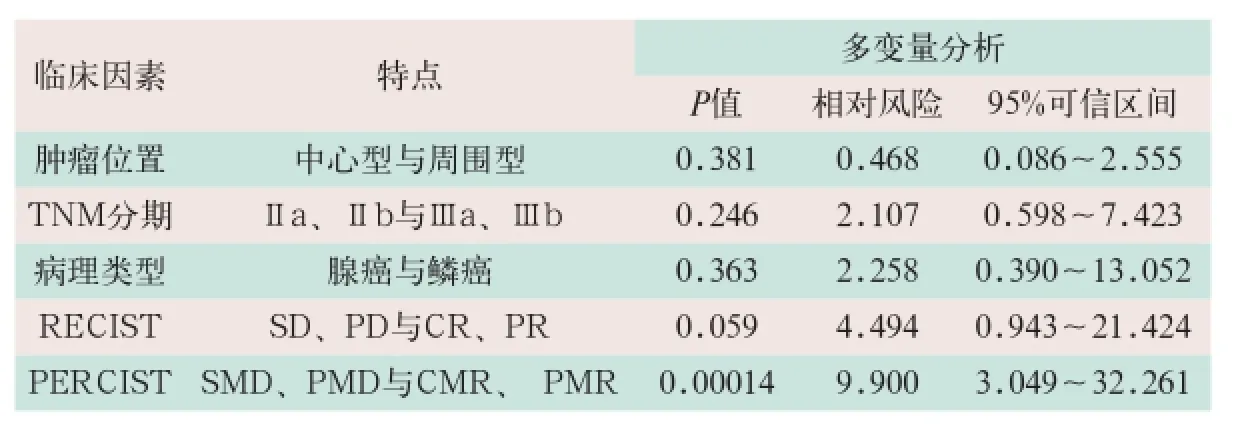
表3 体部伽玛刀治疗NSCLC患者不同预后参数的多变量分析
3 讨论
PET评价疗效常用的指标为治疗前后的ΔSUV,但有时也用修正后的ΔSUL评价。当ΔSUV在80%以上时其预测肿瘤完全缓解的灵敏度、特异性和准确率分别为90%、100%和96%[5]。在Cerfolio等[6]的一项研究中以ΔSUV>75%作为肿瘤CR的标准,而ΔSUV>55%作为肿瘤PR的标准。
评价疗效时还需注意PET/CT检查时间窗的选择。Pottgen等[7]研究也发现,化疗前后SUV的下降程度与疗效密切相关,疗效好的患者SUV的降低更显著,而且SUV显著下降及治疗有效的患者复发率明显低于治疗无明显效果的患者。放射治疗可直接或间接地损伤肿瘤细胞,引起DNA损伤或非DNA病变,而与放射损伤的修复有关的几个生化旁路是消耗ATP的过程,糖酵解与有氧氧化是细胞内产能的主要途径,因此放射治疗后一段时间内肿瘤细胞代谢虽然减低但细胞损伤可导致继发反应的糖代谢增加,两者互相抵消使肿瘤的18F-FDG浓聚程度保持不变甚至增加;化疗后全身骨髓等组织可出现反应性增生,放射性摄取增高。通常认为放化疗前及放射治疗后2~3个月或第3化疗疗程开始前分别行PET/CT显像对疗效的评价比较准确。Kong等[8]对15例NSCLC患者进行的初步研究结果显示,放射治疗中与放射治疗后3~4个月的代谢反应和最高FDG活性显著相关。这一结果提示可以使用放射治疗中的PET反应(在近45 Gy时)来预测肺癌的长期生存率,后续研究可采用大样本病例来验证此结果,并证实放射治疗中的18F-FDG活性是否可作为调整剩余治疗方案的指标。
Sasaki等[9]最早报告了SUV(临界值=5)可以作为放射治疗患者的预后因子。Bollineni等[10]对132例I期不可手术的NSCLC患者进行立体定向射频消融放射治疗(SABR)。SABR后12周进行单一PET检查后定期CT随访,研究结果显示,18F-FDG摄取值(SUV(max)≥5.0)提示局部复发的风险。因此在12周进行18F-FDG-PET扫描,结果可用于预测局部复发风险并制定与之相适应的随访方案。Zhang等[11]的研究结果也显示,SBRT后6个月进行PET扫描所得SUV值与NSCLC的局部复发率有关。SBRT治疗6个月后进行PET扫描所得高SUV(>5)则高度怀疑局部复发,考虑到PET可能出现假阳性结果,因此建议进行活检确诊是否复发。值得注意的是,治疗前PET SUV(max)并不能预测SBRT治疗早期NSCLC患者的纵隔转移、远端转移或总体生存期[12]。Coon等[13]使用PET/CT对射波刀治疗I期NSCLC、肺癌复发和肺转移患者进行的研究结果显示,PET/CT在分期、计划和评估治疗反应很有价值并且可以预测远期治疗结果。
SUV对各期肺癌的预后价值不同,对I~II及Ⅲ期患者SUV有预后价值,而对Ⅳ期无预后价值。I~II期与Ⅲ期比较,SUV对Ⅲ期患者的预后价值更大。本研究发现:应用RECIST1.1和PERCIST1.0标准评价近期疗效存在显著差异;单因素方差分析示TNM分期、ΔSUL及PERCIST是体部伽玛刀治疗NCSLC患者过程中与OS显著相关的因素,而ΔV、RECIST、肿瘤位置、年龄、KPS评分以及病理学类型则不与OS相关;多变量Cox比例风险回归分析显示PERCIST 1.0(CMR与非CMR)为可以预测OS最显著的独立预后因素。
因此,有理由认为应用18F-FDG PET/CT对进行体部伽玛刀治疗的NSCLC患者进行近期及远期疗效评价可能较CT更准确,但尚需更多的病例积累及更深入的研究来进一步证实。
[1]Shankar LK,Hoffman JM,Bacharach S,et al.Consensus recommendations for the use of18F-FDG PET as an indicator of therapeutic response in patients in National Cancer Institute Trials[J].J Nucl Med,2006,47(6):1059-1066.
[2]Hicks RJ.Role of18F-FDG PET in Assessment of Response in Non-small Cell Lung Cancer[J]. J Nucl Med,2009,50:31S-42S.
[3]Wahl RL,Jacene H,Kasamon Y,et al.From RECIST to PERCIST:Evolving Considerations for PET Response Criteria in Solid Tumors[J].J Nucl Med,2009,50(Suppl 1):122S-150S.
[4]李宏奇,吴伟章,王颖杰,等.采用体部伽马刀治疗肺转移瘤的安全性研究[J].中国医学装备,2013,10(7):80-83.
[5]赵军.PET/CT在肿瘤学中的应用进展[J].中国医疗器械信息,2007,13(7):5-7,35.
[6]Cerfolio RJ,Bryant AS,Winokur TS,et al.Repeat FDG-PET after neoadjuvant therapy is a predictor of pathologic response in patients with non-small cell lung cancer[J].Ann Thorac Surg,2004,78(6):1903-1909.
[7]Pöttgen C1,Levegrün S,Theegarten D,et al.Value of18F-fluoro-2-deoxy-D-glucosepositron emission tomography/computed tomography in non-small-cell lung cancer for prediction of pathologic response and times to relapse after neoadjuvant chemoradiotherapy[J]. Clin Cancer Res,2006,12(1):97-106.
[8]Kong FM,Frey KA,Quint LE,et al.A pilot study of [18F]fluorodeoxyglucose-positron emission tomography scans during and after radiationbased therapy in patients with non smallcell lung cancer[J].J Clin Oncol,2007,25(21):3116-3123.
[9]Sasaki R,Komaki R,Macapinlac H,et al.[18F] fluorodeoxyglucose uptake by positron emission tomography predicts outcome of non-small-cell lung cancer[J].J Clin Oncol,2005,23(6):1136-1143.
[10]Bollineni VR,Widder J,Pruim J,et al.Residual18F-FDG-PET uptake 12 weeks after stereotactic ablative radiotherapy for stage I non-small-cell lung cancer predicts local control[J].Int J Radiat Oncol Biol Phys,2012,83(4):e551-555.
[11]Zhang X,Liu H,Balter P,et al.Positron emission tomography for assessing local failure after stereotactic body radiotherapy for non-smallcell lung cancer[J].Int J Radiat Oncol Biol Phys,2012,83(5):1558-1565.
[12]Burdick MJ,Stephans KL,Reddy CA,et al.Maximum standardized uptake value from staging FDG-PET/CT does not predict treatment outcome for early-stage non-smallcell lung cancer treated with stereotactic body radiotherapy[J].Int J Radiat Oncol Biol Phys,2010,78(4):1033-1039.
[13]Coon D,Gokhale AS,Burton SA,et al.Fractionated stereotactic body radiation therapyin the treatment of primary, recurrent,and metastatic lung tumors:the role of positron emission tomography/computed tomographybased treatment planning[J].Clinical Lung Cancer,2008,9(4):217-221.
Study on using 18F-FDG PET/CT to assess the efficacy of body gamma knife treatment ofnon-small cell lung cance
r/KANG Jing-bo, FANG Heng-hu, DU Rui, et al// China MedicalEquipment,2014,11(8):18-22.
Objective: Discuss the value of18F-FDG PET / CT in assessing the efficacy of body gamma knife treatment on non-small cell lung cancer by comparing PET Response Criteria in Solid Tumors (PERCIST) and the widely used conventional Response Evaluation Criteria in Solid Tumors (RECIST). Methods: Eighty-two patients with non-small cell lung cancer who received no other anti-tumor therapies after the gamma knife treatment were studied. Radio therapeutic lesion responses were evaluated using CT and18F-FDG PET according to the RECIST and PERCIST methods. The CT and PET/CT scans were obtained before and about 3 months after body gamma knife. Associations were statistically analyzed between overall survival and clinic opathologic results. Results: There was a significant difference in response classification between RECIST and PERCIST (Wilcoxon signed-rank test, P=0.0001). Univariate analysis showed that TNM stage, ΔSUL and PERCIST were significant factors associated with overall survival in this study, while ΔV, RECIST, tumor location, age, Karnofsky scores and histology were not. Multivariate Cox proportional hazards regression analysis showed PERCIST1.0 (CMR and non-CMR) is the most significant independent prognostic factor which is able to predict OS. Conclusion: PERCIST might be considered more suitable for evaluation of radio therapeutic response to NSCLC than RECIST.
Fluorine-18-fluorodeoxyglucose; PET/CT; Body gamma knife; Non-small cell lung cancer
1672-8270(2014)08-0018-05
R734.2
A
10.3969/J.ISSN.1672-8270.2014.08.006
2014-02-27
全军科技攻关项目(06G034)“中药与现代技术优化对恶性肿瘤的防治研究”;首都医学发展科研基金(2007-3031)“PET/CT在伽玛刀治疗肿瘤定位中的价值”;中华国际医学交流基金会抗肿瘤专项基金(CIMF-F-H001-209)“体部伽玛刀联合恩度治疗老年非小细胞肺癌的临床研究”
①海军总医院肿瘤诊疗中心 北京 100048
②海军总医院核医学科 北京 100048
康静波,男,(1963- ),硕士,主任医师。海军总医院肿瘤诊疗中心,从事肿瘤放化综合伽玛刀及射波刀治疗。

