不同品种马兰的活性组分及抑制蛋白糖基化功能
朱晓琳,刘跃钧,陆 敏,吕丽爽,*
不同品种马兰的活性组分及抑制蛋白糖基化功能
朱晓琳1,刘跃钧2,陆 敏1,吕丽爽1,*
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.浙江省丽水市林业科学研究所,浙江 丽水 323000)
选取10 个品种马兰(M1~M10)为研究对象,测定M1~M10的β-胡萝卜素、多酚、黄酮和皂苷的含量;并初步分析10 个品种马兰抑制蛋白糖基化的活性及其与各功能成分之间的关系。结果表明:马兰中的活性成分含量较高,其中M2、M5的β-胡萝卜素含量最高;M3、M10的多酚和黄酮含量最多;M4、M6的皂苷含量最高。10 个品种马兰粗提物具有良好的抑制蛋白糖基化效果,抑制率达到49%~71%。马兰对由甲基乙二醛(methylglyoxal,MGO)和乙二醛(glyoxal,GO)引发的蛋白质的非酶糖基化反应的抑制作用与其多酚含量和黄酮含量呈现一定的线性关系;而皂苷含量仅与对MGO引起的非酶糖基化反应的抑制作用呈现一定的线性关系。
马兰;黄酮;蛋白质非酶糖基化
马兰(Kalimeris indica(L.)Sch-Bin.)为菊科马兰属植物的带根全草,各地又有泥鳅串、鸡儿肠、田边菊等称法,是多年生草本植物。我国江浙一带自古就作为蔬菜食用。据《本草纲目》载:根、叶,主诸疟及腹中急痛,痔疮。现代医学认为,马兰性凉味辛,有凉血、清热、利湿、解毒等功效。与一般蔬菜比较,其Se、Zn、Mg、Ca含量更高[1-2]。目前马兰中已分离得到的化合物主要有皂苷类物质和甾醇类物质[3-9]。而正是这些活性成分,可能与马兰的功能有着密不可分的关系。
近年来,活性二羰基化合物如:甲基乙二醛(methylglyoxal,MGO)和乙二醛(glyoxal,GO)引起了人们的广泛关注,它不仅是食品颜色和香气的前体物质,更是引起糖尿病并发症的前体物质[10-12]。MGO和GO是人体内产生代谢的主要活泼羰基化合物,极易与含有赖氨酸、精氨酸和半胱氨酸残基的蛋白质反应,最终形成与糖尿病密切相关的糖基化终产物(advanced glycationend products,AGEs)。有研究发现,在体外培养的人血红细胞中,当血糖升高时MGO浓度增大[13];而且在糖尿病患者和链唑霉素诱导的糖尿病大鼠血液中也发现MGO水平升高[14-15]。体外实验表明MGO会与蛋白质快速发生反应[16],即便是MGO处于生理浓度下[17],生成具有荧光特性的产物,产物特征与蛋白质在衰老和糖尿病患者体内特征相似[18]。2002年,首次报道油炸和烘焙食品中含有致癌性物质丙烯酰胺,Mottram等[19]就用天冬酰胺和糖的模型研究了美拉德反应生成丙烯酰胺的途径。后来他们进一步证明了MGO是生成丙烯酰胺的中间产物。
已有研究发现,茶多酚可以通过抑制机体糖基化的进行,降低机体糖基化产物的含量来缓解高糖环境下糖基化诱导的肾脏损伤[20]。无糖浆果的植物化学提取物能抑制蛋白的糖化,这种抗糖化效果归因于提取物清除活性羰基的能力,酚类化合物如儿茶素,可以通过与它们形成加合物来清除反应性羰基化合物[21]。饮食中的黄酮类化合物:芦丁、儿茶素、木犀草素、槲皮素,对甲基乙二醛介导糖基化终产物的形成表现出显著的抑制作用[22]。徐惠琴等[23]发现山茱萸环烯醚萜总苷对由糖尿病血管并发症引起的氧化应激损伤具有保护作用,能提高超氧化物歧化酶的含量,抑制非酶糖化终产物的形成,阻止其对超氧化物歧化酶的破坏作用。本实验旨在分析比较10 个品种马兰的营养成分,并讨论10 个品种马兰抑制蛋白质糖基化的抑制作用及与各种活性物质含量的关系,为马兰的深加工利用提供理论依据,从而进一步促进了马兰种植和加工业的发展。
1 材料与方法
1.1 材料与试剂
马兰由浙江省丽水市林业科学研究院马兰种质资源圃提供,并由该院刘跃钧院长做品种鉴定,10 个品种马兰的植物学特征如表1所示。

表1 10 个品种马兰的分类Table1 Botanical features of ten varieties of Kalimeris inddiiccaa
牛血清白蛋白(bovine serum albumin,BSA) 生工生物工程(上海)股份有限公司;MGO、GO 美国Sigma公司;其他均为分析纯 南京化学试剂有限公司。
1.2 仪器与设备
RE-52A旋转蒸发器 上海亚荣生化仪器厂;SHB-Ⅲ循环水式多用真空泵 郑州长城仪器厂;KDN-04型消化炉 上海新嘉电子有限公司;SX-5-12型箱式电阻炉、FM100高速万能粉碎机 天津泰斯特仪器有限公司;HH-6数显恒温水浴锅 常州国华电器有限公司;LD5-10低速离心机 北京医用离心机厂;V5100型可见分光光度计 上海元析仪器有限公司;Infinite 200Pro-多用酶标仪 奥地利帝肯公司。
1.3 方法
1.3.1 马兰粗提物的制备
马兰→干燥→粉碎→80%乙醇溶液提取(料液比1∶10(m/V),60 ℃水浴60 min,磁力搅拌)→1 800×g离心20 min→残渣以同样的方法重复提取2 次→减压浓缩制→冷冻干燥→冷藏备用
1.3.2 马兰粗提取物中多酚含量的测定
多酚含量采用Folin-Ciocalteus法测定,以没食子酸为对照品。参照李静等[24]的方法,用标准曲线法测定样品样品多酚的含量。所得标准曲线的回归方程为:y=0.014 07x+0.030 42(R2=0.997 3),式中:x为多酚含量/(mg/mL),y为吸光度。
1.3.3 马兰粗提取物中黄酮含量的测定
黄酮含量的测定采用亚硝酸钠-硝酸铝-氢氧化钠显色法测定,以芦丁为对照品。参照刘新明等[25]的方法,用标准曲线法测定样品黄酮含量。所得标准曲线回归方程为:y=0.011 59x-0.019 17(R2=0.999 2),式中:x为黄酮含量/(μg/mL),y为吸光度。
1.3.4 马兰粗提取物中皂苷含量的测定
皂苷含量的测定采用香草醛-浓硫酸显色法测定,以齐墩果酸为对照品。参照刘新明等[25]的方法,用标准曲线法测定样品中皂苷含量。所得回归方程为:y=0.036 81x+0.012 18(R2=0.999 5),式中:x为皂苷含量/(μg/mL),y为吸光度。
1.3.5 马兰粗提取物中β-胡萝卜素的测定
按照GB/T5009.83—2003《食品中胡萝卜素的测定》,以β-胡萝卜素含量为横坐标,吸光度为纵坐标绘制标准曲线,用标准曲线法测定样品中β-胡萝卜素的含量。所得回归方程为y=0.018 42x+0.034 66(R2=0.998 0),式中:x为皂苷含量/(μg/mL),y为吸光度。
1.3.6 10 个品种马兰粗提物抑制蛋白质非酶糖基化活性
1.3.6.1 蛋白质的糖化溶液体系
BSA质量浓度为30 mg/mL,GO、MGO浓度为20 mmol/L,M1~M10马兰提取液的质量浓度均为30 mg/mL,青霉素链霉素混合液体积分数为0.5%。将所有试剂和材料加入反应管后,密封管口,于37 ℃恒温培养箱中反应168 h。期间每24 h取样500 μL,冷冻结束反应,作为阳性组。以缓冲液代替M1~M10马兰提取液如上操作作为阴性对照。
1.3.6.2 马兰提取物对AGEs形成的抑制活性测定
将1.3.6.1节所得反应液稀释10 倍后利用酶标仪在λEx/λEm340 nm/465 nm测定荧光值。按照下式计算化含物对BSA糖基化反应的抑制作用,用抑制率表示。
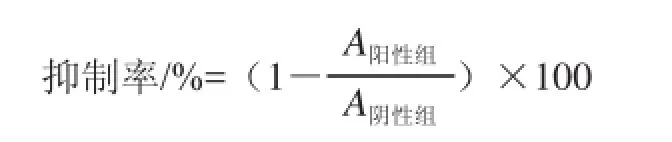
1.4 统计学分析
采用SPSS软件对数据进行统计学分析。测定结果以柱形图表示,显著性检验为t检验,显著性水平为P<0.05,极显著性水平P<0.01。
2 结果与分析
2.1 10 个品种马兰生物活性成分分析
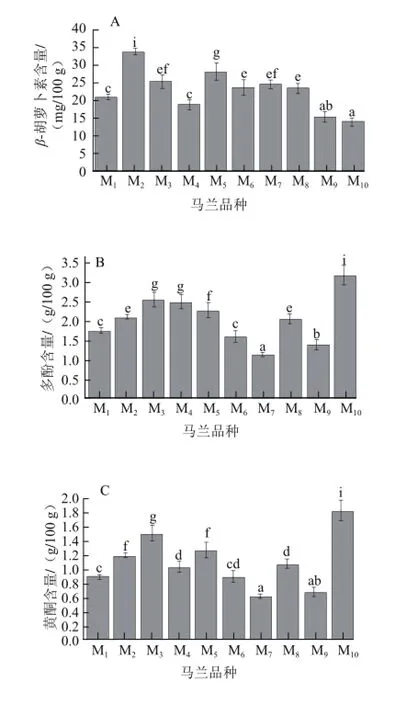

图1 10 种马兰活性成分含量Fig.1 Saponin contents of ten varieties of Kalimeris indica
由图1A可知,10 个品种马兰中β-胡萝卜素含量差异性显著。10 种马兰的β-胡萝卜素含量从高到低依次是M2、M5、M3、M7、M6、M8、M1、M4、M9、M10;其中,M2含量最高(33.88 mg/100 g),是含量最低(M10)的2.44 倍;M1、M3、M5、M6、M7、M8的β-胡萝卜素含量差异不大,均在21~28.5 mg/100 g之间。王福祥等[26]报道马兰嫩茎叶水分含量为86.4%,胡萝卜素含量为31.5 mg/100 g,与本实验测得的β-胡萝卜素含量结果较为一致。
由图1B可知,10 个品种马兰中多酚含量均较高,且具有显著性差异。其中,M10多酚含量显著高于其他品种,为3.15 g/100 g;M3多酚含量仅次于M10(2.54 g/100 g),显著高于除M10之外的马兰品种;其他马兰品种的多酚含量从高到低依次为M4、M5、M8、M2、M6、M1、M9、M7。
由图1C可知,10 个品种马兰中黄酮含量差异性显著。其中,M10黄酮含量显著高于其他品种,为1.84 g/100 g;M3黄酮含量仅次于M10(1.5 g/100 g),显著高于除M10之外的马兰品种;其他马兰品种的黄酮含量从高到低依次为M5、M2、M8、M4、M6、M1、M9、M7。国内外未见文献报道马兰中的黄酮,叶春等[27]测得新鲜芹菜叶、豌豆尖、青苋菜的黄酮含量较高,分别为3.65、3.00、2.55 mg/g,与这些蔬菜相比,马兰的黄酮含量略低。对比图1B和1C发现,不同品种黄酮含量与多酚含量的排序较为一致,多酚含量高的品种黄酮含量也高,这可能是由于多酚包括黄酮类,而其他诸如包括单宁类、酚酸类以及花色苷类等含量差异较小造成的。
由图1D可知,10 个品种马兰中皂苷含量差异性显著。其中,M4皂苷含量显著高于其他品种,为1.66 g/100 g;其他马兰品种的皂苷含量从高到低依次为M6、M2、M7、M9、M10、M8、M5、M3、M1。辛欣等[28]曾报道芦蒿中皂苷含量为0.192 g/100 g,相比较而言,马兰的皂苷含量较高。
综合以上营养指标,分析认为M4因蛋白含量、皂苷含量高,M10因多酚和黄酮含量高具有较高的营养价值。
2.2 10 种马兰提取液抑制蛋白质非酶糖基化活性的比较
2.2.1 10 种马兰提取液抑制BSA与GO的蛋白质非酶糖基化的活性

图2 BSA-GO模型中10 种马兰抑制AGEs产生的抑制率Fig.2 Inhibitory rates of AGEs formation by ten varieties of Kalimeris indica in the BSA-GO assay
由图2可知,10 种马兰对BSA与GO发生的蛋白质非酶糖基化反应的抑制作用各组间存在部分差异性显著,其中M1、M6、M9三者间,M2、M3两者间,M4、M8、M10三者间差异性不显著;其他品种间存在显著性差异,抑制作用从大到小排序为:M5、M3、M2、M8、M10、M4、M9、M6、M1、M7。M5、M7出现显著性差异可能是因为这两个品种马兰的各项营养指标均有显著性差异,各种活性成分含量不同,尤其是黄酮和多酚含量M5为最高,M7为最低,从而导致其抑制非酶糖基化的抑制率也具有显著性差异。M10、M8、M2、M3、M5的抑制率较高可能与这些品种的多酚和黄酮含量较高有关。相关研究表明,多酚类物质特别是黄酮类化合物对AGEs的形成具有较强的抑制作用,比如葛根、水飞蓟等均为潜在的天然AGEs抑制剂[25-26]。
2.2.2 10 种马兰提取液抑制BSA与MGO的蛋白质非酶糖基化的活性

图3 BSA-MGO模型中10 种马兰抑制AGEs产生的抑制率Fig.3 Inhibitory rates of AGEs formation by ten varieties of Kalimeris indica in the BSA-MGO assay
由图3可知,10 种马兰对BSA与MGO发生的蛋白质非酶糖基化反应的抑制作用有一定差异,10 种马兰的抑制作用从大到小排序为:M4、M2、M7、M5、M10、M6、M9、M8、M3、M1;其中M4、M2组间差异性不显著,且其抑制率显著大于其他品种,接近70%。而M3、M1组间差异性不显著,而其抑制率显著小于其他品种,其他品种M5~M10马兰的抑制率较为在60%左右,差异性不显著。出现显著性差异可能是各种活性成分含量不同,从而导致其抑制非酶糖基化的抑制率也具有显著性差异,其中,M2、M4的抑制效果较好可能与皂苷含量相对较高有关。
对比10 种马兰提取液抑制BSA与GO和MGO的蛋白质非酶糖基化的活性可以看出,马兰提取液抑制BSA与MGO的蛋白质非酶糖基化的活性整体上高于抑制BSA与GO的蛋白质非酶糖基化的活性。这可能与GO在水溶液中的存在形式有关,据报道GO在水溶液中以二聚体、三聚体和游离GO的形式共同存在,因此马兰提取液对GO的捕获需要等待GO二聚体、三聚体转换成游离GO,因此对GO引起的蛋白糖基化抑制率低于MGO引发的糖基化[27]。
2.3 10 种马兰粗提物抑制蛋白质非酶糖基化活性与各种活性物质含量关系的分析
2.3.1 马兰粗提物抑制蛋白质糖基化活性与β-胡萝卜素含量的关系
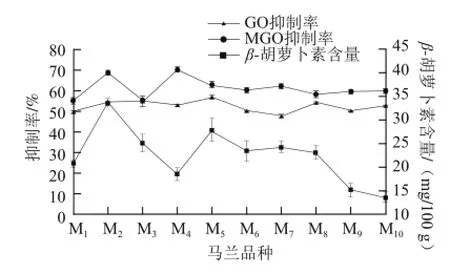
图4 马兰对蛋白质糖基化的抑制率和β-胡萝卜素含量的关系Fig.4 Inhibition of protein glycosylation as a function of β-carotene contents of Kalimeris indica
由图4可知,不同品种马兰对蛋白质糖基化的抑制作用与β-胡萝卜素含量没有相关性。
2.3.2 马兰粗提物抑制蛋白质糖基化活性与多酚含量的关系
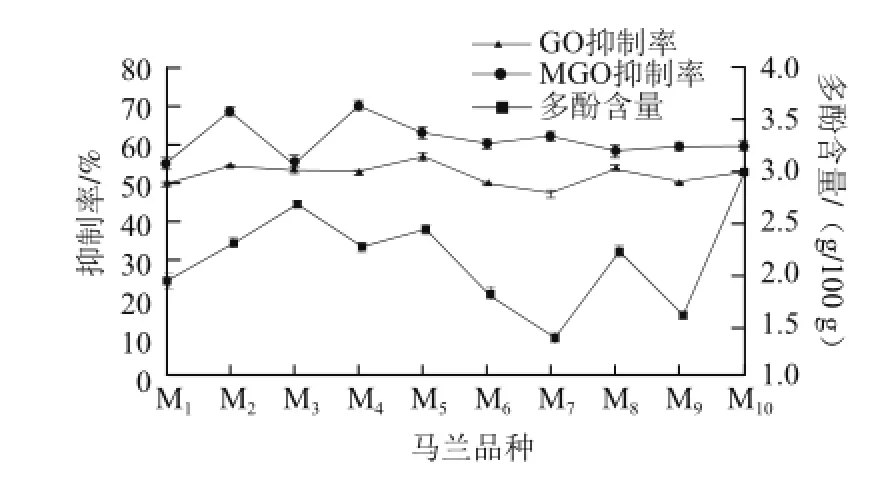
图5 马兰对蛋白质糖基化的抑制率和多酚含量的关系Fig.5 Inhibition of protein glycosylation as a function of polyphenol contents of Kalimeris indica
由图5可知,不同品种马兰粗提物对GO引起的蛋白质糖基化的抑制作用与多酚含量有一定的相关性,线性相关为y=6.434x+39.974(R2=0.824);M1~M9中蛋白抑制作用大的品种其多酚含量也高,反之,蛋白抑制作用小的多酚含量小;而M10表现异常,对GO引起的蛋白抑制作用属于中等水平,然而其多酚含量很高。不同品种马兰粗提物对MGO引起的蛋白质糖基化的抑制作用与多酚含量的相关性并不明显。
2.3.3 马兰提取液抑制蛋白质糖基化活性与黄酮含量的关系

图6 马兰对蛋白质糖基化的抑制率和黄酮含量的关系Fig.6 Inhibition of protein glycosylation as a function of flavonoid contents of Kalimeris indica
由图6可知,不同品种马兰对GO引起的蛋白质糖基化的抑制作用与黄酮含量有一定的相关性,而且趋势与图5相似,即马兰对蛋白质糖基化的抑制作用与多酚含量的关系和黄酮含量的关系相似,线性相关性为y=10.021x+41.943(R2=0.767);其中,M1~M9中蛋白抑制作用大的品种其黄酮含量也高,反之,蛋白抑制作用小的黄酮含量小;但是M10对GO引起的蛋白抑制作用属于中等水平,然而其黄酮含量很高。另外,不同品种马兰对MGO引起的蛋白质糖基化的抑制作用与黄酮含量的相关性并不明显。
2.3.4 马兰粗提物抑制蛋白质糖基化活性与皂苷含量的关系
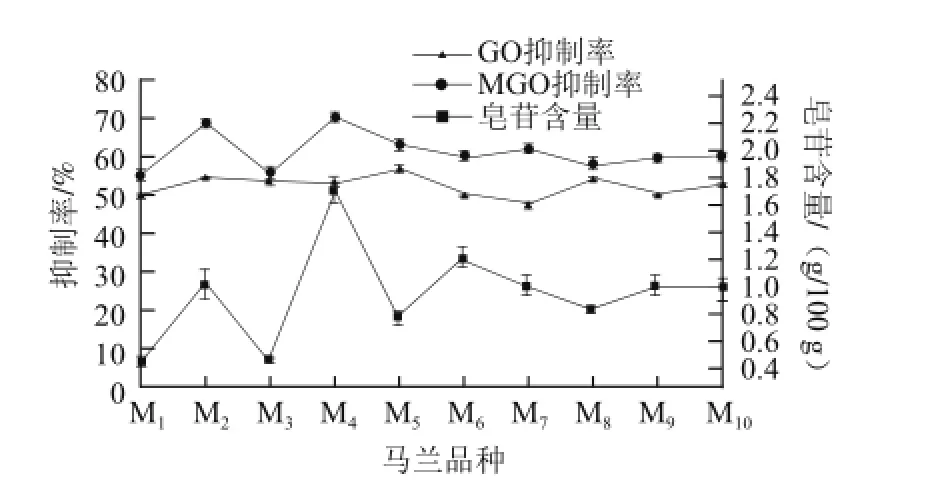
图7 马兰对蛋白质糖基化的抑制率和皂苷含量的关系Fig.7 Inhibition of protein glycosylation as a function of saponin contents of Kalimeris indica
由图7可知,M4马兰的抑制率最高,皂苷含量也是10 个品种中最高的;M5~M10的抑制率属于中等水平,皂苷含量也是10 个品种中的中等水平;M1和M3的抑制率最低,皂苷含量也是10 个品种中最低的;表明马兰对MGO引起的蛋白质糖基化的抑制作用与皂苷含量有一定相关性,线性关系为y=11.024x+50.185(R2=0.749)。而不同品种马兰粗提物对GO引起的蛋白质糖基化的抑制作用与皂苷含量的相关性并不明显。
3 结 论
综合以上研究结果,马兰是一种营养丰富的蔬菜,所测不同品种马兰的营养成分均具有显著差异,但属于种间正常差异。β-胡萝卜素含量和皂苷含量较为丰富,β-胡萝卜素能降低一些人类肿瘤的发病率,增强放疗和化疗对肿瘤的疗效,并能提高人群的免疫能力[28];皂苷具有抗炎、抗菌、抗病毒、抗肿瘤、降低血糖血脂的作用;另外马兰可显著抑制蛋白质非酶糖基化;因此马兰是一种具有较好的保健食品。
笔者还讨论了10 个品种马兰抑制蛋白质糖基化的抑制作用与各种活性物质含量的关系。结果表明,抑制作用与β-胡萝卜素没有相关性;对由GO引发的蛋白质非酶糖基化反应的抑制作用与多酚含量和黄酮含量具有一定的线性相关性;对由MGO引发的蛋白质非酶糖基化反应的抑制作用与皂苷含量具有一定的线性相关性。
总的来看,马兰是一种营养价值和药用价值都较高的蔬菜。目前对马兰的研究多集中于化合物的分离鉴定,对其药用价值的开发利用的研究相对较少,关于品种选育的研究几乎空白。本实验分析比较了10 个品种马兰的营养价值,筛选出马兰优良品种并且研究了马兰抑制蛋白质非酶糖基化的活性,虽然国内外文献均有关于β-胡萝卜素、多酚类物质、黄酮类物质和皂苷类物质抑制蛋白质非酶糖基化的活性的报道,但是均未深入这些物质抑制作用的化学本质原因。因此,马兰抑制蛋白质非酶糖基化的作用机制还有待进一步研究。
[1] 程丽君, 石雪平. 野菜马兰营养、药理作用及其加工利用研究进展[J].食品研究与开发, 2008, 29(4): 189-191.
[2] 雷雪仿, 彭珊珊. 马兰菜中的营养元素[J]. 广东微量元素科学, 1999, 10(6): 64-66.
[3] 林材, 曹佩雪, 黄光义. 马兰化学成分的研究[J]. 中国药学杂志, 2006, 41(4): 251-253.
[4] 林彬彬, 王刚, 刘劲松, 等. 马兰化学成分研究[J]. 安徽中医学院学报, 2008, 27(6): 48-49.
[5] 王刚, 王国凯, 刘劲松, 等. 马兰化学成分研究[J]. 中药材, 2010, 33(4): 551-554.
[6] 钟文武, 刘劲松, 张聪佴, 等. 马兰化学成分研究(Ⅱ)[J]. 广西植物, 2012, 32(2): 261-263.
[7] 刘劲松, 王刚, 王国凯, 等. 马兰三萜类成分研究[J]. 中成药, 2010, 32(3): 462-464.
[8] 龚小见, 周欣, 赵超, 等. 马兰中的三萜类成分[J]. 中国中药杂志, 2010, 35(3): 327-330.
[9] 龚小见, 王道平. 马兰茎和根的挥发性化学成分研究[J]. 中华中医药杂志, 2010, 25(12): 2112-2115.
[10] BAYNES J W, THORPE S R. Role of oxidative stress in diabetic complications: a new perspective on an old paradigm[J]. Diabetes, 1999, 48(1): 1-9.
[11] ONORATO J M,THORPE S R, BAYNES J W. Immunohistochemical and ELISA assays for biomarkers of oxidative stress in aging and disease[J]. Annals of the New York Academy of Sciences, 1998, 854: 277-290.
[12] THORNALLEY P J, BATTAH S, AHMED N, et al. Quantitative screening of advanced glycation endproducts in cellular and extracellular proteins by tandem mass spectrometry[J]. Biochemical Journal, 2003, 375(3): 581-592.
[13] THORNALLEY P J. Methylglyoxal, glyoxalases and the development of diabetic complications[J]. Amino Acids (Vienna), 1994, 6(1): 15-23.
[14] PHILLIPS S A, MIRRLEES D,THORNALLEY P J. Modifi cation of the glyoxalase system in streptozotocin-induced diabetic rats. effect of the aldose reductase inhibitor statil[J]. Biochemical Pharmacology, 1993, 46(5): 805-811.
[15] MCLELLAN A C, THORNALLEY P J, BENN J, et al. Glyoxalase system in clinical diabetes mellitus and correlation with diabetic complications[J]. Clinical Science (London), 1994, 87(1): 21-29.
[16] DICKERSON J E, Jr, LOU M F, GRACY R W. Ascorbic acid mediated alteration of alpha-crystallin secondary structure[J]. Current Eye Research, 1995, 14(2): 163-166.
[17] LO T W C, WESTWOOD M E, MCLELLAN A C, et al. Binding and modification of proteins by methylglyoxal under physiological conditions: a kinetic and mechanistic study with N-alphaacetylarginine, N-alpha-acetylcysteine, and N-alpha-acetyllysine, and bovine serum albumin[J]. Journal of Biological Chemistry, 1994, 269(51): 32299-32305.
[18] VANDER JAGT D L, ROBINSON B, TAYLOR K T, et al. Reduction of trioses by NADPH-dependent aldo-keto reductases. Aldose reductase, methylglyoxal, and diabetic complications[J]. The Journal of Biological Chemistry,1992, 267(7): 4364-4369.
[19] MOTTRAM D S, WEDZICHA B I, DODSON A T. Acrylamide is formed in the Maillard reaction[J]. Nature, 2002, 419: 448-449.
[20] 彭善丽, 张根义.茶多酚对蛋白质糖基化作用的影响[J]. 食品工业科技, 2011, 32(12):183-186.
[21] WANG Wei, YAVUZ Y, TIMOTHY J B, et al. Phytochemicals from berries and grapes inhibited the formation of advanced glycation end-products by scavenging reactive carbonyls[J]. Food Research International, 2011, 44(9): 2666-2673.
[22] WU C H, YEN G C. Inhibitory effect of naturally occurring fl avonoids on the formation of advanced glycation endproducts[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 3167-3173.
[23] 许惠琴, 朱荃, 李祥, 等. 7味中药对体外非酶糖化终产物生成的抑制作用[J]. 中草药, 2002, 33(2): 145-147.
[24] 李静, 聂继云, 李海飞, 等. Folin-酚法测定水果及其制品中总多酚含量的条件[J]. 果树学报, 2008, 25(1): 126-131.
[25] 刘新明, 潘道东, 吕丽爽. 大孔吸附树脂筛分马兰中活性组分及体外抗脂质过氧化测定[J]. 食品科学, 2011, 32(22): 89-94.
[26] 王福祥, 孙公江, 莫江玉. 马兰的营养成分利用和栽培技术要点[J].吉林蔬菜, 2006, 12(4): 38-39.
[27] 叶春. 聂开慧. 对40种新鲜蔬菜中总黄酮含量的测定[J]. 山地农业生物学报, 2000, 19(2): 121-124.
[28] 辛欣, 余宙, 范青生, 等. 藜蒿皂苷分离纯化及其体外抗氧化、抗菌活性研究[J]. 天然产物研究与开发, 2009, 21(2): 312-318.
Functional Components and Inhibitory Activity of Different Varieties of Kalimeris indica against Protein Glycosylation
ZHU Xiao-lin1, LIU Yue-jun2, LU Min1, LÜ Li-shuang1,*
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. Lishui Forestry Research Institute of Zhejiang Province, Lishui 323000, China)
Ten varieties of Kalimeris indica (M1through M10) were selected to determine their contents of β-carotene, polyphenols, flavonoids and saponins according to Chinese national standards and common methods. The inhibitory activity against non-enzymatic glycosylation and its relationship with active ingredients were analyzed as well. The results showed that Kalimeris indica was rich in the active ingredients; of the varieties investigated, M2and M5contained the highest amounts of β-carotene, M3and M10contained the highest amounts of polyphenols and flavonoids, M4and M6contained the highest amounts of saponins. Crude extracts from all these varieties were highly effective against protein glycosylation with inhibition rates between 49% and 71%. The inhibition of non-enzymatic glycosylation caused by either methylglyoxal (MGO) or glucose oxidase (GO) displayed positive linear correlation with the contents of polyphenol or flavonoid, while saponin contents were linearly correlated only with the inhibition of non-enzymatic glycosylation caused by MGO.
Kalimeris indica(L.)Sch-Bip; flavonoid content; protein glycosylation
TS201.4
A
1002-6630(2014)09-0090-06
10.7506/spkx1002-6630-201409019
2013-05-28
浙江省自然科学基金项目(LY12C15001);江苏省自然科学基金项目(BK2012850);江苏省教育厅自然科学基金项目(12KJB550005)
朱晓琳(1988—),女,硕士研究生,研究方向为功能性食品与食品营养。E-mail:zhuxiaolinrainbow@126.com
*通信作者:吕丽爽(1969—),女,副教授,博士,研究方向为功能性食品的分离及活性。E-mail: lishuanglv@126.com

