大孔吸附树脂对草鱼肽的脱盐作用
林利美,胡勤玲,王 申,吴永宁,2,宫智勇,*
(1.武汉工业学院食品科学与工程学院,湖北 武汉 430023;2.国家食品安全风险评估中心,北京 100021)
大孔吸附树脂对草鱼肽的脱盐作用
林利美1,胡勤玲1,王 申1,吴永宁1,2,宫智勇1,*
(1.武汉工业学院食品科学与工程学院,湖北 武汉 430023;2.国家食品安全风险评估中心,北京 100021)
目的:研究DA201-C大孔吸附树脂对草鱼肽的脱盐作用。方法:对脱盐前后草鱼肽的灰分、肽含量、分子质量及氨基酸组成进行分析,采用脱盐率、血管紧张素转化酶(angiotensin I-converting enzyme,ACE)抑制活性、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)自由基清除率和铁还原抗氧化能力(ferric reducing antioxidant potential,FRAP)为指标考察其脱盐效果。结果:草鱼肽的脱盐率为82.02%,脱盐处理后,肽片段和疏水氨基酸得到有效富集;ACE抑制活性显著增大,半抑制质量浓度(IC50)由0.36 mg/mL变为0.23 mg/mL;抗氧化性增强,其IC50由5.59 mg/mL变为4.48 mg/mL;总抗氧化值由1.018增大到1.261。结论:采用DA201-C大孔吸附树脂对草鱼肽脱盐是一种简便有效的处理方法。
大孔吸附树脂;草鱼肽;脱盐
草鱼活性肽是利用蛋白质水解草鱼肉蛋白得到的一类对生命活动有益的寡肽的统称,分子质量通常位于200~10 000 D之间[1]。草鱼肽易消化吸收,具有良好的热稳定性、溶解性等理化性质及降血压、降血脂、抗氧化等生理功能[2-3]。酶解法得到的多肽在安全、口味、营养价值上都要高于碱水解法得到的多肽[4-6],目前酶解法制取生物活性肽已成为研究的热点。
由于在酶解草鱼肉蛋白的过程中,需要不断的加入碱液以维持反应体系的pH值恒定,导致草鱼肽中残留了大量的无机盐,盐分的存在不仅不利于对草鱼肽的深入研究与分析,更影响了其风味和理化性质,因此需要进行脱盐处理[7]。目前对生物活性物质的脱盐方法主要有透析、超滤、纳滤等。但这些方法对小分子物质脱盐效果不佳或无法实现。尽管电渗析可以用于小分子物质脱盐,但回收率不高,能源消耗较大[8]。
大孔吸附树脂是由苯乙烯、二乙烯苯或甲基丙烯酸酯等聚合而成的一类新型的非离子型高分子吸附剂,其吸附作用主要是基于化合物的疏水基团与非极性吸附剂之间的范德华力和静电引力[9]。因其具有选择性好、吸附容量大、回收率高、再生处理简单,对脱盐原料理化性质影响较小等优点,越来越受到研究工作者的青睐。
本实验利用DA201-C大孔吸附树脂对草鱼肽进行脱盐处理,重点比较了处理前后草鱼肽的灰分含量、肽含量、分子质量、氨基酸组成,对血管紧张素转化酶的抑制活性以及抗氧化性的变化。
1 材料与方法
1.1 材料与试剂
草鱼活性肽(蛋白质含量79.26%、肽含量62.07%、水分含量5.69%、灰分含量19.91%) 实验室自制。
血管紧张素转化酶(angiotensin converting enzyme,ACE)、马尿酰-组氨酰-亮氨酸(N-Hippuryl-His-Leu hydratecas,HHL)、马尿酸(hippuric acid,HA)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH) 美国Sigma公司;大孔吸附树脂 江苏苏青水处理工程集团有限公司;乙腈(色谱纯) 中国医药集团总公司;其他试剂均为分析纯。
1.2 仪器与设备
1525-2998 高效液相色谱仪 美国Waters 公司;iMark 酶标仪 美国Bio-Rad公司;DDS-307型电导率仪上海市精密科学仪器有限公司;HD-3紫外分析仪 上海沪西分析仪器厂有限公司;7200可见分光光度计 尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 大孔吸附树脂对草鱼肽的脱盐[10]
用3.5 cm×50 cm的玻璃层析柱装满DA201-C大孔吸附树脂,室温下以10 mg/mL的质量浓度上样吸附,上样流速为1.5 BV/h,用紫外检测仪检测流出液的A220nm,以A220nm为0.05时作为透过点。平衡后用双蒸水洗涤层析柱,每10 mL一管收集洗脱液并测定其电导率,当电导率值与水一致时,用75%乙醇洗脱树脂,流速为3 BV/h。收集洗脱峰,旋转蒸发浓缩,冷冻干燥后得到脱盐草鱼肽。
1.3.2 肽成分分析
1.3.2.1 灰分含量的测定[11]
采用马弗炉灰化法,按照GB5009.4—2010《食品中灰分的测定》标准进行。

1.3.2.2 肽含量的测定[12]
按照大豆肽粉行业标准QB/T 2563—2004《大豆肽粉行业标准》进行。
1.3.2.3 分子质量的测定[13]
采用排阻色谱-多角度激光光散射-折光联用技术测定草鱼肽分子质量分布。取样品0.03 g,用0.9%的NaCl溶解,14 000 r/min离心5 min,取上清液20 øL进样。色谱柱:PL aquagel-OH 30(7.5 mm×300 mm);流动相:0.9% NaCl水溶液;流速:1 mL/min;检测器:Wyatt反射型示差折光检测器,波长:664 nm;Varian 335二极管阵列检测器,波长:230 nm;Wyatt 18角激光散射检测器,波长:664 nm;计算模式:Zimm 模式(激光转角)。
1.3.2.4 氨基酸组成分析[14]
将1 g样品置于水解管中,加入6 mol/L含1%苯酚的盐酸5 mL。真空充入氮气,火焰封口。105℃水解24 h,冷却后过滤,定容。采用高效液相色谱法测定其氨基酸组成。
1.3.3 ACE抑制活性的测定[15-17]
在一定条件下,HHL在体外与ACE反应可生成HA,HA在228 nm波长处有最大吸收,因此HA生成量的大小可反映ACE的活性。本研究利用反相高效液相色谱法检测草鱼肽对ACE的抑制活性。以0.05 mol/L的硼酸盐缓冲液(含0.3 mol/L NaCl,pH 8.3)为溶剂,配制浓度为2.5 mmol/L的HHL溶液,依次取30 μL HHL、10 μL草鱼肽,37℃恒温水浴5 min后加入ACE 20 μL,恒温反应1 h,然后加入HCl 70 μL终止反应,得到供试液。

色谱条件:色谱柱:O D S C18分析型色谱柱(4.6 mm×150 mm,5 μm);二极管阵列检测器,检测波长:228 nm;流速:0.8 mL/min;流动相A:水(含0.05%三氟乙酸) ;流动相 B:乙腈(含0.05%三氟乙酸);进样量:20 μL;柱温:25℃;梯度洗脱条件:10%~60% B(15 min);60%~10% B(3 min)。
1.3.4 DPPH自由基清除率的测定[18]
用双蒸水溶解样品并配制一系列梯度质量浓度,以无水乙醇溶解DPPH使其浓度为0.1 mmol/L,取草鱼肽和DPPH溶液各2 mL混合均匀,室温放置30 min后测其吸光度。按照式(3)计算清除率。

式中:Ai为DPPH+肽液的吸光度;Aj为肽液+无水乙醇的吸光度;A0为DPPH+无水乙醇的吸光度。
为突破实践教学困境,高校应当基于多元智能理论,提升师资水平,邀请行业专家参编教材,创新实训方式,优化考核与评价体系,健全校企合作机制。
1.3.5 总抗氧化活力的测定[19]
按照碧云天生物技术研究所生产的总抗氧化能力检测试剂盒进行检测。总抗氧化能力以铁还原抗氧化能力(ferric reducing antioxidant potential,FRAP)即单位样品的吸光度在标准曲线上相对应的FeSO4浓度的当量表示。FRAP值越大,抗氧化活性越强。
1.4 数据处理
数据采用SPSS17.0 统计分析软件进行处理。
2 结果与分析
2.1 草鱼肽成分分析

表1 脱盐对草鱼肽的灰分、肽含量和分子质量的影响Table 1 Effects of desalination on ash content, peptide content and molecular weight distribution of GCP
以灰分含量、分子质量分布和氨基酸组成为指标对草鱼肽脱盐前后的成分进行分析。由表1可知,经过DA201-C大孔吸附树脂脱盐处理后,草鱼肽的灰分含量<5%,脱盐率达82.02%,肽含量由62.07%增大到89.35%;分子质量分布较为集中,主要在400~900 D之间。对脱盐前后草鱼肽的氨基酸组成进行分析,结果见表2,经过脱盐处理,草鱼肽中的疏水氨基酸得到了有效的富集,由272.6 mg/g增大到338.2 mg/g,其中Pro、Tyr、Leu等氨基酸残基含量显著增大。

表2 脱盐对草鱼肽氨基酸组成的影响Table 2 Effect of desalination on amino acid compositions of GCPTable 2 Effect of desalination on amino acid compositions of GCP mg/g
2.2 草鱼肽对ACE的抑制活性
ACE在血压调节系统中可以把血管紧张素Ⅰ转化为收缩因子血管紧张素Ⅱ,引起血压升高,因此可以通过抑制其活性达到降低血压的目的[20]。表3列出了脱盐前后不同浓度草鱼肽对ACE活性的抑制率,回归分析得线性方程y=48.875x3-162.66x2+176.24x+5.722 7(R2=0.996 4)和y=48.596x3-153.44x2+159.07x+18.079(R2=0.997 7),归一化求解得到脱盐前后草鱼肽对ACE抑制活性的IC50分别为0.36、0.23 mg/mL。
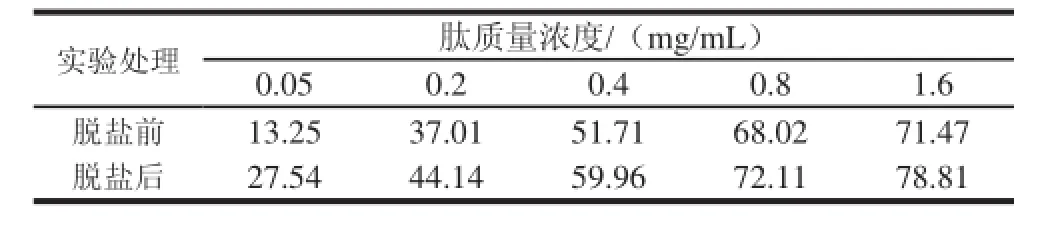
表3 脱盐对草鱼肽ACE抑制活性的影响Table 3 Effect of desalination on ACE inhibitory activity of GCP %
2.3 草鱼肽对DPPH自由基的清除作用
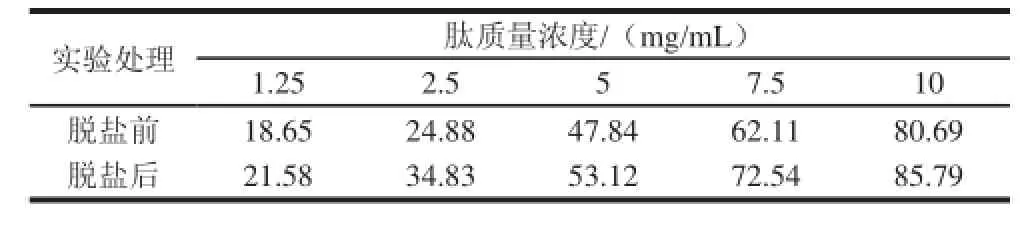
表4 脱盐对草鱼肽DPPH自由基清除率的影响Table 4 Effect of desalination on DPPH free radical scavenging Table 4 Effect of desalination on DPPH free radical scavenging capacity of GCP GCP %
由表4可知,随着草鱼肽质量浓度的增大,肽对DPPH自由基清除率逐渐增强,且同一质量浓度条件下,脱盐后肽的清除率均高于脱盐前。对数据回归分析得线性方程y = -0.002x3-0.025 7x2+7.689 6x+8.067 5(R2= 0.995 2)和y=-0.001 7x3-0.231x2+10.083x+9.890 1(R2=0.998 7),归一化求解得脱盐前后草鱼肽对DPPH自由基清除率的IC50分别为5.59、4.48 mg/mL。脱盐后,草鱼肽对DPPH自由基清除率显著增大。
2.4 草鱼肽的总抗氧化能力
FRAP法是基于单电子转移机理通过FRAP值来反应样品的总抗氧化能力。由图1可知,经过脱盐处理,草鱼肽的FRAP值由1.018增大到1.261,表明脱盐处理提高了其总抗氧化能力。
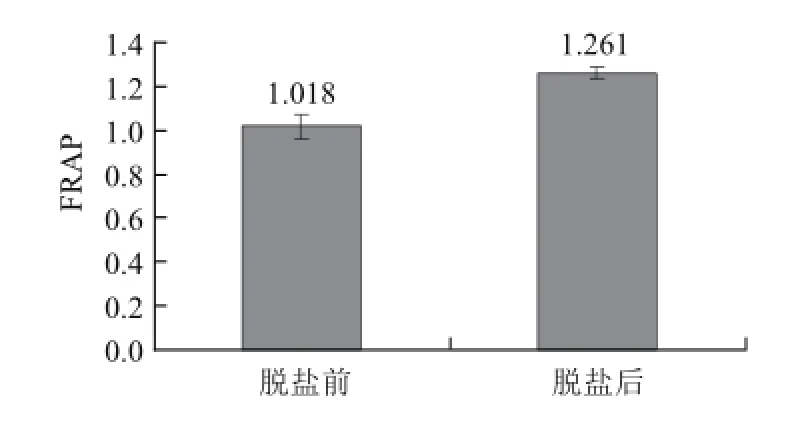
图1 脱盐对草鱼肽总抗氧化能力的影响Fig.1 Effect of desalination on FRAP values of GCP
经过脱盐处理,草鱼肽的抗氧化性明显提高,抗氧化性与肽片段的分子质量、氨基酸组成和结构有关。其分子质量通常在500~1 500 D之间[24],分子质量适中,其供氢基团才能充分暴露并与自由基反应,表现出强的抗氧化能力。疏水性支链氨基酸Val和Leu在N端时肽的抗氧化性增强[25]。Sarmadi等[26]研究表明,Tyr、Trp、Met、Lys、Cys和His是抗氧化肽的特征氨基酸。
3 结 论
大孔吸附树脂DA201-C对草鱼肽具有较好的脱盐效果,脱盐率达82.02%,且具有一定的纯化作用,小分子肽片段和疏水性氨基酸得到有效富集。经过脱盐处理,其ACE抑制活性显著增强,DPPH自由基清除率和总抗氧化性能力明显增大。利用DA201-C大孔吸附树脂对草鱼肽进行脱盐是一种简便有效的处理方法,具有潜在的工业应用前景。
[1] 王莹, 徐秀林, 朱乃硕. 生物活性肽降血糖功能的研究进展[J]. 食品科学, 2012, 33(9): 341-344.
[2] 陈季旺, 孙勤, 夏文水. 鱼降压肽的大孔吸附树脂脱盐及理化性质[J]. 食品科学, 2009, 30(24): 158-162.
[3] CHEN Jiwang, WANG Yimei, ZHONG Qixin, et al. Purification and characterization of a novel angiotensin-I converting enzyme (ACE) inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides, 2012, 33: 52-58.
[4] 史云丽. 酶法制备大米抗氧化活性肽的研究[D]. 长沙: 中南林业科技大学, 2009.
[5] 封梅, 覃楠, 兰岚, 等. 酶法水解鱼蛋白制备鱼降压肤的工艺研究[J].粮油加工, 2008(3): 126-128.
[6] 朱碧英, 毋瑾超, 胡锡钢. 酶解鳀鱼可溶性肽分子组成结构及营养评价[J]. 中国海洋药物, 2001, 20(4): 32-36.
[7] 陈季旺, 孙勤, 夏文水. 鱼降压肽的大孔吸附树脂分离及其活性稳定性[J]. 食品科学, 2009, 30(18): 25-28.
[8] TANG Zhigang, ZHOU Rongqi, DUAN Zhanting. Adsorption and desorption behaviour of taurine on macroporous adsorption resins[J]. Journal of Chemical Technology and Biotechnology, 2001, 76(7): 752-756.
[9] 范文, 阮长青, 王鹤霖. DA201-C 大孔吸附树脂对腐乳多肽脱盐作用的研究[J]. 中国粮油学报, 2011, 26(8): 105-108.
[10] DING Yan, YANG Xiaoming, PAN Guobo, et al. Adsorption and enrichment of alkalids from areca nut by means of macroporous resins[J]. Adsorption Science & Technology, 2012, 30(3): 193-204.
[11] 卫生部食品卫生监督检验所. GB 5009.4—2010食品中灰分的测定[S]. 北京: 中华人民共和国卫生部, 2010.
[12] 易维学, 陈岩, 蔡木易, 等. QB/T 2653—2004大豆肽粉[S]. 北京: 中华人民共和国国家发展和改革委员会, 2004.
[13] OLIVA A, LLABRÉ S M, FARIÑA J B. Comparative study of protein molecular weights by size-exclusion chromatography and laser-light scattering[J]. Journal of Pharmaceutical and Biomedical Analysis, 2001, 25(5): 833-841.
[14] ADEYEYE E I. Amino acid composition of three species of Nigerian fish: Clarias anguillaris, Oreochromis niloticus and Cynoglossus senegalensis[J]. Food Chemistry, 2009, 113: 43-46.
[15] CHEUNG H S, CUSHMAN D W. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochem Pharmacol, 1971, 20: 1637-1648.
[16] WU Jianping, DING Xiaolin. Characterization of inhibition and stability of soy protein derived angiotensin I-converting enzyme inhibitory peptides[J]. Food Research International, 2002, 35: 367-375.
[17] CHEN Jiwang, WANG Yimei, ZHONG Qixin, et al. Purification and characterization of a novel angiotensin-I converting enzyme (ACE) inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides, 2012, 33(1): 52-58.
[18] ESCUDERO E, ARISTOY M C, NISHIMURA H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311.
[19] DAY C A, KRAFT L J, KANG M, et al. Analysis of protein and lipid dynamics using confocal fluorescence recovery after photobleaching (FRAP)[J]. Current Protocols in Cytometry, 2012, 57(5): 2-19.
[20] 于志鹏, 赵文竹, 刘博群, 等. 血管紧张素转化酶抑制肽研究进展[J].食品科学, 2010, 31(11): 308-311.
[21] NATESH R, SCHWAGER S L U, STURROCK E D, et al. Crystal structure of the human angiotensin-converting enzyme-lisinopril complex[J]. Nature, 2003, 421: 551-554.
[22] LÓPEZ-FANDIÑO R, OTTE J, van CAMP J. Physiological, chemical and technological aspects of milk-protein-derived peptides with antihypertensive and ACE-inhibitory activity[J]. International Dairy Journal, 2006, 16(11): 1277-1293.
[23] RUIZ ˘ G, RAMOS M, RECIO I. Angiotensin converting enzymeinhibitory activity of peptides isolated from Manchego cheese. Stability under simulated gastrointestinal digestion[J]. International Dairy Journal, 2004, 14(12): 1075-1080.
[24] WANG Wenyi, MEJIA D, GONZALEZ E. A new frontier in soy bioactive peptides that may prevent age-related chronic diseases[J]. Comprehensive Reviews in Food Science and Food Safety, 2006, 4(4): 63-78.
[25] LI Xiuxia, HAN Lujia, CHEN Longjian. in vitro antioxidant activity of protein hydrolysates prepared from corn gluten meal[J]. Journal of the Science of Food and Agriculture, 2008, 88(9): 1660-1666.
[26] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956.
Desalination of Grass Carp Peptides with Macroporous Adsorption Resin
LIN Li-mei1, HU Qin-ling1, WANG Shen1, WU Yong-ning1,2, GONG Zhi-yong1,*
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. China National Center for Food Safety Risk Assessment, Beijing 100021, China)
Objective: To investigate the desalination of grass carp peptides (GCP) with macroporous adsorption resin DA201-C. Methods: Ash and peptide contents, molecular weight and amino acid composition of GCP were analyzed before and after desalination. Desalination efficiency, angiotensin I-converting enzyme (ACE) inhibitory activity, 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging activity and ferric reducing antioxidant potential (FRAP) were used to evaluate how well GCP was desalinated. The results showed that the desalination efficiency of GCP was 82.02%. The peptide fragments and hydrophobic amino acids were enriched in desalinated GCP. Meanwhile, the ACE inhibitory activity was significantly higher than that of native GCP, showing a decrease in IC50from 0.36 to 0.23 mg/mL, and the antioxidant activity was also increased showing an IC50of 4.48 mg/mL compared to 5.59 mg/mL for native GCP. The desalination resulted in an increase in the FRAP value of GCP from 1.018 to 1.261. Conclusion: The use of macroporous adsorption resin DA201-C provides a simple and effective method to desalinate GPC.
macroporous adsorption resin; grass carp peptides; desalination
TS254.9
A
1002-6630(2014)05-0033-04
10.7506/spkx1002-6630-201405007
2013-02-26
国家高技术研究发展计划(863计划)项目(2010AA023003);武汉工业学院校研究生创新基金资助项目(2011cx013)
林利美(1986—),女,硕士,研究方向为食品营养与安全。E-mail:llm2805810@163.com
*通信作者:宫智勇(1966—),男,教授,博士,研究方向为食品毒理学。E-mail:gongzycn@yahoo.com

