一种多孔型NaF吸附剂的制备及其对MoF6吸附的初步研究
李杨娟 程治强 张焕琦 张国欣 李洒洒 龙德武 吴国忠 李晴暖
1(中国科学院上海应用物理研究所 嘉定园区 上海 201800)
2(中国科学院核辐射与核能技术重点实验室 上海 201800)
3(上海大学 上海 201800)
一种多孔型NaF吸附剂的制备及其对MoF6吸附的初步研究
李杨娟1,2程治强1,2张焕琦1,2张国欣1,2李洒洒3龙德武1,2吴国忠1,2李晴暖1,2
1(中国科学院上海应用物理研究所 嘉定园区 上海 201800)
2(中国科学院核辐射与核能技术重点实验室 上海 201800)
3(上海大学 上海 201800)
发展了一种以高分子羧甲基纤维素钠(Carboxymethyl cellulose, CMC)、NaF和H2O为原料,通过成形和烧结等程序制取多孔型NaF吸附剂颗粒的新方法。分析和表征结果指出,吸附剂比表面积为0.3-0.4m2.g-1,孔隙率为40%-45%,颗粒强度为60-80N。室温下,吸附剂对MoF6的平衡吸附量约37.8 mg MoF6/1g NaF。能谱(Energy Dispersive Spectrometry, EDS)分析指出,MoF6能够通过NaF颗粒的孔隙扩散到吸附剂的内部。预计该吸附剂可以用于氟化挥发中UF6的进一步纯化研究。
NaF,吸附剂,多孔型,MoF6
随着人类对能源需求的不断增加和化石燃料资源的短缺,核能又一次受到世界各国的重视。但是,核能的广泛应用也带来诸如乏燃料的后处理和裂变材料再利用等迫切需要解决的问题。高温、无水状态下核燃料的干法后处理,由于其经济性、安全性和可靠性等优点[1-2],成为第四代反应堆高燃耗的乏燃料后处理最有竞争力的方法。熔盐反应堆是四代堆中唯一的液态反应堆,熔盐堆中核燃料以氟化物形式溶解在LiF和BeF2混合熔盐中。由此,对于熔盐堆,特别是钍基熔盐堆,干法后处理工艺几乎成为辐照过燃料处理唯一可选择的技术路线[3]。
U氟化挥发工艺是利用不同氟化物的挥发性差异,实现铀的快速、高效分离和纯化的干法后处理技术。它采用F2将U氟化为易挥发的UF6进入气相,与不易挥发的Th、Pa以及大多数稀土元素和碱土金属裂变产物分离。但是依然有部分裂变产物,例如Nb、Ru、Sb、Mo、Te等元素,由于它们的氟化物也具有较高挥发性,将伴随UF6一起进入气相。研究表明,杂质的去除可以利用挥发性氟化物在吸附剂上不同的吸附选择性,铀的回收可以通过吸附剂上的吸附—解吸过程或冷凝过程。使用得最多的吸附剂是NaF,美国橡树岭国家实验室(Oak Ridge National Laboratory, ORNL)利用NaF吸附剂通过改变吸附温度将挥发性较低的Nb和Ru的氟化物以及挥发性更高的Mo的氟化物与UF6分离[4]。近年来,俄罗斯为回收放射性同位素99Mo,研究采用NaF吸附剂吸附惰性气体中痕量的MoF6[5],日本等也在进行相关的研究[6]。吸附机制研究指出,吸附剂通过化学吸附形成UF6.NaF或UF6.2NaF配合物[7-8]。研究过的其他吸附剂还有MgF2、CaF2和LiF等[9]。
制备NaF吸附剂的基体材料有NaF和NaF.HF,成型过程大多采用基体材料和水混合后直接压制成颗粒状,然后再在一定温度下烧结[10-11],也有采用胶质化学合成法(Colloidal-Chemical Synthesis)进行NaF吸附剂制备的报道[5]。使用NaF.HF替代NaF是为了使最终的吸附剂具有更大的比表面积,从而增加对UF6的吸附容量[10],但是在制备过程中不得不面对有强腐蚀性的HF产生。本工作以NaF粉末为基体材料制备NaF吸附剂,为了达到使用NaF.HF制备吸附剂所相似的增加比表面积的效果,在制备过程中添加了具有粘结和造孔功能的高分子羧甲基纤维素钠(Carboxymethyl cellulose, CMC)。在经过大量的配比、烧结温度和升温程序等试验和优化基础上,成功研制出性能良好的多孔型NaF吸附剂,并用MoF6气体对其吸附进行了初步测试。采用MoF6是因为它不仅在挥发性上类似于UF6,而且它是一个高产额裂变产物,利用吸附剂实现Mo与U分离将是熔盐堆辐照过燃料后处理的一个重要研究内容。
1 试剂与仪器
羧甲基纤维素钠(CMC):粘度 300-800 mPa.s,国药集团化学试剂有限公司,试剂纯;NaF粉末:国药集团化学试剂有限公司,优级纯;5%氟氦混合气:北京华科微能特种气体有限公司;99.95% MoF6:阿法埃莎(天津)化学有限公司;氮气:99.999%;去离子水;自制挤出器(螺杆挤出,材质:316L);箱式气氛炉:上海久工电器有限公司;充气泵(EHEZM100,1.1L.min-1);电子天平:ML503,瑞士梅特勒-托利多;真空泵:英国Edward,抽速4L.s-1;绝压传感器(美国Setra,0-13.3kPa);手套箱:上海米开罗那机电技术有限公司非标定制。
相关分析仪器:压汞仪(Autopore IV 9505,美国麦克仪器公司);比表面积及孔径分析仪(V-sorb 2800TP,北京金埃谱科技有限公司);颗粒强度仪(KY-20,江苏姜堰市科苑电子仪器有限公司);X射线多晶衍射仪(XRD (X-ray diffraction),X' Pert Pro MPD,荷兰帕纳科公司);电感耦合等离子体原子发射光谱仪(Inductively Coupled Plasma-Atomic Emission Spectrometry, ICP-AES,optima 8000,美国PerkinElmer公司);电感耦合等离子体质谱仪(Inductively Coupled Plasma Mass Spectrometry, ICP-MS,NexION 300 D,美国PerkinElmer公司);扫描电子显微镜(Scanning Electron Microscope, SEM,LEO1530VP,ZEISS公司);能谱(Energy Dispersive Spectrometry, EDS,探头:牛津公司);离子色谱(ICS-2100,美国热电公司);氦检仪(HLT560,德国Pfeiffer Vacuum有限公司)。
2 实验方法
2.1 NaF吸附剂的制备和表征
按确定质量比(CMC:水:NaF=1:8:16)称取NaF和CMC粉末并均匀混合,加入相应量的去离子水,将混合物搅拌成一均匀稠状物,再将该稠状物放入自制挤出器中挤出成条状,切成底面ø4mm、长约10mm的圆柱形颗粒。将成型的吸附剂颗粒盛在石英表面皿上,然后放入箱式炉,在300min内将箱式炉加热到350°C,保温120 min;继续加热,在250min内将箱式炉从350°C加热到600°C,保温120 min,然后自然冷却。加热过程通入空气,以促进CMC的完全分解,达到NaF颗粒的造孔并固化目的。箱式炉冷却到室温后将吸附剂取出,转入干燥器中保存。在MoF6吸附试验前,在300°C条件下,用5% F2气体对NaF吸附剂进行处理,以去除吸附剂中CMC在高温烧结过程中产生的主要杂质Na2CO3。
采用比表面积及孔径分析仪对吸附剂比表面积进行测试,采用压汞仪对吸附剂孔隙率和平均孔径进行测试。参照中华人民共和国国家标准《GB 102012-88磷酸一铵、磷酸二铵颗粒平均抗压强度测定》,采用颗粒强度仪对吸附剂颗粒强度进行测试。堆积密度的测定根据对一定量吸附剂的质量和体积进行测量后计算得到。吸附剂中阳离子杂质含量通过ICP-MS和ICP-AES测定,阴离子杂质含量通过离子色谱测量。采用XRD对CMC烧结后的灰分进行分析。采用扫描电镜对吸附剂截面的微观形貌进行观察。
2.2 NaF吸附剂对MoF6的吸附实验
NaF颗粒对MoF6的吸附实验在图1所示的试验装置中进行,装置所用材料为不锈钢316L,氦检仪检测其泄漏率小于10-5Pa.L.s-1,实验前对实验装置采用F2进行钝化处理。试验时,取下吸附柱,在手套箱中称取10g左右的NaF吸附剂颗粒于吸附柱中。将吸附柱连入吸附装置,再次使用5%F2充入吸附装置至常压,室温下(约25°C)保持3h,以除去吸附柱与装置连接处的水分。采用真空泵将装置气压抽至小于6.66Pa后,充入MoF6气体约50kPa,保持静态吸附约60 h后,除去剩余MoF6,充入氮气至常压。

图1 NaF吸附剂吸附MoF6的实验装置示意图Fig.1 Sketch of laboratory equipment for NaF adsorbing of MoF6.
实验完成后,取下吸附柱,在手套箱中对实验后的吸附剂进行称量,确定MoF6的吸附量。扫描电镜和EDS线扫描分析用于观察和表征MoF6在吸附剂内部的扩散和分布。
3 结果与讨论
3.1 NaF吸附剂的制备和表征
烧结后的NaF颗粒呈白色圆柱形,直径和长度无明显变化。扫描电镜对吸附剂内部观察到的微观形貌如图2所示。观察到NaF为立方晶体,经高温烧结后晶体颗粒相互粘连但相互间有一定的孔隙,另有直径约微米级的孔洞均匀分布在吸附剂颗粒内部,这为气体氟化物在吸附剂内部的快速扩散提供了有利条件。采用压汞仪和比表面积及孔径分析仪,测得吸附剂的孔隙率为40%-45%,平均孔径为3-4μm,比表面积为0.3-0.4m2.g-1。经颗粒强度仪测得制备的NaF吸附剂颗粒碎裂压力为60-80N,堆积密度为0.78 g.cm-3。

图2 吸附剂颗粒截面的扫描电镜图 (a) ×100, (b) ×1 000Fig.2 Scanning electron micrograph of cross-sectional of NaF adsorbent particles. (a) ×100, (b) ×1 000
NaF吸附剂对铀的吸附净化作用主要依赖于NaF与挥发性氟化物的选择性吸附,因此,应尽量减少吸附剂中的杂质并避免杂质对吸附过程产生影响。经ICP-AES、ICP-MS、离子色谱等检测,得到氟化后吸附剂中的主要杂质有金属Fe、Ca、Cr、Ni,它们含量均低于3×10-5,阴离子杂质有SO42-、Cl-,含量低于5×10-5。NaF吸附剂中含量最高的杂质是5×10-4的Na2CO3,XRD测试证明,Na2CO3系CMC在600°C烧结后的灰分主要成分,折算到F2处理前的吸附剂中,其含量约为1%,该数据通过离子色谱对吸附剂中碳酸根离子的测定得到了进一步验证。采用F2在300°C高温下对吸附剂进行氟化处理,XRD物相分析(图3)表明,此举可将Na2CO3等无机钠盐杂质转化为NaF,大大减少吸附剂中的CO32-,离子色谱分析表明,吸附剂中Cl-、SO42-等杂质也有一定的去除效果。为考察残留的NaCO对NaF吸附MoF实验是否有影响,本工作在吸附实验前首先试验了MoF6与Na2CO3分别在常温和100°C下的反应,结果表明二者无明显的化学反应或吸附效应,因此,微量的Na2CO3存在不会影响下面的吸附实验结果。
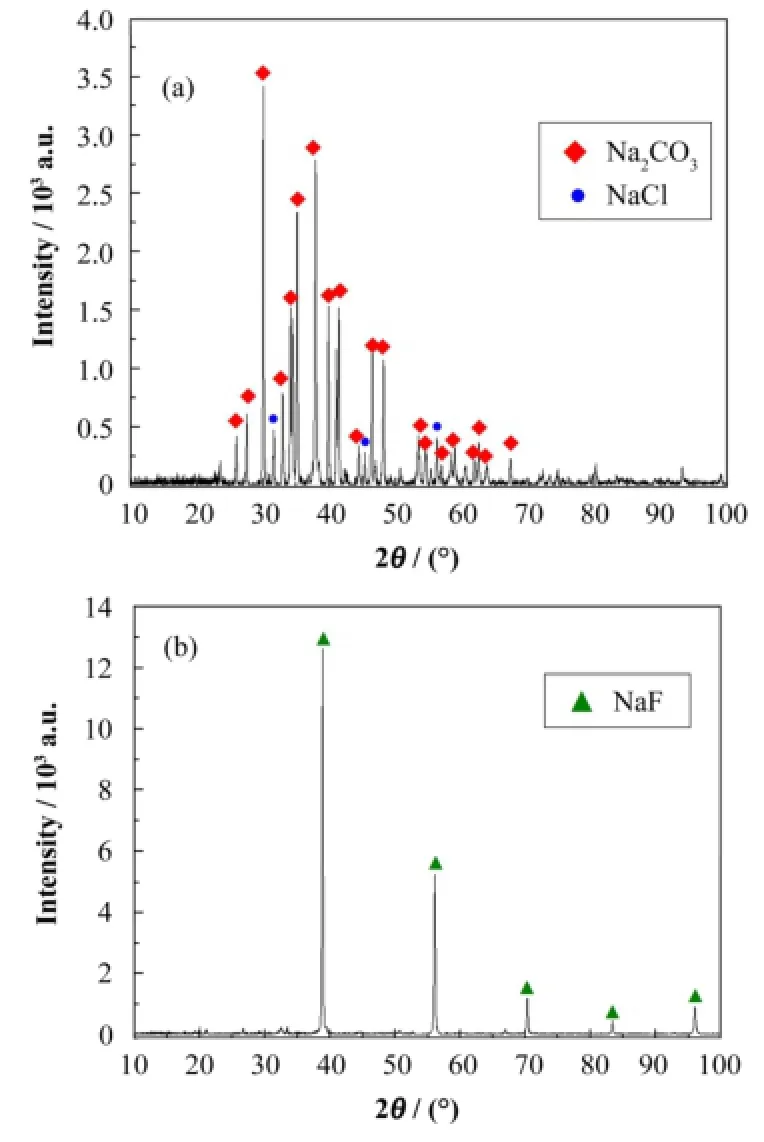
图3 CMC 600°C烧结后的灰分的XRD物相分析(a) 氟化前, (b) 氟化后Fig.3 XRD analysis of ash produced by sintering CMC at 600°C. (a) Before fluorination, (b) After fluorination
吸附剂的吸附容量是衡量吸附剂质量的重要指标之一。吸附容量除了与被吸附物的种类和浓度有关外,主要取决于吸附剂的比表面积。大的比表面积能够提供更多的吸附位点,因而获得更大的吸附容量。为了提高吸附剂比表面积,人们尝试了各种方法。ORNL将NaF和水混合后制成丸状,干燥后在250-350 °C下进行氟化处理,得到的NaF吸附剂颗粒的比表面积只有0.07m2.g-1,孔隙率为28%。如果将NaF.HF代替NaF,制成丸状后在200-400°C去除HF,再在400-700 °C下烧结成型,吸附剂的比表面积就增加到1m2.g-1,相应的孔隙率为45%[10]。类似地,中国原子能研究院赵家骏等[11]也用NaF.HF作为基体材料,在600°C烧结脱HF后得到比表面积为0.589m2.g-1的NaF吸附剂颗粒,并成功用于UF6与NpF6的分离研究。使用NaF.HF为基底材料虽然可使吸附剂比表面积有明显提高,但我们实验发现这样研制的吸附剂颗粒强度较低。更加不利的是用NaF.HF制备NaF吸附剂过程中放出HF,对人体和设备有较强的毒性和腐蚀性。
鉴于上述原因,本文提出了上述制备NaF吸附剂颗粒的新方法,该方法要点是在制备之初就在NaF基体粉末中添加CMC。CMC由C、H、O、Na组成,呈白色或乳白色纤维状粉末,由于它的环境友好性,已被广泛用于食品工业、医药工业和日用化学工业等各个领域中。CMC在NaF吸附剂研制中同时起着两种功能。作为粘结剂,CMC使得NaF和水的均匀稠状物能容易通过挤出切粒的方式方便获得均匀的圆柱形颗粒,这对于规模制备NaF吸附剂颗粒非常有用。更为重要的是,CMC在高温加热条件下可分解为CO2和H2O,这些气体的迅速逸出导致在吸附剂中产生孔隙,因此CMC同时起着造孔剂的作用。由于孔隙的产生,增加了吸附剂的有效表面积,因而在吸附过程中,MoF6吸附分子能够通过吸附剂的孔隙扩散到吸附剂的内部,从而增加吸附容量。经反复实验测试,得到烧结后吸附剂的比表面积为0.3-0.4m2.g-1。实验还指出,制得的NaF颗粒经F2处理后,吸附剂的比表面积有一定程度的提高。
还有一些方法可以提高NaF吸附剂的比表面积,例如ORNL报道,1m2.g-1的NaF吸附剂在25-50°C下用4:1 (HF:NaF)的HF处理,接着在250°C时除去HF,得到的NaF吸附剂比表面积提高到7m2.g-1[8]。应该指出,在使用吸附剂进行分离的化学工艺中比表面积并不是唯一考虑的因素,过大的比表面积可能带来吸附剂强度下降的弊病。本工作在用CMC制备NaF吸附剂时发现比表面积随着烧结温度的降低而增加,当烧结温度为450°C时,比表面积可以达到接近0.8m2.g-1。但是随着烧结温度的降低,吸附剂的强度也逐步降低(图4)。低的颗粒强度在实际应用过程中可能导致颗粒破碎,甚至粉化,其结果将会造成吸附柱堵塞,严重影响燃料U的纯化和回收。由此可见,吸附剂的制备必须根据应用的实际需求全面考虑它们的各个基本指标。本工作用CMC研制的多孔NaF吸附剂颗粒的基本表征参数与迄今在核燃料氟化挥发分离流程中见到的多数吸附剂性能大致相接近,预计可以用于氟化挥发中铀的分离和纯化目的研究,相关工作正在计划中。

图4 NaF吸附剂比表面积和颗粒强度随烧结温度变化关系Fig.4 Specific surface area of NaF adsorbent and its particle strength along with the change of sintering temperature.
3.2 NaF吸附剂对MoF6的吸附实验
本工作使用静态吸附方法测定MoF6气体在NaF吸附剂上的吸附容量。吸附实验中充入的MoF6气体初始压力约50kPa,此后由于MoF6在NaF吸附剂上的吸附,MoF6气体压力逐渐下降,60h后,MoF6气体压力降低到约16kPa,并保持恒定,吸附达到平衡。在手套箱中取出吸附剂并进行称量,发现吸附反应后吸附剂的质量从10.7521g增加到11.1581g,相当于本实验条件下NaF吸附剂对MoF6的吸附容量约37.8 mg MoF6/1g NaF。
为了验证CMC热分解在NaF颗粒内部形成的孔隙,将吸附了MoF6后的NaF吸附剂用能谱EDS进行分析,在吸附剂颗粒内部,沿着颗粒截面直径进行多次线扫描,结果在颗粒所有检测点均检测到Mo元素的存在,而且Mo和Na元素含量分布具有高度的相似性(见图5),佐证了MoF6确实沿吸附剂孔隙扩散到多孔型的NaF颗粒的内部。
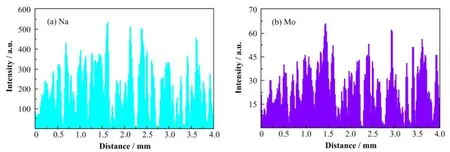
图5 吸附剂颗粒内部EDS线扫描图谱Fig.5 EDS line scan patterns inside sorbent particle.
4 结语
采用以CMC为粘结剂和造孔剂,将基体NaF粉末通过混合、挤出、切粒和高温烧结等一系列程序制得了一种多孔型的NaF吸附剂颗粒。该吸附剂比表面积为0.3-0.4m2.g-1,孔隙率为40%-45%,平均孔径为3-4μm,颗粒强度为60-80N,堆积密度为0.78 g.cm-3。该吸附剂杂质含量低,且残留的Na2CO3对MoF6的吸附无明显影响。室温条件下,吸附剂在平衡压力为16kPa时对MoF6吸附容量为37.8mg MoF6/1gNaF。能谱EDS分析表明,MoF6可扩散到吸附剂内部。与文献[10]报道的以NaF.HF作为基体材料制备吸附剂的技术路线相比,本工作提出的研制技术方法简便易行,不涉及有害、高腐蚀的HF气体。预计研制的NaF吸附剂可以用于氟化挥发中U的进一步纯化研究。
致谢感谢复旦大学侯惠奇老师在实验过程中提供的建议和指导。
1 刘学刚. 乏燃料干法后处理技术研究进展[J]. 核化学与放射化学, 2009, 31(增刊): 35-44
LIU Xuegang. Advances in the technology of processing of spent fuel dry[J]. Nuclear and Radiochemistry, 2009, 31(Suppl): 35-44
2 叶国安, 张虎. 核燃料后处理技术发展及其放射化学问题[J]. 化学进展,2011, 23(7): 1289-1294
YE Guoan, ZHANG Hu. Technology development and its radiochemical processing of nuclear fuel[J]. Chemical Processing, 2011, 23(7): 1289-1294
3 江绵恒, 徐洪杰, 戴志敏. 未来先进核裂变能—TMSR核能系统[J]. 中国科学院院刊, 2012, 03
JIANG Mianheng, XU Hongjie, DAI Zhimin. The future of advanced nuclear fission nuclear energy system-TMSR[J]. Chinese Proceedings of the National Academy of Sciences, 2012, 03
4 Culler F L, Bresee J C, Ferguson D E, et al. Chemical technology division annual progress report[R]. ORNL-3627,1964
5 Artyukhov A A, Kravets Y M, Seregin M B, et al. Transfer by metallic service lines and sorption extraction of MoF6from the gas flow[J]. Journal of Engineering Physics and Thermophysics, 2010, 83(2): 235-242
6 Kuniyoshi H, Daisuke W, Akira S, et al. Development of advanced reprocessing system "FLUOREX"[C]. Proceedings of GLOBAL, 2011
7 Katz S. Preparation of MoF6.NaF complexes with uranium, tungsten, and molybdenum hexafluorides[J]. Inorganic Chemistry, 1966, 5(4): 666-668
8 Katz S. Use of high-surface-area sodium fluoride to prepare MoF6.2NaF complexes with uranium, tungsten, and molybdenum hexafluorides[J]. Inorganic Chemistry, 1964, 3(11): 1598-1600
9 Stephenson M J, Merriman J R, Kaufma H L. Remove of impurities from uranium hexafluoride by selective sorption technology: progress report for 1966[R]. K-1713, 1966
10 Rosentha M W, Briggs R B, Kosten P R. Molten-salt reactor program semiannual progress report[R]. ORNL-4344, 1968
11 张家骏, 赵沪根, 段云富, 等. NaF颗粒吸附柱分离气体UF6、NpU6的工艺研究[J]. 原子能科学技术, 1985, 3: 311-315
ZHANG Jiajun, ZHAO Hugen, DUAN Yunfu, et al. Study on technique of separation of gas UF6, NpU6NaF particle adsorption column[J]. Atomic Energy Science and Technology, 1985, 3: 311-315
CLCTL99
A novel technique for preparation of the porous adsorbent NaF and a preliminary study on its adsorption capacity for MoF6
LI Yangjuan1,2CHENG Zhiqiang1,2ZHANG Huanqi1,2ZHANG Guoxin1,2LI Sasa3LONG Dewu1,2WU Guozhong1,2LI Qingnuan1,2
1(Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Jiading Campus, Shanghai 201800, China)
2(Key Laboratory of Nuclear Radiation and Nuclear Technology, Chinese Academy of Sciences, Shanghai 201800, China) 3(Shanghai University, Shanghai 201800, China)
Background:As a pyroprocess, the fluoride volatility process is developed to recover uranium from spent nuclear fuel. And the fluoride adsorption technology is usually applied as a mean for the purification and collection of UF6in the fluoride volatility process. Purpose: A novel technique for preparation of the adsorbent NaF used for the purification of uranium in the fluoride volatile process has been developed. Methods: In this work, the polymer sodium carboxymethyl cellulose (CMC), NaF and water were used as raw materials, and porous NaF adsorbent particles were made by molding and sintering process. The characteristics of the adsorbent particles were analyzed and characterized. Results: Specific surface area of the adsorbent was 0.3-0.4m2.g-1, porosity was 40%-45% and particle strength was 60-80N. At room temperature, the equilibrium adsorption capacity of MoF6was about 37.8 mg MoF6/1g NaF. The energy dispersive spectrometry (EDS) analytical result indicated that the MoF6was able to diffuse into the interior of the adsorbent particles through their pores. Conclusion: The NaF adsorbent developed in this study is expected to be used for further purification of uranium in fluoride volatile process.
NaF, Adsorbent, Porous, MoF6
TL99
10.11889/j.0253-3219.2014.hjs.37.080601
中国科学院战略性先导科技专项资助项目(No.XDA02030000)资助
李杨娟,女,1986年出生,2011年于厦门大学获硕士学位,主要从事铀氟化挥发产物的吸附净化研究
2014-04-11,
2014-05-09