SQA-V精子质量分析仪与计算机辅助精液分析系统在土家族男性精液检测中的应用
张明忠 秦 丽 赵 敏
湖北恩施土家族苗族自治州中心医院,湖北恩施 445000
随着社会的发展进步,男性生育障碍越来越受到重视[1]。 而精液检验已成为诊断男性不育症及评估男性不育症治疗效果的重要检查手段。目前临床用于精液检验的主要有传统手工分析方法、计算机辅助精液分析系统及SQA-V 精子质量分析系统三种, 但是传统手工分析方法常受检验者操作水平的影响,常导致检测结果差异较大,重复性差,缺少客观性,无法满足临床需要[2]。 而计算机辅助精液分析系统及SQA-V 精子质量分析系统有着操作方便、 检验结果准确的特点,目前临床应用较广。 本研究通过应用计算机辅助精液分析系统及SQA-V 精子质量分析系统对湖北恩施土家族苗族自治州中心医院(以下简称“我院”)收集的土家族男性精液进行分析,以对比两种检验系统的准确性及相关性。
1 资料与方法
1.1 一般资料
收集2009 年5 月~2013 年4 月于我院就诊行精液检查的土家族男性3000 例,年龄25~41 岁,平均(33.41±11.36)岁。 正常组2236 例,不育症组764 例。 不育症诊断标准为:婚后性生活正常,未采取任何避孕措施1 年以上配偶未怀孕者,且配偶生育能力正常者[3]。
1.2 标本采集
精液采集前受检者禁止性生活3~5 d, 在此期间应避免自慰或梦遗等情况, 保持正常饮食及作息,劳逸结合不可劳累过度,另外应戒除烟酒,忌服对生精功能有影响的药物等。 精液采集前排净尿液,应用手淫法采集精液,将一次性射精精液用清洁玻璃小瓶收集(禁用避孕套),标本保持于30~40℃之间,并于采集1 h 内送检。
1.3 诊断标准
正常精液判断标准[4-5]:①精液量2~5 mL;②精子密度≥20×106/mL; ③精子活力具有前向运动的精子(a 级+b 级) 百分比>50%或a 级精子百分比>25%;④pH 值7.2~8.0;⑤精子活率a 级(%)+b 级(%)+c 级(%)≥60%;⑥液化时间<60 min;⑦正常形态精子>70%或精子畸形率<30%。 当精液检测结果均符合上述标准时判断为正常,否则为异常精液。
1.4 检查方法
1.4.1 SQA-V 精子质量分析 于精液充分液化30 min后进行检测, 应用检测仪器选用以色列MES 公司的SQA-V 精子质量分析仪,操作方法严格按照《SQA-V型精子质量分析仪用户手册》进行操作[6]:将液化后的精液充分混匀, 使用SQA-V GOLD 专用一次性采样管吸取0.5 mL 标本加入自动检测孔进行分析。1.4.2 计算机辅助精液分析系统 用SQA-V 精子质量分析的同时,同时将标本于计算机辅助精液分析系统中进行检测,仪器选用WLY29000 型数码彩色精子质量检测系统进行检测,操作严格按照《全国临床检验操作规程》进行检测[7]:一次性吸管吸取10 μL 混合均匀精液样本至macro 计数板,盖上盖板后计数,计数视野≥5个。
1.5 观察方法
1.5.1 DMPPFI 六项参数分析 对正常组和不育症组两组患者分别应用SQA-V 精子质量分析及计算机辅助精液分析系统所得的DMPPFI 六项参数[精子密度(SD)、精子活率(SM)、前向运动精子率(PR)、前向运动精子数(PRC)、有效精子密度(FSC)和精子活力指数(SMI)]进行对比分析。
1.5.2 相关性分析 对所有患者应用SQA-V 精子质量分析及计算机辅助精液分析系统所得的DMPPFI 六项参数进行相关性分析。
1.6 统计学方法
统计学软件应用SPSS 19.0 软件, 所有数据均以均数±标准差(±s)形式表示,并应用独立样本t 检验; 相关性分析使用Bivariate 模型,r ≥0.70 为高度相关,0.40≤r <0.70 为中度相关性,r <0.40 为低度相关性,以P <0.05 为差异有统计学意义。
2 结果
2.1 DMPPFI 六项参数分析
正常组及不育症组SD、SM、PR、PRC、FSC 及SMI等DMPPFI 六项参数比较,差异均无统计学意义(P >0.05)。 见表1、2。
2.2 相关性分析
经相关性分析显示,应用SQA-V 精子质量分析及计算机辅助精液分析系统检测所得DMPPFI 六项参数间均存在显著的正向直线相关关系(P = 0.000)。见表3。
表1 正常组DMPPFI 六项参数分析(±s)
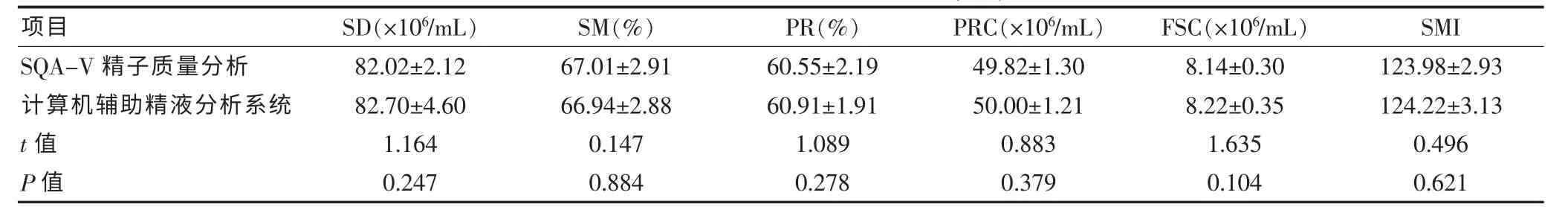
表1 正常组DMPPFI 六项参数分析(±s)
注:SD:精子密度;SM:精子活率;PR:前向运动精子率;PRC:前向运动精子数;FSC:有效精子密度;SMI:精子活力指数
?
表2 不育症组DMPPFI 六项参数分析(±s)

表2 不育症组DMPPFI 六项参数分析(±s)
注:SD:精子密度;SM:精子活率;PR:前向运动精子率;PRC:前向运动精子数;FSC:有效精子密度;SMI:精子活力指数
项目 SD(×106/mL) SM(%) PR(%) PRC(×106/mL) FSC(×106/mL) SMI SQA-V 精子质量分析计算机辅助精液分析系统t 值P 值35.35±1.81 35.27±1.91 0.250 0.803 41.24±5.48 41.30±1.99 0.083 0.934 37.92±1.92 38.23±1.96 0.984 0.327 15.15±1.13 15.33±1.21 0.950 0.344 4.43±0.86 4.69±0.83 1.893 0.060 41.66±4.37 42.70±4.36 1.455 0.148
表3 相关性分析(±s)

表3 相关性分析(±s)
注:SD:精子密度;SM:精子活率;PR:前向运动精子率;PRC:前向运动精子数;FSC:有效精子密度;SMI:精子活力指数
项目 SD(×106/mL) SM(%) PR(%) PRC(×106/mL) FSC(×106/mL) SMI SQA-V 精子质量分析计算机辅助精液分析系统r 值P 值58.68±23.50 58.99±24.05 0.984 0.000 54.12±13.64 54.11±13.09 0.930 0.000 49.23±11.54 49.57±11.54 0.971 0.000 32.48±17.43 32.66±17.44 0.995 0.000 6.28±1.97 6.45±1.88 0.902 0.000 82.82±41.46 83.46±41.07 0.990 0.000
3 讨论
精液检查的准确性是临床诊断及治疗的基础,因此其在临床工作中意义重大。 计算机辅助精液分析系统相对于传统的手工分析方法在检查中增加了严格的量化指标, 显著降低了手工检测的主观性[8],其是在显微镜检查的基础上, 利用计算机辅助图形分析技术对各项精液指标进行检测[9],大大提高了检测的准确性, 但是也存在着对精子形态和活力的辨别能力较低的缺点[10]。 而SQA-V 精子质量分析是运用精子运动所引起的光密度来进行测定, 同样有着较好的准确性, 且可弥补计算机辅助精液分析系统对精子形态和活力的辨别能力较低的缺点[11-13]。 本研究通过应用计算机辅助精液分析系统及SQA-V 精子质量分析两种检测方法对土家族无不育症男性及不育症男性精子进行检测, 以比较两种检测方法的准确性, 结果显示: 正常组及不育症组应用SQA-V精子质量分析及计算机辅助精液分析系统检测所得的DMPPFI 六项参数比较均未见显著差异。 同时,应用SQA-V 精子质量分析及计算机辅助精液分析系统检测所得DMPPFI 六项参数间均存在显著的正向直线相关关系, 可见两种检测方法均可应用于土家族男子的精液检测。
本研究在比较两种检测方法中选取了DMPPFI六项参数作为检测指标,DMPPFI 六项参数主要包括SD、SM、PR、PRC、FSC 和SMI 六项。 其中SD 是精子数量的客观体现,虽然足够的精子数量对于受孕有着重要的作用,但是单纯应用精子密度尚不能作为评估男性的生育能力唯一指标。 SM 将精子分前向运动和非前向运动的不动精子两大类, 其中因非前向运动的不动精子,可导致无法受孕,而前向运动的精子为受孕的有效精子, 故本指标同样也是评价男性生育能力的重要指标。PR 和PRC 均是评价前向运动精子的主要指标, 也是评价男性生育功能的主要指标之一,当前向运动精子数量及功能正常时,精子可有效地穿过女性宫颈、子宫等部位,完成受孕,因此也是评价男性不育症的一个最好的指标之一。 而FSC 及SMI 均是综合SD、SM、PR、PRC 四项指标而得出的评价男性生育能力的重要指标,FSC 及SMI 降低,则可表示存在生育功能障碍。 临床研究显示受精的失败与精液质量或精子功能低下有关[14-15],综合以上六项检测指标,可有效体现男性的生育能力。 因此本研究选取DMPPFI 六项参数作为检测指标。虽然本研究所得出的结果未对比出SQA-V 精子质量分析与计算机辅助精液分析系统在DMPPFI 六项参数分析中的差异, 但是已有研究显示相对于计算机辅助精液分析系统,SQA-V 精子质量分析在进行精液检测中有着高精密度和高效率的特点, 且其所能检验出的精子参数较计算机辅助精液分析系统更丰富, 除本研究所观察的DMPPFI 六项参数外,其还可对精子质量进行更全面的检测, 对临床诊断及评估治疗效果意义更为重大。
综上所述,在临床工作中,对于土家族男性精子的检测中,SQA-V 精子质量分析及计算机辅助精液分析系统比较未见明显差异,同时两种检测方式存在直线相关性,临床工作中均可应用。
[1] 余文辉.无精子症男性激素水平变化及睾丸病理分析[J].国际检验医学杂志,2009,30(3):264-265.
[2] Komiya A,Watanabe A,Kawauchi Y,et al. Analysis of inter-examination differences in sperm nuclear vacuoles among male patients with infertility[J].Syst Biol Reprod Med,2014,60(1):35-42.
[3] 世界卫生组织.世界卫生组织人类精液及精子-宫颈黏液相互作用实验检验手册[M].4 版.北京:人民卫生出版社,2001:4-20.
[4] 叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:319.
[5] Degl'Innocenti S,Filimberti E,Magini A,et al. Semen cryopreservation for men banking for oligospermia,cancers,and other pathologies:prediction of post-thaw outcome using basal semen quality [J]. Fertil Steril,2013,100(6):1555-1563.
[6] 戈一峰,汪春晖,邵永,等.两种精子分析系统的比较研究[J].中华男科学杂志,2008,14(10):923-926.
[7] 安茂伟,韩秀娟,王世礼,等.计算机辅助精子质量分析与常规精液分析的对比性研究[J].现代诊断与治疗,2008,19(1):7-9.
[8] Kathiravan P,Kalatharan J,Karthikeya G,et al.Objectivesperm motion analysis to assess dairy bull fertility using computer-aided system-a review [J]. Reprod Domest Anim,2011,46(1):165-172.
[9] 郭海彬,殷宝莉,张翠莲,等.精子质量与短时间受精后受精结局关系的研究[J].中华检验医学杂志,2012,35(2):150-155.
[10] 黄开权,张淑芳,沈熔.ZKPACS 多功能显微图像分析系统在精液分析中应用与评价[J].安徽医学,2010,31(3):270-272.
[11] Ge YF,Wang CH,Shao Y,et al. Comparison of the parameters obtained by sperm quality analyzer V and computer-aided spermanalysis system [J]. Zhonghua Nan Ke Xue,2008,14(10):923-926.
[12] Maree L,van der Horst G. Quantification and identification of sperm subpopulations using computer-aided sperm analysis and species-specific cut-off values for swimming speed [J]. Biotech Histochem,2013,88(3-4):181-193.
[13] 刘安娜,张玲,王厚照.SQA-V 全自动精子质量分析仪与计算机辅助精液分析系统结果比较[J].职业与健康,2009,25(20):2161-2162.
[14] 阮杰,黄华振,刘新光.蛋白激酶CK2 活性与人精子质量相关性的初步探讨[J].国际检验医学杂志,2007,28(4):289-291.
[15] Hoogewijs M,De Vliegher S,De Schauwer C,et al.Validation and usefulness of the Sperm Quality Analyzer V equine for equine semen analysis[J].Theriogenology,2011,75(1):189-194.
