高效液相色谱串联四极杆质谱法同时测定豆芽中7 种药物残留
胡祥娜,顾亚萍,*,林慧纯,王 瑞,方长发
(1.深圳市农产品质量安全检验检测中心,广东 深圳 518040;2.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055)
高效液相色谱串联四极杆质谱法同时测定豆芽中7 种药物残留
胡祥娜1,顾亚萍1,*,林慧纯1,王 瑞1,方长发2
(1.深圳市农产品质量安全检验检测中心,广东 深圳 518040;2.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055)
为加强对豆芽类产品的监管,研究豆芽中7 种药物(6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-D、赤霉素、多菌灵、腐霉利和恩诺沙星)同时检测的方法。该方法使用乙腈对豆芽中7 种药物进行同时提取,使用高效液相串联四极杆质谱仪对上述7 种药物进行检测。7 种药物在0.01~10 μg/mL(多菌灵和恩诺沙星在0.01~1 μg/mL)内线性良好(R2≥0.987)。两种豆芽中7 种药物的3 个添加量(分别为0.002、0.2、0.5 mg/kg)回收实验结果表明:7 种药物的回收率为60.31%~108.51%,相对标准偏差为1.03%~13.10%,方法检出限为0.010 5~0.125 μg/kg。
高效液相色谱串联四极杆质谱仪;豆芽;6-苄基腺嘌呤;4-氯苯氧乙酸;2,4-D;赤霉素;多菌灵;腐霉利;恩诺沙星
豆芽类蔬菜为广大市民经常食用的一类价廉物美的食品,其营养丰富,富含蛋白质、B族维生素和微量元素,且易于被人体消化吸收。但近年来,市场上多次报道毒豆芽、问题豆芽等事件[1-3]。据调查,部分豆芽生产中确实存在滥用药物的情况,使用药物有6-苄基腺嘌呤、4-氯苯氧乙酸钠[4]、2,4-D和赤霉素等植物激素[5-7],多菌灵、腐霉利等杀菌剂农药和兽药恩诺沙星[8]等。我国对豆芽中相关药物的使用有明确的规定,其中6-苄基腺嘌呤、4-氯苯氧乙酸钠[4]、2,4-D和赤霉素在豆芽生产中使用都属于违规行为。恩诺沙星为动物专用药,也不能将其应用于豆芽的生产中。
目前,豆芽中药物残留的检测方法多为单个化合物一个标准,如6-苄基腺嘌呤、4-氯苯氧乙酸钠和2,4-D[9-11]。而赤霉素、恩诺沙星的检测还处于研究阶段[7],尚未有标准涵盖。豆芽中药物的相关检测的研究,前处理方法繁琐[4],不能满足快速检测的要求;实验多采用高效液相紫外检测器,导致结果容易受样品中基质的干扰,影响结果的精确度;方法单一,最多只能同时检测4 种药物[7,12-13]。高效液相色谱串联四极杆质谱技术在农药残留[14]、人工合成甜味剂[15]、工业染料[16]及中草药植物成分的测定中已经有研究报道,且均有较稳定的回收率及较高的精密度,而使用高效液相串联四极杆质谱对上述7 种化合物的检测研究比较少[6,8,17-19]。
本实验使用乙腈对6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-D和赤霉素、多菌灵、腐霉利和恩诺沙星进行同时提取,前处理方法简单快速。使用高效液相串联四极杆质谱仪进行检测,能最大程度地利用高效液相色谱串联四极杆质谱对于基质的抗干扰能力,且方法回收稳定,精密度好,更加符合在现有国情下各级监测部门对豆芽产品进行快速监控的需要。
1 材料与方法
1.1 材料与试剂
实验豆芽样品由作者所购绿豆和黄豆经发芽自制而成。
6-苄基腺嘌呤、恩诺沙星、赤霉素、4-对氯苯氧乙酸和2,4-D标准物质 美国Sigma公司;多菌灵和腐霉利 农业部环境质量监督检验测试中心(天津);甲醇、乙腈(均为色谱纯) 德国默克公司;氯化钠(分析纯) 西陇化工股份有限公司;无水硫酸镁、甲酸和乙酸铵(均为优级纯) 上海安谱科学仪器有限公司;实验用水为自制超纯水。
样品提取液上机前经0.2 2 μ m的聚四氟乙烯(polytetrafluoroethylene,PTFE)滤膜过滤至2 mL HP小瓶中。
1.2 仪器与设备
XEVO TQ-S高效液相色谱串联四极杆质谱联用仪(软件为Masslynx) 美国Waters公司;N-EVAP 112氮吹仪 美国Organomation Associates公司;Elix5纯水机美国Millipore公司;T25匀浆机 德国IKA公司;XH-B旋涡混合器 江苏省姜堰市康健医疗器具有限公司;TG16G台式高速离心机 湖南凯达科学仪器有限公司;AS30600BDT超声波清洗器 天津奥特赛恩斯仪器有限公司;滤膜和HP小瓶 安捷伦科技有限公司。
1.3 方法
1.3.1 溶液的配制
标准储备液:分别准确称取适量的上述固体标准品(6-苄基腺嘌呤、恩诺沙星、赤霉素、4-对氯苯氧乙酸和2,4-D)用甲醇溶解稀释配制成质量浓度为1 000 μg/mL的标准储备液,于-20 ℃条件下保存备用。多菌灵的标准储备液质量浓度为500 μg/mL,储存于室温备用;腐霉利标准储备液质量浓度为1 000 μg/mL,储存于-18 ℃条件下备用。分别准确吸取一定量的上述7 种标准储备液,混合,用甲醇稀释成的混合标准溶液,于-18 ℃条件下保存备用,准确吸取一定量的混合标准溶液,用甲醇和水(体积比为1∶1)溶液稀释到0.01、0.02、0.05、0.1、0.2、0.5、1 μg/mL和10 μg/mL,作为标准工作溶液。
0.2%甲酸溶液:准确移取1 mL甲酸,加水稀释到500 mL,经超声波清洗器脱气5 min用于仪器流动相用。
1.3.2 样品前处理
准确称取经组织捣碎机粉碎的样品(4±0.05)g,加入12 mL乙腈12 000 r/min匀浆3 min。再加入氯化钠3 g,匀浆3 min,置于高速离心机中在4 000 r/min离心5 min。静置15 min后,移出上清液3 mL置于氮吹仪上50 ℃条件下吹干后,加入甲醇和水(体积比为1∶1)定容至1 mL,经0.22 μm的PTFE滤膜过滤至HP小瓶中待上机。
1.3.3 仪器分析条件
1.3.3.1 高效液相色谱条件
Acquity UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相:0.2%甲酸溶液-甲醇。流速0.5 mL/min;进样量1 μL;柱温40 ℃;流动相梯度如表1所示。

表1 流动相梯度表Table1 Gradient elution program
1.3.3.2 质谱条件
电喷雾电离(electrospray ionization,ESI):ESI+/ ESI-电离模式;毛细管电压3 kV;干燥气温度450 ℃;干燥气流速900 L/h;锥孔气流速150 L/h;雾化压力0.7 MPa;碰撞气流速0.15 mL/min。
豆芽中7 种添加物的信息如表2所示,其质谱检测参数详见表3。
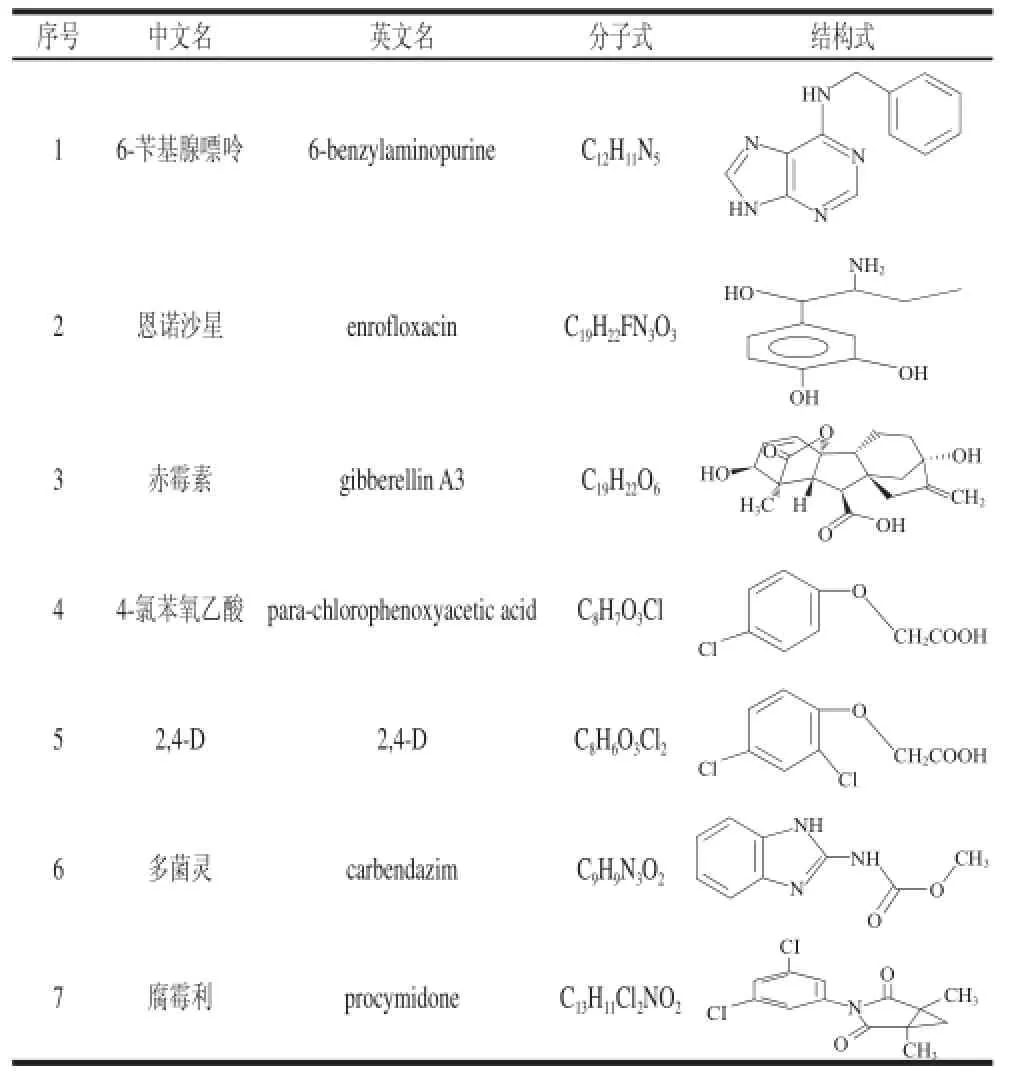
表2 豆芽中7 种添加物信息Table2 Information about seven additives in bean sprouts

表3 豆芽中7 种添加物的质谱检测参数Table3 MS parameters for seven additives in bean sprouts
2 结果与分析
2.1 质谱条件的选择
2.1.1 母离子的选择
取0.5 μg/mL的各化合物标准溶液,依次吸入注射器中,放在蠕动泵进样器上,设置蠕动泵以20 μL/min的速度进样,对质谱条件进行优化,尽可能得使待测物响应信号达到最高。同时调节质谱参数(尤其是毛细管电压、锥孔电压、干燥气温度、干燥气流速、锥孔气流速和中性气体流速),使在该模式下选择的离子响应值达到最大。
2.1.2 子离子的选择
使用仪器自带软件Intellistart功能对挑选出来的母离子进行碎裂条件的优化,为每个母离子自动挑选出2 个子离子并得到最佳碎裂参数(即锥孔电压、碎裂电压)。
2.1.3 子离子的再选择
对上述得到的子离子结合化合物的结构式和碎裂规律进行再次分析,以验证仪器自动挑选子离子功能的准确性。终上所述,将7 种化合物的母离子和子离子相关信息汇总如表4所示。

表4 豆芽中7 种添加物质谱检测条件中母离子、子离子结构信息Table4 Structural information of parent ion and daughter ion for seven additives in bean sprouts
2.2 色谱条件的选择
比较水、0.2%甲酸溶液和盐溶液(5 mmol/L乙酸胺和0.05%甲酸)作为流动相时对于7 种化合物的色谱分离的影响。
当使用水-甲醇作为流动相体系时,恩诺沙星的两个离子响应明显降低,这可能是因为,后两种流动相体系中都有一定浓度的酸存在,更加容易诱导恩诺沙星在ESI源中产生[M+H]+。当使用盐溶液-甲醇作为流动相体系时,会容易引起多菌灵和恩诺沙星、4-氯苯氧乙酸和6-苄基腺嘌呤的分离度降低,且个别峰的峰形拖尾,导致化合物之间的干扰严重、灵敏度降低。因此综合考虑,使用甲酸溶液-甲醇作为流动相体系,用于这7 种化合物的分离。
2.3 线性范围、标准曲线、检出限
以0.01、0.02、0.05、0.1、0.2、0.5、1 μg/mL和10 μg/mL的各类化合物标样色谱峰面积Y对其质量浓度作图,得线性回归方程、相关系数和线性范围如表5所示。
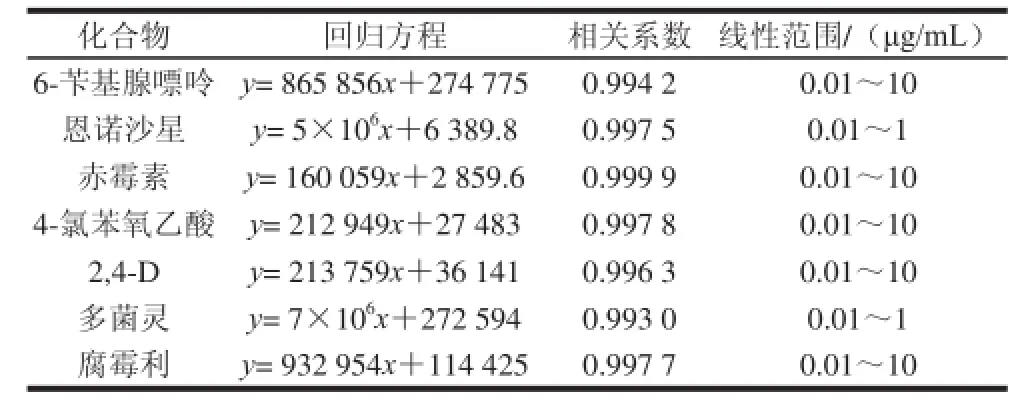
表5 豆芽中7 种添加物的回归方相关系数和线性范围Table5 Regression equations with correlation coefficients and linear ranges
在上述分析条件下,以1.0 μL进样,对上机最小质量浓度0.01 μg/mL各类化合物进行积分,在各峰附近选择比较平稳的0.2 min左右的检出作为基线进行信噪比计算,可得到0.01 μg/mL质量浓度条件下,6-苄基腺嘌呤、恩诺杀星、赤霉素、4-氯苯氧乙酸、2,4-D、多菌灵、腐霉利的信噪比分别为190、115、110、203、454、743、230。不考虑样品基质在检测条件下对于仪器条件的干扰导致的基线变化情况,以3倍信噪比作为各化合物的检出限,则6-苄基腺嘌呤、恩诺沙星、赤霉素、4-氯苯氧乙酸、2,4-D、多菌灵、腐霉利最低检出限分别为0.015 8、0.026 1、0.027 3、0.014 8、0.006 6、0.004 0、0.013 0 μg/kg,完全能满足日本[20-21]、美国限量标准的检测需要[22-23]。
按照农药残留相关标准的检测要求[24-25],以实际能做到的最低检测质量浓度为检出限。将上述7 种农药标准品加入阴性豆芽样品基质中配制成0.01 μg/mL的溶液,并视峰面积的大小进行逐级稀释并上机。图1表明,加入豆芽基质后,会使仪器基线信号有部分放大,导致各类化合物的检出限会有改变,6-苄基腺嘌呤、恩诺沙星、赤霉素、4-氯苯氧乙酸、2,4-D、多菌灵、腐霉利检出限分别为0.045 3、0.125、0.052 6、0.032 8、0.028 1、0.010 5、0.039 2 μg/kg。
与其他方法相比,使用液相色谱-质谱进行检测时,豆芽基质在此7 种化合物的峰附近的干扰很少(黄豆芽基质中无干扰)。这可能是由于选择二级离子、仪器离子精度高的原因。但是绿豆芽中存在部分化合物的干扰现象,如图2所示。绿豆芽基质在2,4-D的出峰时间6.82 min处有峰干扰,但是只是其中一组离子有干扰,可以通过更换定量离子来进行定量。而绿豆芽在6-苄基腺嘌呤峰附近(6-苄基腺嘌呤出峰时间为3.74 min,干扰物质出峰时间为3.55 min)有一个小干扰峰,且两组离子均有相应。但是可以通过设置仪器参数,如调高保留时间控制精度以减少对最终检测结果的误判。
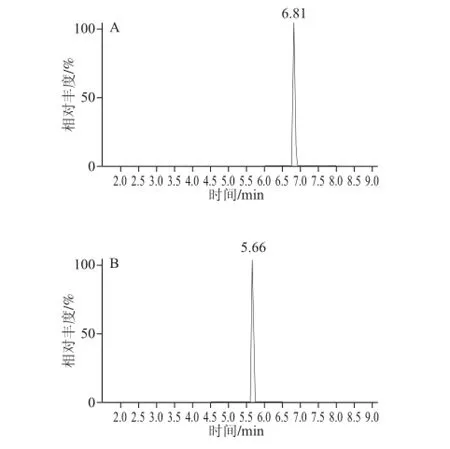
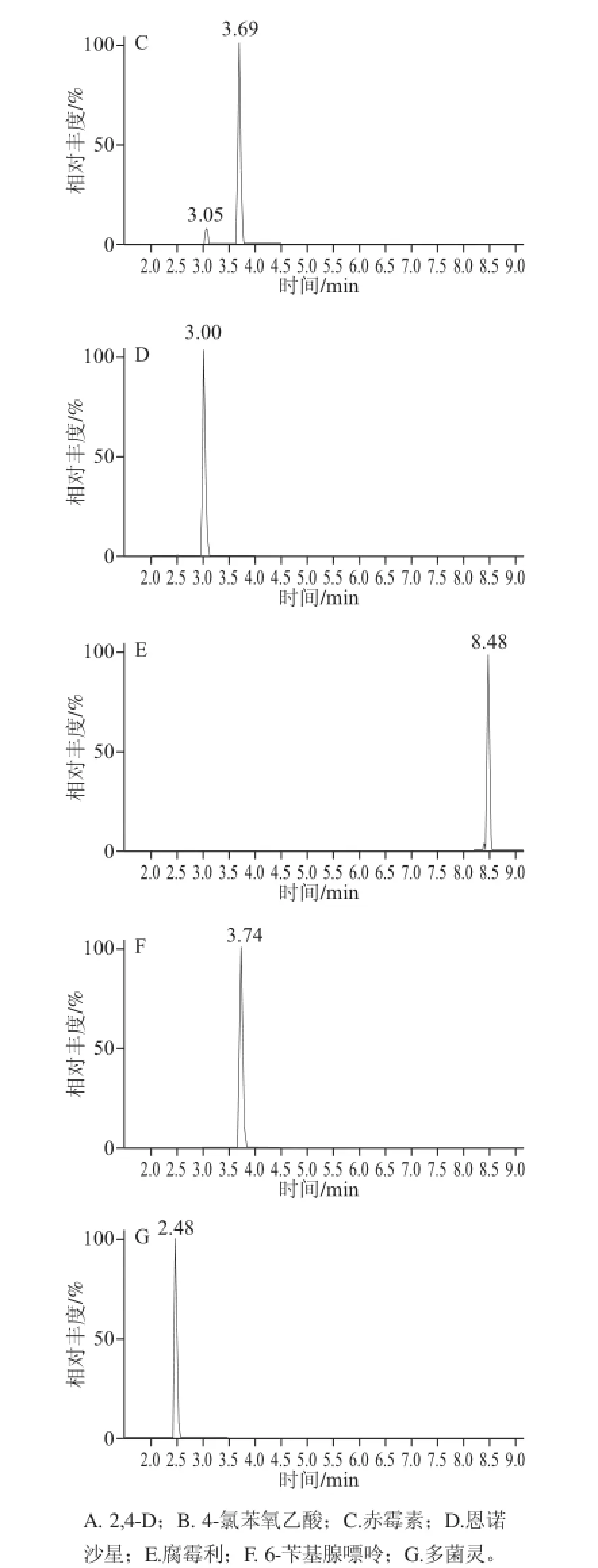
图1 绿豆芽中7 种药物的提取离子扫描质谱图Fig.1 Extracted-ion mass spectra of seven additives in mung bean sprouts


图2 绿豆芽基质的提取离子流图Fig.2 Extracted-ion current chromatograms of seven additives in mung bean sprouts
2.4 回收率与精密度
采用标准添加法,在空白豆芽基质中添加0.002、0.2、0.5 mg/kg标品进行回收率实验,每个添加量进行8 个样品平行实验,回收率和相关系数结果见表6。结果表明,该方法对7 种药物的回收率为60.31%~108.51%,精密度(相对标准偏差(relative standard deviation,RSD))在1.03%~13.10%之间。

表6 豆芽中7 种化合物3 种添加量的回收率和精密度(n=6)Table6 Recovery rates and relative standard deviations of seven compounds in spiked bean sprouts (n=6)
2.5 实际样品分析
从深圳市场和超市随机抽取30 个豆芽样品(15 个黄豆芽、15 个绿豆芽)进行7 种药物的检测,共3 个样品4 种药物10 次检出,其中多菌灵检出2 次,最高含量0.10 μg/kg;6-苄基腺嘌呤检出3 次,最高含量0.052 μg/kg ;2,4-D检出2 次,最高含量0.087 μg/kg;赤霉素检出3 次,最高含量0.21 μg/kg。
3 结 论
本实验使用乙腈对6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-D、赤霉素、多菌灵、腐霉利和恩诺沙星进行同时快速提取,结合使用高效液相串联四极杆质谱仪对7 种非法添加物进行同时检测。前处理方法简单快捷,经实验测算,每次前处理耗时2.5 h,可同时处理样品12 个左右。使用该方法对黄豆芽和绿豆芽进行3 个添标回收,结果表明7 种化合物的添加回收率稳定(60.31%~108.51%),精密度好(RSD为1.03%~13.10%),检出限低(0.010 5~0.125 μg/kg)。
综上所述,使用该方法对豆芽进行检测,更加有利于在我国现有国情下对豆芽产品进行全面快速监控,提高监控的应急水平,满足人们对于安全豆芽的食用需求。
[1] 余露. 豆芽生产禁用农药、化学添加剂[J]. 农药市场信息, 2013(3): 12.
[2] 王卫明. 从豆芽案件看食品安全监管立法的缺陷[J]. 上海政法学院学报: 法治论丛, 2013(3): 1-5.
[3] 陈梦茜, 李清雅, 单晓云, 等. 江苏省四市消费者无根豆芽认知、态度、行为调查[J]. 中国食物与营养, 2013(5): 75-77.
[4] 李小平, 蒋经伟, 范建中, 等. 固相萃取HPLC法测定豆芽中4-氯苯氧乙酸钠[J]. 中国卫生检验杂志, 2006(3): 267-269.
[5] 谢寒冰, 林洪, 蒋万枫, 等. 高效液相色谱-电喷雾质谱联用法检测豆芽中残留的6-苄基腺嘌呤[J]. 山东农业科学, 2008(2): 92-94.
[6] 柳菡, 吴斌, 殷耀, 等. 高效液相色谱-串联质谱法测定芽苗类蔬菜及其来源豆类中4 种非法添加物的残留量[J]. 色谱, 2013(1): 22-26.
[7] 彭姝, 张昊, 郇正玉, 等. 豆芽中三种常见激素的高效液相色谱检测法[J]. 山东农业科学, 2010(2): 95-98.
[8] 崔相勇, 张凤清, 周长民, 等. 高效液相色谱-质谱 联用法测定豆芽中恩诺沙星含量[J]. 食品科学, 2012, 33(20): 180-183.
[9] DB S22/003—2012 豆芽中6-苄氨基嘌呤的测定: 高效液相色谱法[S].
[10] DB33T 625.3—2007 无公害豆芽. 第3部分: 6-苄基腺嘌呤残留量和4-氯苯氧乙酸钠残留量的测定[S].
[11] DB11T 379—2006 豆芽中4-氯苯氧乙酸钠、6-苄基腺嘌呤、2,4-滴、赤霉素、福美双的测定[S].
[12] 唐根源, 吴红京. 高效液相色谱法测定食用豆芽中激素物质的含量[J].色谱, 1993(5): 321-323.
[13] 柴勇, 杨俊英, 李必全, 等. 市售豆芽中激素和生长调节剂检测分析[J].西南农业学报, 2007(4): 698-701.
[14] 田文礼, 彭文君, 韩胜明, 等. 液相色谱-串联三重四极杆质谱测定蜂蜜中的氯霉素残留[J]. 食品科学, 2009, 30(14): 285-287.
[15] 王建华, 杨君, 刘琳, 等. 液相色谱-四极杆-飞行时 间质谱法筛查食品中6 种人工合成甜味剂[J]. 食品科学, 2014, 35(8): 181-186.
[16] 路勇, 渠岩, 冯楠, 等. 超高效液相色谱-串联四极杆质谱法快速筛查食品中的45 种工 业染料[J]. 食品科学, 2012, 33(6): 176-180.
[17] 何佳, 吴延晖, 张曼, 等. 肉及肉制品中2,4-滴残留量的测定[J]. 食品研究与开发, 2011, 32(4): 138-140.
[18] 赵扬, 郑志明, 金社胜, 等. 液质联用法同时测定猪粪便中16 种(氟)喹诺酮类药物残留[J]. 农业环境科学学报, 2011(6): 1248-1253.
[19] 钟莉萍, 徐敦明, 方恩华, 等. 高效液相色谱法和高效液相色谱-质谱/质谱法测定荔枝中对氯苯氧乙酸(钠)[J]. 检验检疫学刊, 2010(2): 24-27.
[20] 郑庆伟. 日本修订甲氧虫酰肼等8 种农药残留限量标准[J]. 农药市场信息, 2014(8): 37.
[21] 明星星. 国内外农产品中农药最高残留限量标准的 比对分析研究[D].北京: 中国农业大学, 2005.
[22] 刘刚. 美国修订多种农药的残留限量要求[J]. 农药市场信息, 2014(13): 39.
[23] 李芳, 李正 名. 对近几十年来美国农药使用的评估及其发展趋势[J].世界农药, 2014(1): 1-12.
[24] 张宏军, 宋稳成, 段丽芳, 等. CCPR第46届年会农药残留限量标准制定新进展[J]. 农 药学学报, 2014(3): 336.
[25] 李太平. 食品中农药最大残留限量标准的安全漏洞分析[J]. 食品科学, 2011, 32(3): 266-271.
Simultaneous Determination of Seven Drug Residues in Bean Sprouts by High Performance Liquid Chromatography-Tandem Mass Spectrometry
HU Xiang-na1, GU Ya-ping1,*, LIN Hui-chun1, WANG Rui1, FANG Chang-fa2
(1. Shenzhen Centre of Inspection and Testing for Agricultural Products, Shenzhen 518040, China; 2. School of Applied Chemistry and Biological Technology, Shenzhen Polytechnic, Shenzhen 518055, China)
A high performance liquid chromatography-tandem mass spectrometry (HPLC-MS-MS) method was developed for the simultaneous determination of seven drug residues including 6-benzylaminopurine, para-chlorophenoxyacetic acid, 2,4-D, gibberellin A3, carbendazim, procymidone, and enrofloxacin in bean sprouts. The seven compounds from samples were simultaneously extracted with acetonitrile and analyzed by HPLC-MS-MS. The calibration curves showed good linearity in the range of 0.01-10 μg/mL for 6-benzylaminopurine, para-chlorophenoxyaceti c acid, 10-benzylaminopurine, gibberellin A3, and procymidone, and in the range of 0.01-1 μg/mL for carbendazim and enrofloxacin with correlation coefficients more than or equal to 0.987. The recoveries of these drug residues at three spiked levels (0.002, 0.2 and 0.5 mg/kg) ranged from 60.31% to 108.51%, with relative standard deviation (RSDs) between 1.03% and 13.10% and method detection limit (MDL) between 0.010 5 and 0.125 μg/kg.
high performance liquid chromatography tandem mass spectrometry (HPLC-MS-MS); bean sprouts; 6-benzylaminopurine; para-chlorophenoxyacetic acid; 2,4-D; gibberellin A3; carbendazim ; procymidone; enrofloxacin
TS207.3;O657.63
A
1002-6630(2014)20-0253-05
10.7506/spkx1002-6630-201420050
2014-01-15
胡祥娜(1969—),女,高级农艺师,本科,主要从事农产品质量安全监测研究。E-mail:huxiangna@163.com
*通信作者:顾亚萍(1982—),女,工程师,硕士,主要从事农产品安全分析检测研究。E-mail:gypfcf@qq.com

