固相萃取-高效液相色谱法检测肉鸭表皮组织中的松香酸
张苏珍,耿志明,王道营,诸永志,刘 芳,张牧焓,卞 欢,徐为民,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学 肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
固相萃取-高效液相色谱法检测肉鸭表皮组织中的松香酸
张苏珍1,2,耿志明1,王道营1,诸永志1,刘 芳1,张牧焓1,卞 欢1,徐为民1,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学 肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
采用高效液相色谱法对肉鸭表皮组织中的松香酸含量进行检测。肉鸭表皮组织中的松香酸用乙腈提取,经C18固相萃 取柱净化,采用高效液相色谱-紫外法进行检测。色谱柱:反相C18柱(250 mm×4.6 mm,5 μm),流动相:0.003 m ol/L磷酸溶液-甲醇(8∶92,V/V);流 速:1 mL/min;检测波长:240 nm。结果表明:方法线性范围为0.1~10 mg/L,检出限为0.10 μg/g,定量限为0.33 μg/g。在0.5~50 μg/g的添加 范围内回收率为82.2%~88.0%。实际样品分析结果显示,松香脱毛处理的肉鸭表皮中松香酸含量高达14.52 μg/g。本实验建立的分析方法简便快捷、具有较好的灵敏度和可靠性,可用于肉鸭表皮组织中松香酸的定量分析。
肉鸭;松香;松香酸;高效液相色谱法;固相萃取
松香是将松树的含油树脂蒸去挥发的松节油后得到的透明固体物质,主要成分为松香酸和脱氢松香酸。松香是重要的化工原料,主要用于肥皂、造纸、油漆涂料、黏合剂、橡胶、电气、建筑材料等工业[1]。松香加热后具有良好的黏附性,曾经被广泛用于鸭、鹅等水禽加工中的二次脱毛工序。毒理学研究表明松香酸可导致人体肺泡上皮细胞溶解,脱氢松香酸对人体红细胞、多核白细胞有毒性作用[2-7],Ozaki等[8]发现脱 氢松香酸和松香酸会损伤DNA的活性;Kamaya等[9]研究了松香酸、脱氢松香酸对大型水蚤生长的影响,发现二者对水蚤的生长有一定的限制作用。在脱毛加工时,松香酸及脱氢松香酸会通过渗透残留在鸭、鹅的表皮组织中,食用经松香脱毛加工的禽肉产品将给消费者带来严重的健康隐患。2009年,我国颁布实施《食品安全法》,禁止在畜禽加工中使用松香进行脱毛。但由于批准使用的畜禽脱毛剂(松香酸甘油酯)价格高、且脱毛效果不理想,受利益驱动,不良企业、作坊违法使用松香进行畜禽脱毛加工的现象十分严重。而执法部门缺乏有效检测方法和技术,只能现场监管而无法进行产品追溯,也是松香脱毛现象屡禁不止的原因之一。开展水禽中松香脱毛剂残留物质检测技术研究,建立相应的检测方法,可以为执法部门打击违法使用松香脱毛加工畜禽行为提供可靠的检测依据,对于我国禽类产业的健康发展、保护消费者健康具有重要意义。
有关松香酸含量的检测技术研究包括松香产品质量分析以及某些产品中松香酸的含量分析。松香产品中的松香酸含量主要通过气相色谱[10-11]或高效液相色谱(high performance liquid chromatography,HPLC)[12-20]进行分析。由于松香酸的毒性作用,某些产品中掺入或残留的松香酸含量的检测方法研究也引起了人们关注。李富贤等[21]采用HPLC分析清毒素胶囊中松香酸的含量;Lee等[22]通过HPLC法实现了胶黏剂中松香酸的检测;Hroboňová等[23]建立了利用液相色谱-质谱分析蜂胶中掺杂的松香酸含量的方法;Nilsson等[20]将HPLC法应用于化妆品中松香酸的检测。另外,Chow等[24]通过HPLC法检测了造纸厂纸浆中松香酸的含量;Mitani等[25]则通过HPLC法分析了食品包装迁移到食品中的松香酸含量。但有关松香在畜禽肉制品中残留的检测方法还未见报道。本研究以松香的主要成分松香酸(结构见图1)为松香脱毛加工肉鸭时在肉鸭表皮组织中的主要残留标志物,通过样品提取、净化条件的确立,以及HPLC分离、检测条件的优化,建立肉鸭表皮组织中松香酸的定性、定量检测方法。本方法具有操作便捷、灵敏度高、自动化程度高等优点,可用于经松香脱毛处理的水禽中残留松香酸的分析检测。
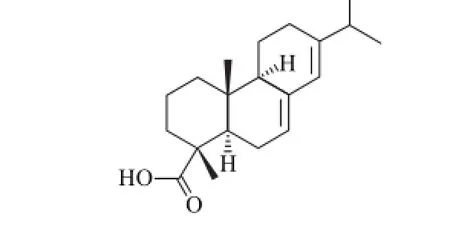
图1 松香酸分子结构Fig.1 Molecular structure of abietic acid
1 材料与方法
1.1 材料与试剂
肉鸭购自农贸市场,宰杀后分别采用人工脱毛和松香脱毛,作为阴性样本和阳性样本。取不同部位表皮组织,切碎,混合均匀,于-20℃保存。
松香酸标准品(纯度95%) 加拿大Helix Biotech公司;乙腈、甲醇(均为色谱纯) 美国Tedia公司;水由美国Millipore公司纯水仪制备;其余试剂为分析纯。
1.2 仪器与设备
Ultimate-3000高效液相色谱(配有VWD-3000紫外检测器、Chromeleon色谱管理系统软件、LPG-3400SD四元分析泵、WPS-3000SL自动进样器) 美国Dionex公司;Xtimate C18色谱柱 美国Welch公司;Biofuge stratos高速离心机 德国Heraeus公司;HS2060A超声波振荡器常州国华电器有限公司;PX-12固相萃取装置 天津谱祥科技有限公司;C18固相萃取(solid-phase extraction,SPE)小柱 美国Supelco公司。
1.3 方法
1.3.1 标准溶液配制
称取适量松香酸标准品,用甲醇溶解,配制100 mg/L松香酸储备液。用移液管吸取适量标准储备溶液,用流动相(0.003 mol/L磷酸溶液-甲醇,8∶92,V/V)稀释配制质量浓度为0.1~10 mg/L系列工作溶液。
1.3.2 样品处理
称取1 g(准确至0.001 g)混合均匀的样品于10 mL离心管中,加入5 mL乙腈,漩涡振摇后超声波水浴振荡10 min,4 000 r/min离心5 min。吸取上清液4 mL,加入4 mL水混匀,通过C18SPE小柱(预先用3 mL乙腈、3 mL水活化),用3 mL 40%乙腈溶液淋洗,最后用2 mL的甲醇洗脱,洗脱液经0.22 μm微孔滤膜过滤,待HPLC分析。
1.3.3 色谱条件
色谱柱:C18柱(250 mm×4.6 mm,5 μm);流动相:0.003 mol/L磷酸溶液-甲醇(8∶92,V/V);流速:1mL/min;柱温:25℃;检测波长:240nm;进样量:20μL。
2 结果与分析
2.1 样品提取及净化
根据松香酸的性质,样品用乙腈提取,最终使提取的松香酸溶于40%的乙腈溶液中,上样于C18SPE小柱。分别观察40%~60%乙腈溶液淋洗的效果,结果发现,乙腈体积分数显著影响净化效果和松香酸在SPE小柱上的回收率,40%的乙腈溶液使松香酸保留在C18SPE小柱的同时,可有效去除部分杂质。
2.2 色谱条件优化
为选择最佳检测波长,本实验采用3波长模式(230、240 nm和250 nm)同时检测1.0 mg/L的松香酸标准溶液(图2)。结果表明,松香酸在240 nm波长处有最大吸收峰,且在240 nm波长处基线稳定,因此将检测波长设为240 nm。

图2 1 mg/L松香酸在不同波长处的HPLC图Fig.2 HPLC chromatograms of 1 mg/L abietic acid at wavelengths of 230 nm (A), 240 nm (B) and 250 nm (C)
分别配制了3种流动相体系:乙腈-0.1%甲酸溶液(75∶25,V/V)、乙腈-甲醇-0.1%甲酸(7∶2∶1,V/V)以及不同比例的0.003 mol/L磷酸溶液-甲醇,观察三者对松香酸在C18柱上保留行为的影响。结果发现,甲醇-磷酸组成的流动相下松香酸的峰形最好,随着甲醇比例的升高,松香酸保留时间缩短、峰高增加,当流动相0.003 mol/L磷酸溶液-甲醇8∶92(V/V)时,保留时间适中且拥有良好的检测限。
本实验还观察了温度、流速对松香酸在C18柱上的保留行为的影响,二者对松香酸的保留时间有一定影响,但对检测灵敏度影响不大,结果表明适宜条件为温度25 ℃、流速1.0 mL/min。在设定的色谱条件下,松香酸保留时间约10.8 min(图2)。
2.3 线性范围、检出限及定量限
用流动相0.003 mol/L磷酸溶液-甲醇(8∶92,V/V)分别配制质量浓度为0.1、0.5、1.0、1.5、5.0、10.0 mg/L的松香酸系列工作溶液,在240 nm波长处进行HPLC分析。以松香酸质量浓度为横坐标(x,mg/L),以峰面积为纵坐标(y),得回归方程y=1.963 4 x+0.037 5,R²=0.999 8。由此可见在0.1~10 mg/L范围内,松香酸质量浓度与峰面积呈良好的线性关系。
分别按照3倍信噪比(RSN=3)和10倍信噪比(RSN=10)计算方法的检出限和定量限,检出限为0.10 μg/g,定量限为0.33 μg/g。
2.4 精密度实验
称取阳性样品10 g,充分剪碎。平行称取7份剪碎的阳性样品,每份精确至1 g。按1.3.2节样品前处理方法处理后进样HPLC测定,记录峰面积,计算相对标准偏差(RSD),结果见表1。
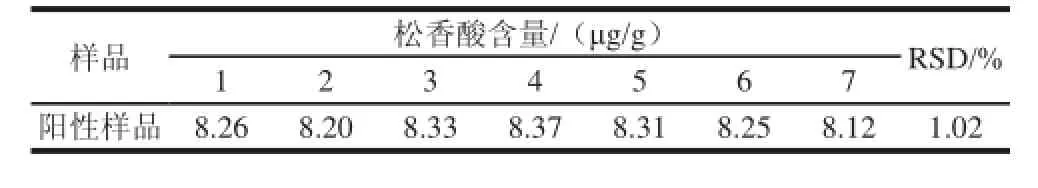
表1 阳性样品精密度实验结果Table 1 Precision (RSDs) for positive samples
2.5 回收率实验
称取剁碎的阴性表皮样品1 g于10 mL离心管中,加入1 mL的0.5、5、50 mg/L的松香酸标准溶液,并在室温条件下放置1 h(使松香酸渗透至样品中),然后按1.3.2节进行样品处理,按1.3.3节进行HPLC检测,比较添加量和检测量计算添加回收率,结果见表2。在3个不同的水平,松香酸的平均回收率为85.6%。
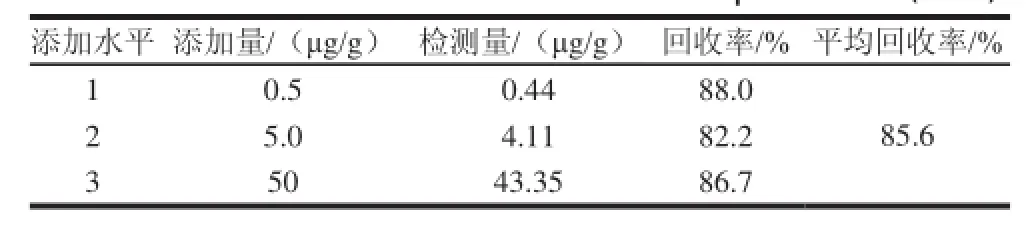
表2 松香酸不同添加水平回收率测定结果( =3)Table 2 Recoveries of abietic acid at different spiked levels ( = 3)
2.6 实际样品分析
分别分析了1个阴性样品、5个阳性样品中松香酸的含量,另外对肉鸭屠宰厂C和D的未知样品C1、C2、C3、D1、D2、D3进行了松香酸含量检测(表3、图3)。在阴性样品中未检出松香酸,而在阳性样品中松香酸含量最高达14.52 μg/g,平均值为10.2 μg/g。两个屠宰厂的未知样品中均检测到残留的松香酸,C和D屠宰厂检测到的松香酸含量平均值分别为2.58 μg/g和4.40 μg/g。两家肉鸭屠宰厂的肉鸭表皮中松香酸残留量显著小于实验室自制样品中的松香酸残留量,可能是屠宰厂所用脱毛剂除松香外还有其他组分,降低了松香酸在肉鸭表皮中的残留量。另外,脱毛环节工艺条件的不同,也可能导致残留在成品白条鸭中松香酸含量的差异。

表3 实际样品分析结果( =3)Table 3 Abietic acid content in real samples ( = 3)

图3 样品的HPLC图Fig.3 HPLC chromatograms of positive and negative samples
3 结 论
本实验通过样品处理条件和色谱条件的优化,建立了松香脱毛处理的肉鸭表皮中松香酸的HPLC检测方法。肉鸭表皮样品中的松香酸经乙腈超声波提取,采用C18SPE小柱净化,然后以0.003 mol/L磷酸溶液-甲醇(8∶92,V/V)为流动相、在反相C18柱上进行分离。线性范围0.1~10.0 mg/L,检出限、定量限分别为0.10 μg/g和0.33 μg/g,在0.5~50 μg/g的添加范围内,平均回收率85.6%。对采用松香脱毛的实际肉鸭样品进行了检测,松香酸残留量最高达14.52 μg/g。对两个屠宰厂生产的白条鸭进行随机抽检,在未知样品中均检测到松香酸。结果表明,采用松香脱毛的肉鸭经过整个生产链加工后表皮仍残留松香酸。本方法操作简便、具有良好的灵敏度和准确性。鉴于松香脱毛现象十分严重,以及松香酸具有相当高的稳定性,后续研究将围绕通过优化样品处理条件和色谱条件,将本实验建立的方法应用于水禽加工制品(盐水鸭/鹅、烤鸭、风鹅等)中松香酸残留的测定。
[1] LISS S N, BICHO P A, SADDLER J N. Microbiology and biodegradation of resin acids in pulp mill effluents: a minireview[J]. Canadian Journal of Microbiology, 1997, 43(7): 599-611.
[2] OZAKI A, OOSHIMA T, MORI Y. Migration of dehydroabietic and abietic acids from paper and paperboard food packaging into food-simulating solvents and Tenax TA[J]. Food Additives and Contaminants, 2006, 23(8): 854-860.
[3] TAVENDALE M H, MCFARLANE P N, MACKIE K L, et al. The fate of resin acids-1. The biotransformation and degradation of deuterium labelled dehydroabietic acid in anaerobic sediments[J]. Chemosphere, 1997, 35(10): 2137-2151.
[4] SMITH P A, GARDNER D R, DROWN D B, et al. Detection of resin acid compounds in airborne particulate generated from rosin used as a soldering flux[J]. American Industrial Hygiene Association Journal, 1997, 58(12): 868-875.
[5] NESTMANN E R, LEE E G, MATULA T I, et al. Mutagenicity of constituents identified in pulp and paper mill effluents using the Salmonella/mammalian-microsome assay[J]. Mutation Research/ Genetic Toxicology, 1980, 79(3): 203-212.
[6] SUNZEL B, SÖDERBERG T A, REUTERVING C, et al. Neutralizing effect of zinc oxide on dehydroabietic acid-induced toxicity on human polymorphonuclear leukocytes[J]. Biological Trace Element Research, 1991, 30(3): 257-266.
[7] SÖDERBERG T A, JOHANSSON A, GREF R. Toxic effects of some conifer resin acids and tea tree oil on human epithelial and fibroblast cells[J]. Toxicology, 1996, 107(2): 99-109.
[8] OZAKI A, YAMAGUCHI Y, FUJITA T, et al. Safety assessment of paper and board food packaging: chemical analysis and genotoxicity of possible contaminants in packaging[J]. Food Additives and Contaminants, 2005, 22(10): 1053-1060.
[9] KAMAYA Y, TOKITA N, SUZUKI K. Effects of dehydroabietic acid and abietic acid on survival, reproduction, and growth of the crustacean Daphnia magna[J]. Ecotoxicology and Environmental Safety, 2005, 61(1): 83-88.
[10] 宋湛谦. 马尾松松香中混杂湿地松松香的检测方法[J]. 林产化学与工业, 2005, 25(B10): 137-138.
[11] 黄小泳, 徐明全. GC检测松香产品的有机酸含量[J]. 现代食品与药品杂志, 2006, 16(6): 28-29.
[12] 刘伟华. 松香药材中松香酸的含量测定方法[J]. 医药论坛杂志, 2011, 32(24): 46-48.
[13] 肖聪, 饶伟文, 钟名诚. 没药掺伪品中松香酸的检测方法研究[J]. 中药材, 2012, 35(8): 1237-1241.
[14] 张妤琳, 曹玲, 谭力, 等. 液质联用技术用于沉香中非法掺入含松香酸类物质的检测[J]. 中成药, 2011, 33(5): 844-847.
[15] 王英锋, 魏小燕. HPLC测定枫香脂碱提物中脱氢松香酸和松香酸的含量[J]. 中国中药杂志, 2013, 38(1): 57-59.
[16] SMITH P A, SON P S, CALLAGHAN P M, et al. Sampling and analysis of airborne resin acids and solvent-soluble material derived from heated colophony (rosin) flux: a method to quantify exposure to sensitizing compounds liberated during electronics soldering[J]. Toxicology, 1996, 111(1): 225-238.
[17] KERSTEN P J, KOPPER B J, RAFFA K F, et al. Rapid analysis of abietanes in conifers[J]. Journal of Chemical Ecology, 2006, 32(12): 2679-2685.
[18] LEE B L, KOH D, ONG H Y, et al. High-performance liquid chromatographic determination of dehydroabietic and abietic acids in traditional Chinese medications[J]. Journal of Chromatography A, 1997, 763(1): 221-226.
[19] SADHRA S, GRAY C N, FOULDS I S. High-performance liquid chromatography of unmodified rosin and its applications in contact dermatology[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1997, 700(1): 101-110.
[20] NILSSON U, BERGLUND N, LINDAHL F, et al. SPE and HPLC/ UV of resin acids in colophonium-containing products[J]. Journal of Separation Science, 2008, 31(15): 2784-2790.
[21] 李富贤, 米彩峰, 石会丽. RP-HPLC测定清毒素胶囊中松香酸的含量[J]. 中国中药杂志, 2008, 33(9): 1086-1087.
[22] LEE B L, ONG H Y, KOH D, et al. High-performance liquid chromatographic method for determination of dehydroabietic and abietic acids, the skin sensitizers in bindi adhesive[J]. Journal of Chromatography A, 1994, 685(2): 263-269.
[23] HROBOŇOV˘ K, LEHOTAY J, SKAȢNI I, et al. HPLC determination and MS identification of dehydroabietic acid and abietic acid in propolis[J]. Journal of Liquid Chromatography & Related Technologies, 2005, 28(11): 1725-1735.
[24] CHOW S Z, SHEPARD D. High performance liquid chromatographic determination of resin acids in pulp mill effluent[J]. Tappi Journal, 1996, 79(10): 173-179.
[25] MITANI K, FUJIOKA M, UCHIDA A, et al. Analysis of abietic acid and dehydroabietic acid in food samples by in-tube solidphase microextraction coupled with liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2007, 1146(1): 61-66.
Determination of Abietic Acid in Duck Skin Tissue by Solid Phase Extraction-High Performance Liquid Chromatography
ZHANG Su-zhen1,2, GENG Zhi-ming1, WANG Dao-ying1, ZHU Yong-zhi1, LIU Fang1, ZHANG Mu-han1, BIAN Huan1, XU Wei-min1,*
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China)
A high-performance liquid chromatographic (HPLC) method was established to determine abietic acid in duck skin. Abietic acid in duck skin samples was extracted with acetonitrile, followed by purification with a C18solid-phase extraction cartridge, and determined by HPLC with an ultraviolet (UV) detector. The chromatographic conditions were established using a C18column (250 mm× 4.6 mm, 5 μm) with a mobile phase consisting of 0.003 mol/L phosphoric acidmethanol (8:92, V/V) at a f ow rate of 1.0 mL/min and the detection wavelength was set at 240 nm. Results indicated that the linearity ranged from 0.1 to 10.0 mg/L, the detection limit of abietic acid was 0.1 μg/g, and the quantif cation limit was 0.33 μg/g. The recoveries from spiked samples at conc entration levels of 0.5–50 μg/g were in the range of 82.2%–88.0%. The developed method was successfully applied to the determination of abietic acid in duck samples epilated with colophony. The content of abietic acid in the duck sample could reach 14.52 μ g/g. This method proved to be of high maneuverability as well as excellent sensitivity and accuracy, and could be used for quantitative analysis of abietic acid in duck skin tissue.
duck; rosin; abietic acid; high performance liquid chromatography (HPLC); sol id phase extraction (SPE)
TS207;O657
A
1002-6630(2014)04-0082-04
10.7506/spkx1002-6630-201404017
2013-04-27
国家自然科学基金青年科学基金项目(31101312);江苏省农业科技自主创新资金项目(CX(12)3082)
张苏珍(1988—),女,硕士研究生,研究方向为食品科学。E-mail:xsdzsz@126.com
*通信作者:徐为民(1969—),男,研究员,博士,研究方向为食品科学。E-mail:weiminxu2002@aliyun.com

