大黄素对高脂血症金黄地鼠脂代谢紊乱的改善作用
范宝妍 朱海波
中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室“新药作用机制研究与药效评价”北京市重点实验室,北京 100050
高脂血症是体内脂质代谢紊乱而形成的血浆中一种或多种脂质含量超过正常值的一种病症,其中低密度脂蛋白胆固醇(LDL-C)是导致动脉粥样硬化(AS)的独立危险因素,临床上控制循环中脂质水平是防治心脑血管疾病的必要手段[1]。但已上市的一线化药,如他汀类、贝特类等,其不良反应限制了其应用范围[2]。因此具有调血脂功效的天然产物逐步受到重视。
大黄素是中药大黄的主要有效成分,中医传统认为大黄具有攻积滞、清湿热、泻火、凉血等功效,近年来文献报道大黄素也具有抗氧化、抗肿瘤、保肝、抗菌等作用[3]。本研究建立实验性高脂血症金黄地鼠模型,观察大黄素对高脂血症的改善作用,并结合脂蛋白谱分析及核磁共振代谢组学技术,寻找大黄素改善脂质代谢的精细差异,为其临床应用提供实验证据。
1 材料与方法
1.1 动物
SPF 级叙利亚金黄地鼠,雄性,体重90~110 g,由北京维通利华实验动物技术有限公司提供, 合格证号:SCXK(京)2006-0009。
1.2 饲料
基础饲料与高脂饲料均由北京华阜康生物科技股份有限公司提供。 高脂饲料配方:由基础饲料添加0.2%胆固醇,20%动物脂肪重新制粒,灭菌封装。
1.3 模型与分组给药
动物适应环境饲养1 周后, 根据体重随机分成4 组,分别为正常对照组(Con 组)、模型对照组(HFD组)、阳性对照组(Simvastatin 组)及大黄素组(Emodin 组)。高脂饲料造模1 周(Con 组给予普通饲料)后开始给药。 各给药组每天灌胃给药1 次,Simvastatin 组给予辛伐他汀6 mg/kg,Emodin 组给于大黄素70 mg/kg。Con 组、HFD 组每天给予等体积的蒸馏水。
1.4 药物与试剂
辛伐他汀购自杭州默沙东制药有限公司 (批号:120945),总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇 (HDL-C)、LDL-C 检测试剂盒均购自中生北控生物科技股份有限公司。 Amplex Red、Nile Red染料购自Sigma 公司,其余分析纯试剂均购自北京化学试剂公司。
1.5 仪器
荧光酶标仪,美国MD 公司;AKATA Purifier 10 System、900 fraction collector、Superdex 200、Superose 6,GE 公司;Bruker AVANCE Ⅲ-500 超导傅立叶变化核磁共振波谱仪,瑞士布鲁克公司。
1.6 生化指标检测
于给药第28 天动物眼眶静脉取血(禁食12 h),参照试剂盒说明书测定血清中血脂指标。
1.7 血清脂蛋白的分离和脂质荧光检测
用3%戊巴比妥钠溶液麻醉动物后, 采集腹主动脉血液,分装至含1%肝素钠的EP 管中。 参照文献[4]方法进行血浆脂蛋白分离及脂质荧光检测实验。
1.8 核磁共振代谢组学
取血浆30 μL,添加生理盐水后混匀,离心后取上清60 μL 加入1.7 mm 核磁样品管中, 于4℃冰箱保存备用。 在Bruker VARIAN Ⅲ-500 超导傅立叶变化核磁共振波谱仪上, 血浆样品调用NOESY 脉冲序列、 弛豫时间编辑 (Carr-Purcell-Meiboom-Gill,CPMG)和扩散编辑(longitudinal eddy-delay,LED)相关脉冲序列,采用预饱和方式抑制水峰,预饱和时间为2 s ,谱宽8000 Hz,采样点数32 k,累加次数128 次,预饱和频率和中心频率都在水峰位置。自由感应衰减(free induction decay,FID)信号经过32 k 点傅立叶变换转为一维NMR 谱图。 以TSP 为化学位移参考峰的位置,设为0。 调用AMIX(Analysis of MIXtures software v.3.0,Bruker Biospin) 软件中的程序将1H-NMR图谱按5~0.5 的范围进行分段积分,每段为0.04。 将积分数据归一化之后, 用SIMCA-P12.0 软件包进行模式识别分析及皮尔森相关性分析。采用主成分分析(principal components analysis,PCA)观察试验样品的自然分布和组别关系, 为进一步区分不同组别差异,采用偏最小方差判别分析 (partial least squares discriminate analysis,PLS-DA)。
1.9 统计学方法
采用统计软件GraphPad Prism 5 进行数据分析,计量资料数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析, 组间两两比较采用LSD-t 检验,以P < 0.05 为差异有统计学意义。
2 结果
2.1 大黄素对金黄地鼠血脂水平影响
与Con 组 比 较, 给 药4 周 后HFD 组TC、TG、LDL-C 水平均显著升高(P < 0.05);与HFD 组相比,Simvastatin 组给药4 周后TC、TG、LDL-C 水平明显下降(P<0.05),大黄素在70 mg/kg 剂量下的血清TC、TG及LDL-C 水平与HFD 组相比有显著性降低(P<0.05),但对HDL-C 水平无显著影响(P > 0.05)。 见表1。
2.2 高脂血症金黄地鼠脂蛋白差异谱绘制
Con 组、HFD 组、Simvastatin 组和Emodin 组的金黄地鼠血清脂蛋白谱具有显著差异(图1A~D)。 将紫外吸收数值根据标准蛋白回归公式计算获得各组脂蛋白含量与Con 组相比,HFD 组VLDL 及LDL 含量明显升高,HDL 含量明显降低,VLDL 及LDL 中脂质成分TC及TG 的含量明显升高, 差异有高度统计学意义(P<0.01);给予辛伐他汀后能显著降低VLDL 及LDL 水平,降低VLDL 中TC、TG 的含量,降低LDL 中TC 含量,差异有统计学意义(P<0.05);给予大黄素能显著降低高脂血症金黄地鼠血清VLDL 水平,升高HDL 水平,差异有统计学意义(P<0.05)。 大黄素可降低VLDL 及HDL中TG 的含量,降低VLDL 中TC 含量,升高HDL 中TC含量,差异有统计学意义(P<0.05)。 见图1 E~G。
表1 大黄素对高脂血症地鼠血清血脂含量的影响(mg/dL,±s)

表1 大黄素对高脂血症地鼠血清血脂含量的影响(mg/dL,±s)
注:与Con 组比较,##P<0.01,###P<0.001;与HFD 组比较,*P<0.05,**P < 0.01;“-”表示无数据;TC:总胆固醇;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇
?
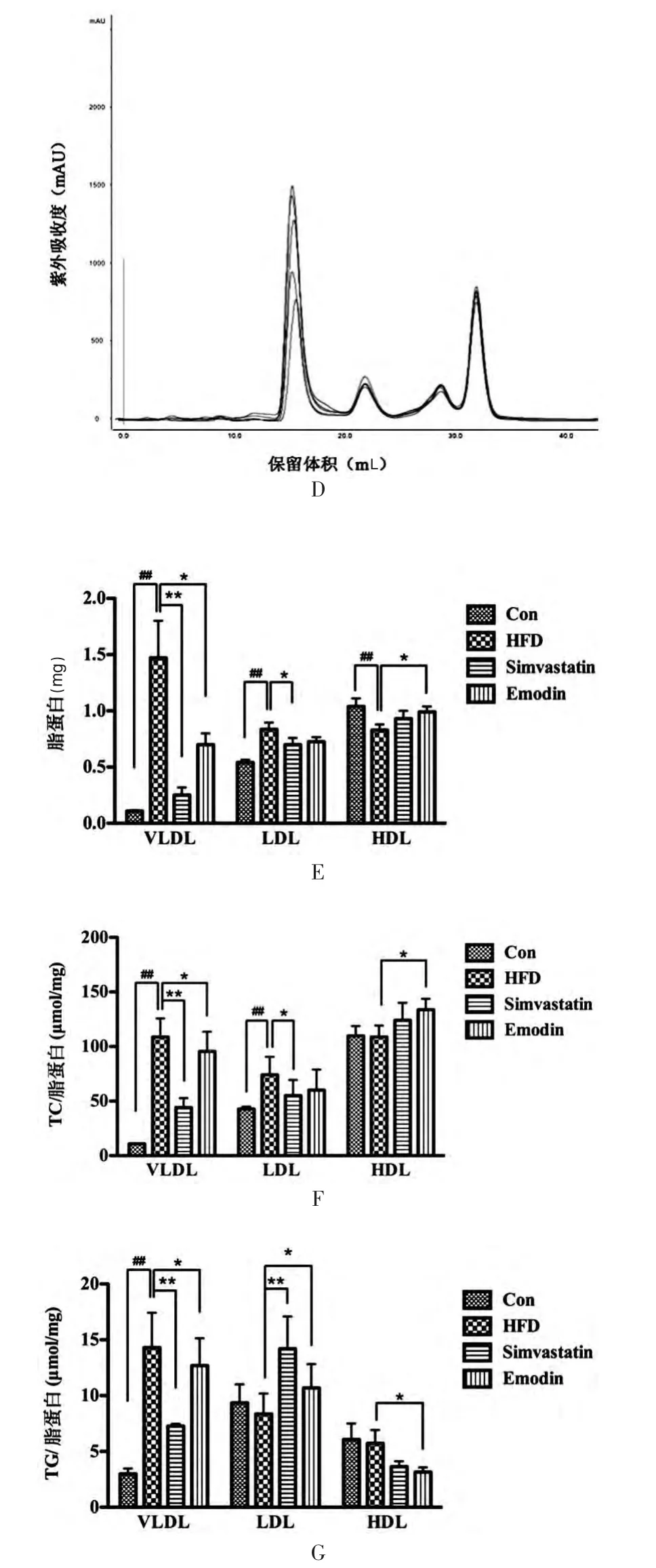
图1 高脂血症金黄地鼠脂蛋白谱
2.3 NMR 代谢组学研究结果

应用核磁共振代谢组学技术,从CPMG、LED 实验及模式识别分析发现,HFD 组血浆中HDL (δ 0.86)、乳酸(δ 1.34、4.1、4.14)、乙酸(δ 1.94)、丙氨酸(δ 1.50)、葡萄糖(δ 3.42~3.98)、赖氨酸(δ1.70、3.02)、柠檬酸(δ 2.54)、磷脂酰胆碱(δ 3.22)、不饱和脂肪酸(δ 2.78、2.82) 等含量较低, 而VLDL/LDL (δ 0.9、0.94、1.34、1.38)、N-乙酰糖蛋白 (δ 2.02、2.06)、 甲硫氨酸(δ 2.14)、甜菜碱(δ 3.30)等含量较高,Con 组和HFD 组能明显区分。给予辛伐他汀及大黄素后内源性小分子和大分子代谢物均表现向正常状态回归的趋势。见图2、3。
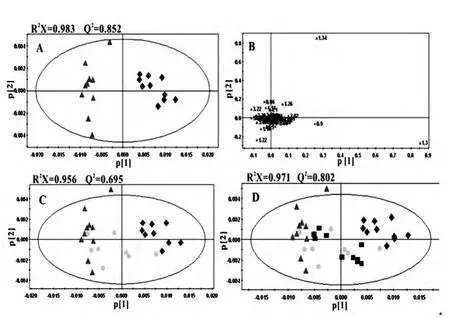
图2 血浆1H-NMR CPMG 实验PLS-DA 得分及载荷图

图3 血浆1H-NMR LEDBP 实验PLS-DA 得分及因子载荷图
3 讨论
高脂血症作为脑卒中、冠心病、心肌梗死等的危险因素之一,进行早期控制,减少并发症发生,是降低患者心血管事件发生的有效控制手段。本研究采用高脂血症动物模型, 观察大黄素对血脂紊乱的改善作用,研究结果表明,大黄素70 mg/kg 给药可以改善动物模型血脂紊乱,降低血清脂质含量。
调血脂药物的药效评价需要建立可靠的血脂代谢紊乱动物模型,豚鼠和金黄地鼠两种动物具有成本较低、造模时间较短的优点,因此目前国际上趋向于采用上述两种动物来建立高脂模型研究血脂代谢相关疾病[5]。通过前期的研究发现,金黄地鼠的脂蛋白谱特征与人类更为相似,并已经被广泛应用于脂代谢研究中[4]。 因此,本研究采用金黄地鼠,结合喂养给予高脂饲料后诱导动物发生血脂增高,建立接近于人类高脂血症发病机制的动物模型。 从结果分析,金黄地鼠给予高脂饲料后,血脂水平显著升高。血清指标:模型组血清TC、TG、LDL-C 含量升高, 与同期正常组相比,有显著性差异。采用该模型观察,大黄素显著降低血清TC、TG 和LDL-C 水平,显示出显著地改善血脂紊乱作用,并且大黄素并未降低血清中HDL-C 含量,提示大黄素在降低血清脂质的同时, 不影响HDL-C水平。由于高密度脂蛋白的主要功能是转运胆固醇排出,是一种抗动脉粥样硬化的血浆脂蛋白,是冠心病的保护因子[6]。 据此推测,大黄素改善HDL-C 功能的性质可能对心血管疾病的治疗有积极意义。
脂蛋白是TG、胆固醇、胆固醇酯和磷脂等与不同载脂蛋白形成的功能性复合体[7],其中的脂质成分除了为机体提供能量,还参与了细胞成分构建和信号传递等重要的生理生化过程[8]。 机体内的脂质存在于不同的载体上,代表着不同的代谢状态,脂蛋白的含量和脂质运载情况能直观反映这种代谢差异。本研究采用分子筛凝胶色谱法对微量血清中脂蛋白进行分离,将脂蛋白VLDL、LDL 峰群与HDL 峰完全分离, 提高了脂蛋白分析的精确性[5]。本研究结果显示,不同脂蛋白组分中脂质含量存在差异。 给予大黄素使血清VLDL 中TC 和TG 含量显著下降,但LDL 转运TG 的能力较强,而HDL 转运TC 的作用更加突出。 脂蛋白谱不仅验证了生化指标变化的结果,同时能精细分析大黄素对不同脂蛋白功能的改变,因此本研究进一步分析了大黄素对HDL 功能影响。
HDL 是一种独特的脂蛋白, 具有明确的抗动脉粥样硬化的作用,并因此获得具有“抗动脉粥样硬化性脂蛋白”的美称,但是以Torcetrapib 为代表的药物,通过增加高密度脂蛋白浓度来改善冠心病的药物却遭受失败的重创[9]。 因此,反思CEPT 抑制剂的开发历程,研究人员发现,单纯提高高密度脂蛋白数量,不能够等同于心血管事件的降低,而高密度脂蛋白功能却被忽视了。 最新的研究表明,高密度脂蛋白功能的提升,有助于改善实验性心血管事件的发生[10]。 通过脂蛋白谱结合脂质检测分析,大黄素治疗后,金黄地鼠血清HDL 运载TC、TG 的能力显著提高。 提示其可能具有调节HDL 功能改善血脂代谢紊乱的作用, 具体的机制仍需后续研究补充。
采用代谢组学方法研究内源性物质的变化及代谢轮廓的变化, 不仅可以观察到传统指标的变化,还可以观察到糖、氨基酸代谢状态的改变,可以加深对疾病状态下机体组织功能的改变,也是全面评价药物的新手段,弥补了传统生化指标检测的不足之处[11-12]。
研究表明,与正常动物相比,高脂血症金黄地鼠的糖、脂及氨基酸代谢均有明显变化在糖代谢方面,三羧酸循环的中间产物乳酸及柠檬酸浓度的降低表明糖酵解速率改变, 三羧酸循环减弱; 在脂代谢方面,FC、FFA 明显升高,与生化检测结果一致,合成脂蛋白的胆碱类化合物及不饱和脂肪酸含量下降;在氨基酸代谢方面, 模型组甲硫氨酸和甜菜碱浓度升高,表明体内甲硫氨酸循环增强,可能导致致动脉粥样硬化危险因素——同型半胱氨酸的升高[13]。 N-乙酰糖蛋白的增高提示炎性反应发生。 大黄素可降低TG、游离胆固醇以及酯化胆固醇、游离脂肪酸含量,使胆碱化合物磷脂酰胆碱含量升高, 后者是合成脂蛋白HDL 的重要成分[14]。大黄素促进脂蛋白合成,防止胆固醇在肝脏内的堆积。 卵磷脂使血液中胆固醇及TG 含量降低, 减少由胆固醇引起的血管内膜损伤,抑制粥样硬化斑块生成[15]。 大黄素升高卵磷脂含量,有助于降低血中TC、TG 含量,利于预防及治疗心血管疾病。
本研究显示,大黄素具有显著改善高脂血症金黄地鼠血脂代谢紊乱的作用,使血清脂蛋白谱向正常回归,且能够增加高密度脂蛋白的脂质运载能力,代谢组学研究结果表明,大黄素可调节血脂水平紊乱动物的血浆内源性代谢物代谢轮廓向正常回归。提示大黄素在治疗高脂血症方面具有深入研究价值。
[1] Wang TJ,Gona P,Larson MG,et al.Multiple biomarkers for the prediction of first major cardiovascular events and death [J]. N Engl J Med,2006,355(25):2631.
[2] Stancu C,Sima A. Statins: mechanism of action and effects [J]. J Cell Mol Med,2001,5(4):378-387.
[3] 张喜平.大黄素的药理作用研究概况[J].中国药理学通报,2003,19(8):851-854.
[4] 高莹,李可基,唐世英,等.几种高脂血症动物模型的比较[J].卫生研究,2002,31(2): 97-99.
[5] Yang L,Fan B,Yang K,et al.A simple and sensitive method for lipoprotein and lipids profiles analysis of individual micro-liter scale serum samples [J]. Chemistry and Physics of Lipids,2012,165:133-141.
[6] Yusuf S,Reddy S,Ounpuu S,et al. Global burden of cardiovascular diseases.PartⅠ.General considerations,the epidemiologic transition,risk factors,and impact of urbanization [J]. Circulation,2001,104:2746-2753.
[7] Olson RE. Discovery of the lipoproteins,their role in fat transport and their significance as risk factors [J]. J Nutr,1998,128:439S-443S.
[8] Vaisar T,Pennathur S,Green PS,et al. Shotgun proteomics implicates protease inhibition and complement activation in the antiinflammatory properties of HDL [J]. J Clin Invest,2007,117(3):746-756.
[9] Tall AR,Yvan-Charvet L,Wang N. The Failure of Torcetrapib,was it the Molecule or the Mechanism?[J].Arteriosclerosis Thrombosis and Vascular Biology,2007,27:257-260.
[10] Florentin M,Liberopoulos EN,Mikhailidis DP,et al.Emerging options in the treatment of dyslipidemias:a bright future? [J]. Expert Opin Emerg Drugs,2011,16:247-270.
[11] Rochfort S. Metabolomics review:a new “omies” platform technology for systems biology and implications for natural products research [J]. J Nat Prod,2005,68:1813-1820.
[12] Griffin JL. Metabonomics:NMR spectroscopy and pattern recognition analysis of body fluids and tissues for characterization of xenobiotic toxicity and disease diagnosis [J].Curr Opin Chem Biol,2003,7:648-654.
[13] Ueland PM,Holm PI,Hustad S. Betaine:a key modulator of one-carbon metabolism and homocysteine status [J].Clin Chem Lab Med,2005,43:1069-1075.
[14] Willker W,Leibfritz D. Assignment of mono-and polyunsaturated fatty acids in lipids of tissues and body fluids[J].Magn Reson Chem,1998,36:S79-S84.
[15] Kuksis A,Roberts A,Thompson JS,et al. Plasma phosphatidylcholine/free cholesterol ratio as an indicator for atherosclerosis [J]. Arteriosclerosis Thrombosis and Vascular Biology,1983,3:389-397.

