胸部肿瘤调强放疗后动态心电图异常的研究
陈晓婕 覃晓波 张 琴 杨苏萍 吴 洁
广西壮族自治区人民医院心电诊断科,广西南宁 530021
放射治疗是胸部肿瘤患者综合治疗的重要组成部分,由于解剖位置的特殊性,胸部肿瘤放疗时,心脏不可避免受到照射, 容易引起放射性心脏损伤(radia tion-induced heart damage,RIHD),而急性RIHD 以心电图异常最为常见[1],胸部肿瘤患者常规放射治疗后出现心电图异常的报道较多[2-3]。 调强放射治疗(intensity modulated radiation therapy,IMRT)是现代放疗技术的主流方向,作为三维适形放射治疗的高级模式,其目的是最大限度提高靶区剂量的同时减少正常组织受量[4],IMRT 后是否出现动态心电图(dynamic electrocardiogram,DCG)改变却鲜有报道,因此本研究通过分析不同时间段、 不同类型肿瘤、 不同治疗方法IMRT 前后DCG 异常例数,评估IMRT 对胸部肿瘤患者DCG 的影响, 以期为减少RIHD 的发生及合理制定放射治疗计划提供参考依据。
1 资料与方法
1.1 一般资料
研究对象为2008 年5 月~2013 年8 月在广西壮族自治区人民医院(以下简称“我院”)临床肿瘤中心住院的胸部肿瘤患者126 例,其中男69例,女57 例,年龄20~85 岁,平均(53.25±15.89)岁,所有患者均经手术或穿刺病理学检查证实为恶性肿瘤。按照肿瘤类型分为左肺癌组43 例, 左乳癌组39 例, 食管癌组44例,三组间比较年龄、性别、治疗方法差异均无统计学意义 (P > 0.05); 按照治疗方法分为单纯放疗组36例,同步放化组46 例,序贯放化组44 例,三组间比较年龄、 性别、 肿瘤类型差异均无统计学意义 (P >0.05)。 本研究得到患者本人知情同意和医院伦理委员会批准,并签署知情同意书。
1.2 方法
患者入院均行胸部CT 平扫加增强扫描检查,按照AJCC Sixth Eition 2002 分期标准给予胸部肿瘤分期,然后按照NCCN 指南不同分期不同类型肿瘤分别接受单纯放疗或同步放化疗或序贯放疗。
1.2.1 单纯放疗方案 放疗给予IMRT。 患者放疗前经西门子螺旋CT(sensation open)全胸部4 mm 层厚连续扫描定位,行图像重建。采用Synergy 型直线加速器及CMS 放射治疗计划系统(XIO)进行计划设计与治疗,按照ICRU50 号和62 号报告规定进行靶区勾画,肿瘤体积(GTV)为临床和影像检查所能确定的肿瘤范围,包括原发肿瘤(GTV-P)和局部淋巴结(GTV-N,在定位CT 下大于或等于10 mm 判断为阳性淋巴结)。GTV-P 在肿瘤窗勾画,GTV-N 在纵膈窗勾画。临床靶体积(CTV)为GTV 外放5~8 mm(原发灶鳞癌GTV 外放6 mm,腺癌GTV 外放8 mm 以及纵膈转移淋巴结GTV 外放5 mm)。 计划靶体积(PTV)根据摆位误差和患者呼吸动度决定。 放疗剂量50~60 Gy。
1.2.2 同步放化方案 放疗同单纯放疗方案,放疗的第1 天同步给予化疗(化疗方案一般为紫杉醇+铂类或多西他赛+铂类,21 d 为1 个周期)。 放疗期间完成2 个周期的同步化疗。
1.2.3 序贯放化方案 先给予化疗 (方案多为紫杉醇+铂类或多西他赛+铂类,21 d 为1 个周期),4 个周期后再接受IMRT。
1.3 DCG 检查
采用美国世纪3000 十二导同步全息24 h DCG记录仪,分别于治疗前、治疗结束时、治疗结束半年后进行DCG 监测,DCG 诊断标准为黄宛主编的《临床心电图学》第6 版。
1.4 统计学方法
采用统计软件SPSS 15.0 对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用方差分析,行t 检验。计数资料以率表示,采用χ2检验。以P< 0.05 为差异有统计学意义。
2 结果
2.1 胸部肿瘤治疗前、后、治疗结束半年后DCG 异常发生率比较
三组间比较偶发房(室)性心律失常、ST-T 改变差异有统计学意义(P < 0.05),两两比较治疗后组较治疗前组偶发房(室)性心律失常、ST-T 改变发生率明显增加,差异有统计学意义(χ2=6.21,P=0.013;χ2=15.14,P=0.000), 而治疗前组与治疗结束半年后偶发房(室)性心律失常、ST-T 改变均差异无统计学意义(P > 0.05)。 见表1。
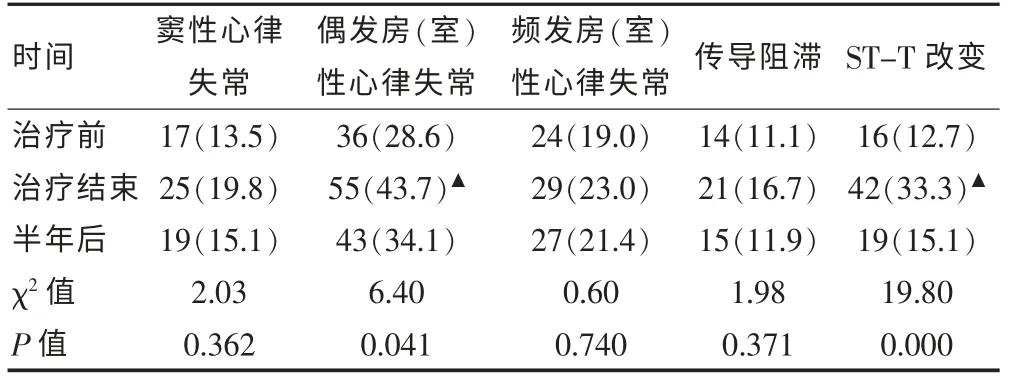
表1 胸部肿瘤治疗前、后、半年后DCG 异常发生率[n(%),n=126]
2.2 胸部肿瘤治疗前后三种类型肿瘤患者DCG 异常发生例数比较
将三组患者治疗前DCG 各项指标比较均差异无统计学意义(P > 0.05),治疗后各项指标比较差异亦无统计学意义(P > 0.05)。 见表2。

表2 胸部肿瘤治疗前后三种类型肿瘤患者DCG 异常发生例数比较(例)
2.3 胸部肿瘤治疗前后三种疗法患者DCG 异常发生例数比较
将三组患者治疗前DCG 各项指标比较差异均无统计学意义(P > 0.05),治疗后各项指标比较差异亦无统计学意义(P > 0.05),见表3。

表3 胸部肿瘤治疗前后三种疗法患者异常发生例数比较(例)
3 讨论
心电图是早期发现心脏传导系统异常和心肌缺血的敏感方法之一,因此急性RIHD 以心电图异常最为常见。 RIHD 发生机制是心脏心肌细胞对放射线耐受最强,而微循环系统较弱,因此放射线首先引起心脏毛细血管内皮细胞和冠状动脉内皮细胞发生损伤、坏死,毛细血管发生破裂和阻塞,导致微循环障碍造成心肌缺血,最终形成心肌纤维化,心脏功能受损[5];其次放射线损伤局部纤溶活性, 纤维蛋白降解受阻,膜通透性增大,导致细胞内环境改变,进而诱导细胞水肿,线粒体肿胀,膜损伤引起离子泵异常,使细胞内钙离子超载,因而导致心肌损伤。Giraud 等[2]研究表明放疗引起的心电图异常多在2 个月内出现,放疗结束半年后,70%的心电图异常可恢复正常。 梅审之等[6]对接受放疗的86 例胸部肿瘤患者进行常规心电图监测, 发现放疗结束后5 个月左右,74%的心电图异常可恢复正常,其可能原因是:因放疗而引发的RIHD,在受照组织细胞“潜在致死损伤”得已修复后,仍可保持其原有的生物特性功能。本研究显示胸部肿瘤患者偶发房(室)性早搏、ST-T 改变在治疗后较治疗前明显增加,差异有统计学意义(P < 0.05),两者在治疗前与治疗结束半年后比较, 差异无统计学意义 (P >0.05),说明IMRT 可在治疗早期引起DCG 改变,以偶发房(室)性心律失常、ST-T 改变为主,与本课题的前期研究结果相一致[7],但治疗结束半年后DCG 改变可基本恢复正常, 提示IMRT 引起的DCG 改变是可逆性的,其对心脏损伤程度相对较轻,与已有研究结果相一致。
本研究将胸部肿瘤患者分为左肺癌,左乳癌和食管癌三组, 将三组患者治疗前DCG 各项指标比较均无统计学差异(P > 0.05),治疗后各项指标比较亦无统计学差异(P > 0.05),提示不同类型胸部肿瘤患者接受IMRT 后,引起DCG 改变相似,其可能原因是:多数学者认为心脏属于“串并联”器官,心脏损伤与受照剂量-体积有关[8-10],IMRT 作为一种精确的放射治疗,在使肿瘤靶区接受最大剂量照射的同时,靶区周围的正常组织受量减少,应用于胸部肿瘤治疗后降低了心脏受照体积及剂量,因此左肺癌、左乳癌、食管癌虽然照射部位有所不同,但通过严格制定的IMRT 方案,使三组胸部肿瘤心脏受量相当,且多在阈值范围内,故心脏损伤程度相似,所以DCG 改变相似。
紫杉类化疗药作为目前唯一具有独特抗微管作用的抗癌新药,与铂类联合起协作增效作用。 Trimble等[11]对1000 例使用紫杉醇患者进行研究,发现心脏毒性发生率14%,多为无症状的心动过缓,少数为室性心律失常和传导阻滞;国内报道[12]紫杉醇心脏毒性作用比较少见,心律失常发生率为2.7%,主要表现为无症状性心动过缓,多数发生于用药期间。 本研究将治疗方法分为单纯放疗、同步放化、序贯放化三组,进行治疗后三组患者新增DCG 异常发生率比较, 发现三组间DCG 各项指标比较均无统计学差异 (P >0.05),提示单纯放疗及放化结合治疗对DCG 影响相似,说明本研究采用紫杉醇+铂类或多西他赛+铂类化疗方案对DCG 影响较小,其心脏毒性相对较低,是较为安全的一线抗癌药物[13]。
胸部肿瘤患者IMRT 后DCG 多在治疗早期出现异常改变,是可逆性的,其对心脏损伤程度较轻[14];不同类型胸部肿瘤, 由于IMRT 的精确性, 其放疗后DCG 异常改变相似; 紫杉类+铂类化疗方案对DCG影响较小,其心脏毒性相对较低,是较为安全的抗癌一线药物。
[1] 王军,王稀,刘青,等.三维放疗急性放射性心脏损伤类型及影响因素分析[J].中华放射肿瘤学杂志,2013,22(3):213-216.
[2] Giraud P,Cosset JM. Radiation toxicity to the heart:physiopathology and clinical data[J].Bull Cancer,2004,91(2):147-153.
[3] Emami B,Lyman J,Brown A,et al.Tolerance of normal tissue to therapeutic irradiation[J].J Radiat Oncol Boil Phys,2009,3(7):1195-1199.
[4] Stewart FA,Seemann I,Hoving S,et al.Understanding Radiation-induced Cardiovascular Damage and Strategies for Intervention[J].Clinical Oncology,2013,25(10):617-624.
[5] FA Stewart.Mechanisms and dose-response relationships for radiation-induced cardiovascular disease[J]. Annals of the ICRP, 2012, 41(3-4):72-79.
[6] 梅审之,刘秋芳,谭丽,等.86 例胸部肿瘤放射治疗心电图改变[J].现代肿瘤医学,2005,13(3):410-411.
[7] 杨苏萍,张琴,蒿艳蓉,等.胸部肿瘤放化疗致心电学指标改变的研究[J].重庆医学,2012,41(3):233-237.
[8] Adams M,Lipshultz SE,Schwartz C,et al. Radiation associated cardiovascular disease:Manifestatons and management [J]. Sem in Radiat Oncol,2003,13(3):346-356.
[9] Lauren MT,Joshua EM,Erin McSpadden,et al.Women at increased risk for cardiac toxicity following chemoradiation therapy for esophageal carcinoma[J].Practical Radiation Oncology,2013,3(4):149-155.
[10] Stewart FA,Seemann I,Hoving S,et al.Understanding Radiation- induced Cardiovascular Damage and Strategies for Intervention[J].Clinical Oncology,2013,25(10):617-624.
[11] Trimble EL,Adams JD,Vena D,et al. Paclitaxel for platinum refractory ovarian cancer:results from the first 1,000 patients registered to National Cancer Institute Treatment Referral Center 9103[J].J Clin Oncol,1993,11(12):2405.
[12] 杨兴艳,薛月珍.紫杉醇心脏毒性研究进展[J].医药导报,2009,28(8):1064-1067.
[13] 朱琳琳,陈绍良,张娟,等.雷帕霉素和紫杉醇对骨髓内皮祖细胞数量及功能的影响[J].中国临床医学,2012,19(5):459-461.
[14] 田雅文,余德美,刘政,等.无痛纤支镜治疗空洞型肺结核的临床护理[J].西部中医药,2012,25(10):112-114.

