α 干扰素增强骨肉瘤细胞对依托泊苷敏感性的实验研究
黄秀芳 原向伟
1.广东省江门市中心医院病理科,广东江门 529030;2.广东省江门市中心医院骨科,广东江门 529030
骨肉瘤高发于青少年人群,居于人类骨骼系统恶性肿瘤发病率第1 位,其恶性程度高,发展快,许多患者在发现时已存在肺转移,因此疗效不佳。 目前主要治疗方法包括新辅助化疗+外科手术包括保肢或截肢手术,但能否手术及保证手术效果的重要前提是化疗有效。临床上相当患者因为化疗耐药或毒副作用大等问题,引起化疗失败,导致患者无法行保肢手术从而截肢,甚至无法手术而导致死亡[1]。 因此,提高化疗疗效对于骨肉瘤的治疗来讲具有重大意义。IFN-α 属于Ⅰ型干扰素,具有调节免疫、抗病毒、抗肿瘤等多种生物学作用[2],IFN-α 可直接抑制耐药骨肉瘤细胞的生长[3],然而其对骨肉瘤化疗敏感性的影响目前尚不清楚。因此笔者联合使用IFN-α 与依托泊苷(Etoposide)处理人骨肉瘤U2OS 和MG63 细胞,探讨其对两种细胞生长抑制和凋亡的影响,并研究其分子机制,以期为提高骨肉瘤对化疗药物敏感性提供依据。
1 材料与方法
1.1 细胞培养
人骨肉瘤细胞U2OS(p53 基因野生型)和MG63(p53 基因突变型)购自中山大学病理教研室,培养液为DMEM(GIBCO 产品),其中含10%胎牛血清(GIBCO 产品)、100 U/mL 青霉素和100 μg/mL 链霉素,培养于37℃的5%CO2培养箱(Forma,美国)。
1.2 药物处理
IFN-α 购自Peprotech 公司, 批号300-02A,Etoposide 购自Sigma 公司, 批号E1383, 稀释分装冻存-20℃, 使用时采用DMEM 培养液稀释成工作浓度,处理分为四组:对照组(加入与等量于其余组的DMEM 培养液)、IFN-α (加入含工作浓度药物的DMEM 培养液使终浓度为5000 U/mL) 组,Etoposide(终浓 度 在U2OS 细 胞 为2.5 μg/mL、MG63 细 胞 为0.625 μg/mL)组和IFN-α+Etoposide(终浓度同上)组。
1.3 流式细胞术检测
细胞经处理后, 消化离心, 收集细胞;PBS 洗两次,离心;70%乙醇固定过夜;细胞经10 μmol/L 的碘化丙啶(PI)染色5 min,4℃避光30 min;上FCM 流式细胞仪(BD,美国)用488 nm 激发光检测细胞DNA含量,LYSIS 软件分析凋亡率。
1.4 DNA Ladder 检测
细胞经各处理后,消化离心,收集细胞;PBS 洗两次;加入0.8 mL 的DNAzol(Invitrogen 产品,批号:10503-027),室温放置数分钟;4℃离心15 min;将上清移入新EP 管, 加入0.4 mL 的无水乙醇;4℃离心10 min;弃上清,加入75%乙醇洗2 次,加入适量TE 溶解基因组DNA,在含有EB 的1.8%琼脂糖凝胶电泳(水平电泳槽为北京六一厂产品),紫外线激发,凝胶成像分析仪(Bio-Rad,美国)采集DNA 梯形条带。
1.5 Western blot
收集细胞,PBS 清洗离心,加入蛋白裂解液,定量蛋白(BCA 法),SDS-PAGE 电泳(垂直电泳仪为美国Bio-Rad 产品),然后电转至PVDF 膜(电转仪为美国Bio-Rad 产品),将膜封闭于含5%脱脂奶粉的TBST,4℃过夜; 鼠抗人p53、MDM2、Bax、Bcl-2、GAPDH 单克隆抗体和兔抗人PARP 多克隆抗体均为SantaCruz公司产品,稀释后室温封膜3 h 或4℃过夜,二抗稀释后室温封膜1 h 或4℃过夜, 暗室ECL 化学发光,胶片显影,定影。
1.6 统计学方法
采用SPSS 14.0 软件进行统计分析, 计数资料以率表示,组间比较采用q 检验。 以P < 0.05 为差异有统计学意义。
2 结果
2.1 IFN-α 在U2OS 和MG63 细胞对Etoposide 引起凋亡的影响
U2OS 和MG63 细胞经IFN-α (5000 U/mL)和etoposide(U2OS 细 胞 为2.5 μg/mL、MG6 细 胞 为0.625 μg/mL)单独或联合处理72 h 后进行流式细胞术检测凋亡率,流式细胞术结果显示,U20S 细胞在对照组、IFN-α 组、Etoposide 组和IFN-α+Etoposide 的细胞凋亡率分别为:(5.1±2.3)%、(5.7±2.7)%、(15.3±3.8)%和(45.5±5.2)%(图1A),结果表明IFN-α 单独并不诱导明显的U2OS 细胞凋亡,却明显增强了Etoposide 诱导的U2OS 细胞凋亡,Etoposide 组与IFN-α+Etoposide 比较,差异有统计学意义(P < 0.05)。然而同样处理MG63 细胞后结果显示,MG63 细胞在对照组、IFN-α 组、Etoposide 组和IFN-α+Etoposide 组的细胞凋亡率分别为:(2.2±0.8)%、(2.5±1.1)%、(23.8±4.6)%和(24.9±5.3)%(图1B),表明IFN-α 不仅单独不诱导明显的MG63 细胞凋亡, 也无增强Etoposide 诱导的MG63 细胞凋亡的作用,Etoposide 组与IFN-α+Etoposide 比较,差异无统计学意义(P > 0.05)。

图1 流式细胞术检测α 干扰素对依托泊苷诱导的U2OS 和MG63细胞凋亡的影响
2.2 IFN-α 在U2OS 和MG63 细胞中对“DNA 梯形条带”的影响
U2OS 和MG63 细胞经IFN-α (5000 U/mL)和etoposide (U2OS 细 胞 为2.5 μg/mL,MG6 细 胞 为0.625 μg/mL)单独或联合处理72 h 后进行DNA Ladder 电泳。 DNA Ladder 是凋亡的特征性表现,结果显示, 与其他各组相比,IFN-α/Etoposide 组的U20S 细胞出现明显的梯形条带(图2A);而在MG63 细胞,各组均未出现明显梯形条带(图2B)。 表明IFN-α 可明显增强Etoposide 诱导的骨肉瘤细胞凋亡, 并且这种效应仅出现在p53 功能正常的U2OS 细胞中,而在因突变导致p53 功能丧失的MG63 细胞中无此效应,提示了p53 可能参与此效应。
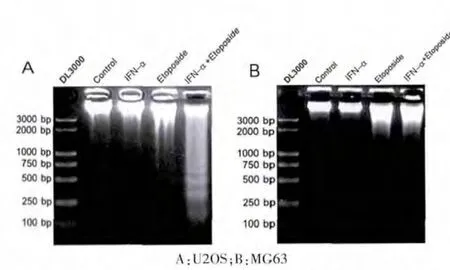
图2 DNA 梯形条带分析α 干扰素对依托泊苷诱导的U2OS 和MG63 细胞凋亡的影响
2.3 IFN-α 在U2OS 细胞中对Etoposide 引起PARP活化的影响
U2OS 细胞经IFN-α (5000 U/mL) 和etoposide(2.5 μg/mL)单独或联合处理72 h 后进行western blot检测PARP 蛋白活化。 采用Western blot 法检测凋亡关键酶PARP 的裂解,结果表明,在U2OS 细胞,对照组、IFN-α 组和Etoposide 组均未出现PARP 的活化,在联合用药组可见116 KD 的无活性PARP 前体明显裂解为85 KD 的活化片段(图3)。提示联合用药明显增强PARP 活化,从而触发U2OS 细胞凋亡。

图3 α 干扰素在U2OS 细胞中增强依托泊苷诱导的PARP 裂解活化(Western blot 法)
2.4 IFN-α 对Etoposide 活化p53 凋亡通路的影响
为进一步验证IFN-α 对Etoposide 的增敏作用与野生型p53 的功能有关,笔者进一步检测了p53 凋亡通路相关基因p53、Bax、Bcl-2、Mdm2 等的表达。如图4所示, 在U2OS 细胞中,IFN-α 单独对p53 及其靶基因MDM2 的表达无明显影响, 而Etoposide 可明显增强二者的表达, 联合用药则进一步增高二者的表达。Bax 和Bcl-2 均是p53 的下游调控基因, 促凋亡的Bax 的表达被Etoposide 增高, 并被IFN-α+Etoposide进一步增强;与对照组相比,抗凋亡的Bcl-2 的表达虽然在Etoposide 组无变化,却被联合用药明显减弱。因此p53、Bax、MDM2 和Bcl-2 的表达变化与凋亡保持同步, 提示了在IFN-α 通过激活p53 凋亡通路增强Etoposide 诱导U2OS 细胞凋亡。 然而在MG63 细胞中,上述基因的蛋白表达均无明显变化,与MG63细胞中的阴性结果相符合。

图4 IFN-α 在U2OS、MG63 细胞中对Etoposide 诱导p53,Bax,Mdm2 和Bcl-2 表达的影响(Western blot 法)
3 讨论
干扰素是一类多功能细胞因子, 具有抗病毒、抗肿瘤和免疫调节等多种生物学作用[1],包括Ⅰ型和Ⅱ型, 其中IFN-α 属于Ⅰ型干扰素, 可与细胞表面的IFN-α/β 受体结合, 从而引起JAK1 和TYK 的活化,活化的JAK1 和TYK 可分别使STAT1 发生和酪氨酸位点(Tyr701)和丝氨酸位点(Ser727)的磷酸化,磷酸化的STAT1 蛋白形成同源或异源二聚体, 进入细胞核与其靶基因启动子上的干扰素刺激反应元件或者γ 活化序列结合,进而调控下游基因表达[4]。 IFN-α 也是临床治疗肿瘤的第一种细胞因子, 已用于膀胱癌、肾癌、肝癌、白血病的临床治疗[5]。
以依托泊苷、阿霉素、顺铂等DNA 损伤性药物为代表的传统化疗药物已广泛用于人类骨肉瘤的新辅助化疗,并获得一定疗效,但因其无肿瘤靶向特异性,常常在杀灭肿瘤细胞的同时也破坏正常组织细胞,从而带来严重的毒副作用,最终导致化疗的失败并影响骨肉瘤的最终疗效[6-7]。 有研究表明IFN-α 本身即可抑制多药耐药的骨肉瘤细胞生长[3],那么IFN-α 联合化疗药物对骨肉瘤细胞的生长是否存在协同作用,笔者对此进行了一系列研究。
CAD(caspase activated DNAase)是细胞中一种能切割染色质的核酸酶, 可被caspase-3 激活,CAD 可识别DNA 序列中的特定位点,将细胞基因组DNA在核小体单位之间的连接处剪断,从而形成180~200 bp或其整数倍大小的寡核苷酸片段, 经琼脂糖凝胶电泳会出现梯形电泳条带,是凋亡的特征性表现,因而成为鉴定凋亡的经典指标[8]。 笔者从流式细胞术和形态学两方面证明IFN-α 对U2OS 细胞无明显影响,却明显增强Etoposide 诱导凋亡, 提示二者联用比化疗药物单用具有更好的抗癌作用。 并且,在U2OS 细胞中,联合用药可明显增强PARP[poly(ADP-ribose)polymerase]的活化。实际上,PARP 是反映凋亡的经典指标,受到促凋亡信号的刺激后,细胞内蛋白酶Caspases 家族成员caspase 8、9 被激活, 继而激活下游效应性caspase 3,最终裂解其底物PARP 发生活化,最终导致细胞凋亡[9]。 上述变化在p53 基因突变而丧失功能的MG63 细胞中却没有发生,这提示此效应可能与p53 有关。 p53 是一个经典的抑癌基因,在超过50%的恶性肿瘤包括骨肉瘤中都存在缺失或突变, 与肿瘤的发生发展关系密切[10], 作为凋亡调控的主要靶点, 激活的p53 可通过调节其下游基因如MDM2,Bax、Bcl-2 等的转录和表达,诱导细胞走向凋亡[10]。 目前,p53 已被认为是众多化疗药物(包括Etoposide)抗癌作用的主要介导者[7]。 不仅如此,最近研究表明,p53 也参与了IFN-α 引发的信号通路[11]。 笔者发现,Etoposide 激活了p53 及其下游基因如MDM2、Bax 等的表达。 IFN-α 虽然单独应用对p53 通路无明显影响, 却明显增强Etoposide 引起的p53、Bax 和MDM2的表达,同时减弱了Bcl-2 的表达,充分说明IFN-α通过激活p53 依赖性信号通路增强Etoposide 诱导的U2OS 细胞凋亡。
MDM2 基因是调节p53 的一个重要因子, 它在细胞核中直接与p53 结合,抑制其转录活性,并通过胞核-胞浆穿梭将p53 转运至胞浆并使其降解,从而降低p53 水平;另一方面,p53 的上调可激活MDM2转录表达,来反馈性抑制p53 蛋白的继续增高。如此二者形成一个负反馈调节环, 使细胞内MDM2/p53比率保持恒定[12]。 本研究发现联合用药引起的p53上调伴随着MDM2 水平的升高,表明p53 的上调反馈性地激活了MDM2 的表达,使其水平升高。Bax 和Bcl-2 基因同属Bcl-2 家族, 均为p53 的靶基因,表达于线粒体,是调控细胞凋亡的重要基因[13]。二者功能相互拮抗,Bax 具有促进凋亡的作用,Bcl-2 则具有抗凋亡的作用, 二者的比例决定了细胞是否走向凋亡[14-16]。 而联合用药通过激活p53 上调Bax 和下调Bcl-2,使Bax/Bcl-2 比例增高,从而促使细胞发生凋亡。
因此,IFN-α 可通过诱导p53 依赖性凋亡来增强骨肉瘤U2OS 细胞对依托泊苷的敏感性,提示IFN-α与骨肉瘤传统化疗药物联合应用可望成为提高骨肉瘤化疗疗效的新方向。
[1] De Saint SN,Fletcher CD.Soft-tissue sarcomas:a update[J].Eur J Surg Oncol,1999,25(2):215-220.
[2] Prejean C,Colamonici OR.Role of the cytoplasmic domains of the type I interferon receptor subunits in signaling [J].Semin Cancer Biol,2000,10(2):83-92.
[3] Manara MC,Serra M,Benini S,et al. Effectiveness of Type I interferons in the treatment of multidrug resistant osteosarcoma cells [J]. Int J Oncol,2004,24(2):365-372.
[4] Stark GR,Kerr IM,Williams BR,et al. How cells respond to interferons[J].Annu Rev Biochem,1998,67(3):227-264.
[5] 郭子文,许晓军.干扰素辅助小剂量HA 方案治疗慢性粒细胞白血病29 例疗效观察[J].中国医药导报,2012,9(3):37-38.
[6] Bruland OS,Pihl A.On the current management of osteosarcoma. A critical evaluation and a proposal for a modified treatment strategy [J]. Eur J Cancer,1997,33(11):1725-1731.
[7] Hande KR. Etoposide:four decades of development of a topoisomerase II inhibitor [J]. Eur J Cancer,1998,34(10):1514-1521.
[8] Gavrieli Y,Sherman Y,Ben S.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation [J]. J Cell Biol,1992,119(3):493-501.
[9] Smulson ME,Simbulan-Rosenthal CM,Boulares AH,et al.Roles of poly(ADP-ribosyl)ation and PARP in apoptosis,DNA repair, genomic stability and functions of p53 and E2F-1 [J]. Adv Enzyme Regul,2000,40(2):183-215.
[10] 何均辉,邹秀玲,李忠楚,等.p53 蛋白在胃癌中的表达分析[J].中国医药导报,2012,9(5):86-88.
[11] Porta C,Hadj SR,Nejmeddine M,et al.Interferons alphaand gamma induce p53-dependent and p53-independent apoptosis, respectively [J]. Oncogene,2005,24(4):605-615.
[12] Moll UM,Petrenko O. The MDM2-p53 interaction[J]. Mol Cancer Res,2003,1(14):1001-1008.
[13] Bond J,Haughton M,Blaydes J,et al. Evidence that transcriptional activation by p53 plays a direct role in the induction of cellular senescence[J].Oncogene,1996,13(10):2097-2104.
[14] Cory S,Adams JM.The Bcl2 family: regulators of the cellular life-or-death switch[J].Nat Rev Cancer,2002,2(9):647-656.
[15] 黄凤,毛丽松,张佳.Bcl-2、IGF-2 蛋白在子宫肌瘤组织中的表达及其相关性研究[J].中国现代医生,2013,51(13):13-14.
[16] 王婷,马云.Bcl-2 在三阴性乳腺癌中的预后价值[J].中国现代医生,2012,50(29):44-46.

