酶解法提取罗非鱼血液中血红素的工艺条件优化
岑剑伟,李来好,杨贤庆,刘在军,2,郝淑贤,周婉君,魏 涯
酶解法提取罗非鱼血液中血红素的工艺条件优化
岑剑伟1,李来好1,杨贤庆1,刘在军1,2,郝淑贤1,周婉君1,魏 涯1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,
国家水产品加工技术研发中心,广东 广州 510300;2.上海海洋大学食品学院,上海 201306)
为更加科学有效地利用丰富的罗非鱼血液资源,研究酶解法提取罗非鱼血液中血红素的工艺条件,通过单因素试验和正交试验确定了复合酶提取血红素的最佳酶解条件为:温度40 ℃、pH 8.0、底物质量浓度6 g/100 mL、酶添加量8 000 U/g、酶解时间2 h。再经过热处理、酸沉淀和真空冷冻干燥等纯化工艺后得血红素终产品。在此条件下,血红素提取率达到80.9%,产品纯度为28.2%。该工艺简单可行,生产成本低,适合工业化生产,不仅能有效地减少环境污染,还能显著地增加企业产品的附加值。
罗非鱼血;血红素;酶解;提取
中国是世界上最大的罗非鱼养殖生产国家,罗非鱼加工厂每年向环境中排放的罗非鱼血达1.2×104t[1],造成宝贵资源的巨大浪费和严重的环境污染,若能进行科学有效的利用,则具有广泛的开发应用前景。血红蛋白是罗非鱼血液中含量最高的一类蛋白(约占血液总蛋白的80%),它由血红素与珠蛋白结合成四聚体(两条α链和两条β链)的形式存在,相对分子质量约为65 000,其中珠蛋白约占96%,血红素占4%[2]。
血红素是由1 个原卟啉环中镶嵌1 个亚铁离子(Fe2+)构成的化合物,分子式为C34H32FeN4O4,相对分子质量为616.487 3。血红素参与机体的多项代谢活动,有着重要的生理功能[3],因此,它在食品、医药和化工等领域得到了较广泛的应用:如作为生物补铁剂或营养强化剂添加到糖果、面食、饮料和酱油等食品中,能够在不影响食品原有色、香、味的同时有效地起到补铁的作用[3-5];在制药行业中,血红素是半合成法制备胆红素的前体,而胆红素既是配制人工牛黄的重要原料,又是制备抗癌特效药-血卟啉衍生物的主要原料[6]等。
目前对于血红蛋白的利用主要是采用冰醋酸法、鞣酸提取法、酸性丙酮法等从中制取血红素,不仅所得产品安全性低、不利于环保,而且造成了蛋白资源的巨大浪费。采用酶解法处理血红蛋白具有反应条件温和可控、作用位点具有选择性、不使用有毒有害试剂、产品安全性高等优点。血红蛋白经蛋白酶处理,去除不需要的肽链,保留维持血红素铁稳定的肽链,可以在一定程度上克服单体血红素的不足。已有研究[7-8]对酶化猪血血红素制品分别进行动物实验和人体验证实验,结果表明酶化猪血血红素制品对防治缺铁性贫血效果显著。同时水解产生大量活性多肽,能够有效增强水解产物的功能特性和应用范围。研究表明,血红蛋白肽具有更容易吸收、调节胃肠运动、提高免疫力、促进氨基酸吸收、加速蛋白质合成、降低血脂和血压和抗氧化等生理功能[9]。
因此,本实验采用酶解法处理血红蛋白,对酶种类、酶添加量、底物质量浓度、酶解时间等酶解工艺条件进行研究,旨在为今后合理开发利用罗非鱼血液资源提供一条新途径,具有很重要的理论研究价值和实践意义。
1 材料与方法
1.1 材料与试剂
罗非鱼(鲜活,约500 g/尾)购自广州华润万家超市新港西路店。
碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、复合蛋白酶、胰蛋白酶、胃蛋白酶 广州齐云生物技术有限公司;血红素标准品 美国Sigma公司;氢氧化钠、甲醛、冰醋酸、磷酸盐(均为分析纯) 广州化学试剂厂。
1.2 仪器与设备
UV-2450/2550型紫外-可见分光光度计 日本岛津公司;全自动电位滴定仪 瑞士万通(Metrohm)公司;Kjeltec 8400全自动凯氏定氮仪 瑞典FOSS公司;ALPHA 1-4 LSC 冷冻干燥机 德国Christ公司;PB-10 pH计 德国Sartorius公司;GB204电子天平 瑞士Mettler公司。
1.3 方法
1.3.1 血红蛋白制备
抗凝处理:按血液与抗凝剂3∶1(体积比)的比例用质量分数3%柠檬酸三钠溶液将采集到的新鲜罗非鱼血液作抗凝血处理,3 000×g离心10 min。
收集红细胞:加入两倍体积生理盐水洗涤红细胞,然后3 000×g离心10 min,收集红细胞,重复2~3 次此步骤即可得洁净红细胞。
超声破碎:将洁净红细胞采用不同的超声功率和时间进行超声波辅助细胞破膜处理,5 000×g离心15 min,收集上层红细胞液,红细胞液作为血红蛋白原料进行酶解实验。
1.3.2 指标检测
1.3.2.1 血红蛋白含量测定
血红蛋白为血红细胞液中的主要蛋白,所以测定血红细胞液的蛋白质含量即为血红蛋白的含量。血红细胞液中的蛋白含量用凯氏定氮法测定[10]。
1.3.2.2 血红素含量测定
紫外-可见分光光度法[11]。精确称取经105 ℃干燥至恒质量的血红素标准品(16.0±0.1) mg,用0.1 mol/L氢氧化钠溶液溶解并定容至100 mL,得标准液。然后分别量取血红素标准液1.0、2.0、4.0、6.0、8.0、10.0 mL,用0.1 mol/L氢氧化钠溶液定容于100 mL容量瓶,摇匀待用。然后以0.1 mol/L氢氧化钠溶液为空白,在特征波长处测定其吸光度,绘制标准曲线。将样品质量浓度调整到标曲线性范围内即可测定其含量。
提取率与纯度按公式(1)、(2)计算:

1.3.2.3 水解度(degree of hydrolysis,DH)测定[12]根据公式(3)计算:

式中:AN为氨基态氮含量/g;TN为总氮含量/g。
采用甲醛电位滴定法测定AN:具体操作步骤参见电位滴定仪操作手册;采用凯氏定氮法测定TN[10]:参考GB 5009.5—2010《食品中蛋白质的测定》。
1.3.3 酶解工艺条件研究
影响蛋白质酶解的因素很多,诸如酶的选择及用量、底物质量浓度、酶解时间、反应温度、pH值、是否存在酶抑制剂等[13],应根据水解产物的应用目的来选择适宜的蛋白酶、制定酶解工艺参数[14-15]。
1.3.3.1 酶种类的选择
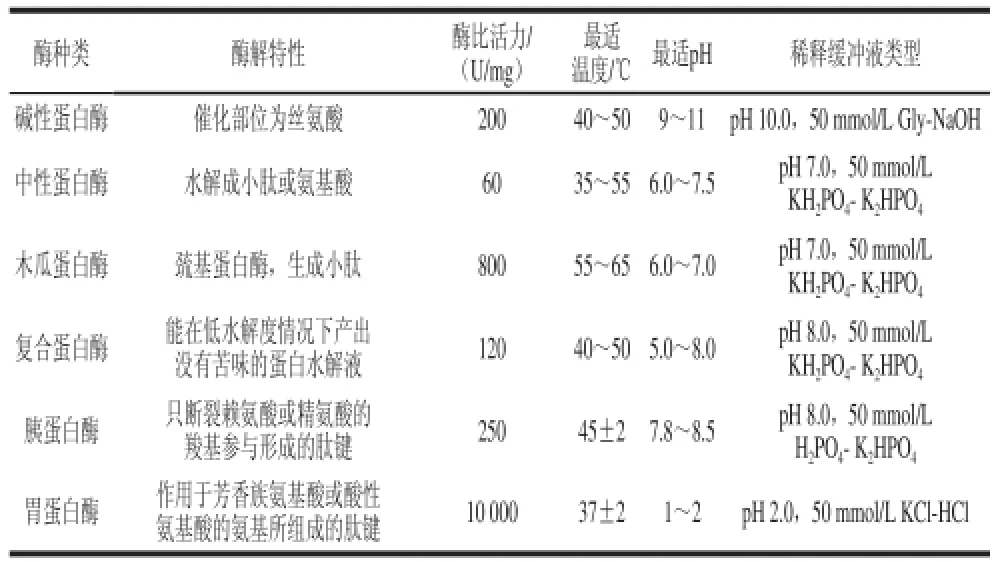
表1 6 种酶相关工艺参数Table 1 Reaction parameters for six proteases
综合文献[16-18]报道,选择表1中6 种酶为实验对象,相关参数见表1。用各种酶对应的最适pH值缓冲液分别配制20 mL含血红蛋白2 g/100 mL的血样,然后按6 000 U/g蛋白的酶添加量加入到血样中,以不加酶为空白对照,在其最适温度条件下恒温搅拌水解2 h。加热煮沸15 min灭酶,测定各样品的DH,离心(3 000×g,10 min),在385 nm波长处测吸光度,与标准曲线换算得到上层液中血红素含量,根据对照实验结果从中选取酶解效果最优的酶类。
1.3.3.2 底物质量浓度对水解反应的影响
用pH 8.0的磷酸盐缓冲溶液分别配制20 mL血红蛋白2、4、6、8、10 g/100 mL的血样,按6 000 U/g的酶添加量分别加入复合蛋白酶,以不加酶为空白对照,在40 ℃条件下恒温搅拌水解2 h,按上述方法得到各样品DH和血红素提取率。
1.3.3.3 酶添加量对水解反应的影响
向20 mL血红蛋白6 g/100mL的血样中分别按2 000、4 000、6 000、8 000、10 000、12 000U/g的酶添加量加入复合蛋白酶,以不加酶为空白对照,在pH 8.0、40 ℃条件下恒温搅拌水解2 h,按上述方法得到各样品DH和血红素提取率。
1.3.3.4 酶解时间对水解反应的影响
将复合蛋白酶按8 000 U/g的酶添加量加入到血红蛋白6 g/100mL的血样中,以不加酶为空白对照,在pH 8.0、40 ℃条件下恒温搅拌水解,每隔2 h取样,按上述方法得到各样品DH和血红素提取率。
1.3.3.5 正交试验
在单因素试验基础上,通过L9(34)正交试验对血红蛋白水解工艺条件进行优化。
1.3.4 血红素纯化
酶解结束后,将酶解液进行沸水浴处理15 min左右,迅速冷却后离心(3 000×g,10 min),去除沉淀。用冰醋酸调节酶解上清液至pH 6.0,充分搅拌后静置20 min,离心(3 000×g,10 min),收集血红素沉淀,经真空冷冻干燥得最终产品。
2 结果与分析
2.1 酶种类的选择
酶的选择是一个关键因素,它决定了水解肽键的作用位点和肽链的长度。不同的酶因作用基团的特异性水解蛋白质长肽链上不同的部位,生成不同的酶解产物,因此酶的选择决定了产物的性质(包括产物的氨基酸组成、分子质量大小及亲、疏水性等)[19-20]。
采用6 种酶酶解罗非鱼血红蛋白的效果如图1所示,其中水解度由大到小依次为碱性蛋白酶>复合蛋白酶>中性蛋白酶,其余3 类的水解效果不明显,而且碱性蛋白酶的水解能力与复合蛋白酶的水解能力无显著差异。程杰顺等[17]曾报道以猪血为原料,对各种蛋白酶水解血红蛋白的能力进行了研究,结果表明,碱性蛋白酶的水解能力最强,与本实验结果一致。从酶解后提取得到的血红素含量来看,得率较高的依次为复合蛋白酶>碱性蛋白酶>中性蛋白酶,且复合蛋白酶的血红素质量浓度明显高于碱性蛋白酶。究其原因,可能与复合蛋白酶特殊性质有关。
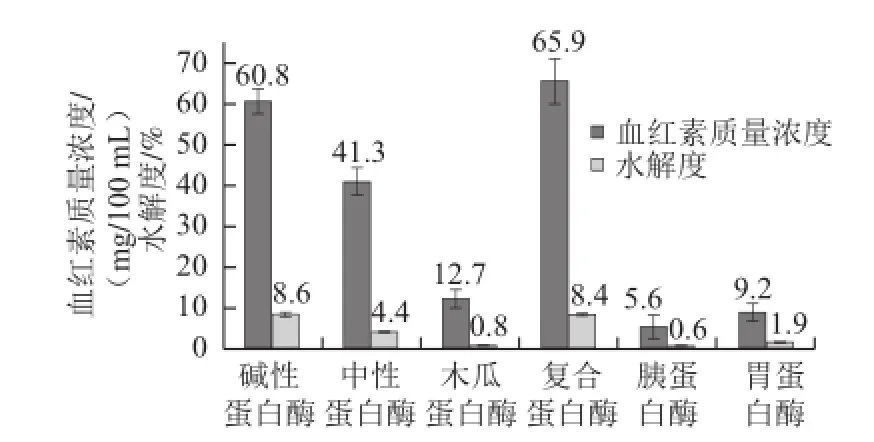
图1 6 种酶的水解效果图Fig.1 Comparison of hydrolysis efficiency of six proteases
复合酶是为水解蛋白质而研制的杆菌蛋白酶复合体,主酶是碱性蛋白酶,与许多其他内切酶不同,复合酶即使在低水解度的情况下也能产出没有苦味的蛋白水解液,适用于动物蛋白、动物血液的水解。它的水解能力与碱性蛋白酶相当,但是,复合酶中其他成分的协同作用能够促使水解更多血红蛋白,导致血红素质量浓度提高。目前虽有不少关于酶解法制备血红素工艺条件的研究,但是有关复合蛋白酶水解血红蛋白的工艺研究尚未见报道,因此,采用复合蛋白酶酶解制取血红素。
2.2 底物质量浓度对水解反应的影响
水在酶解过程中可以起到反应介质和运输载体的作用,使底物和蛋白酶均匀分布,以便两者充分接触;同时水的存在有利于酶解产物迅速分散,防止局部产物质量浓度过高而抑制酶解反应进行,所以在一定程度上底物质量浓度降低会促进酶解。但是随着水分含量的增加,有效的酶浓度降低,反应速度减慢;另一方面,过低的底物质量浓度会造成酶解产物过稀,以致在后续处理中必须进行浓缩,增加了生产工艺的复杂性和能耗。因此,研究并确定酶解反应的最适底物质量浓度显得非常重要。
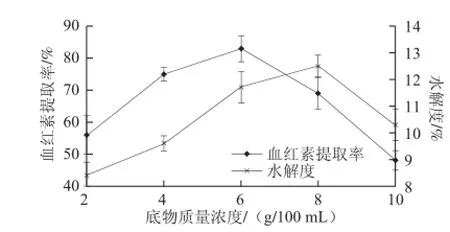
图2 底物质量浓度对水解反应的影响Fig.2 Influence of substrate concentration on hydrolysis efficiency
从图2可以看出,底物质量浓度对水解度和血红素提取率均有比较显著的影响,水解度和血红素提取率均呈现先增加后减少的规律,血红素提取率在底物质量浓度6 g/100 mL时达到最大,而水解度在底物质量浓度8 g/100 mL时达到最大,出现了血红素提取率比水解度提前达到峰值的现象。原因可能是:在2~4 g/100 mL的范围内,底物质量浓度较低,与酶结合效率不够高;在4~6 g/100 mL的范围内,底物质量浓度适宜,与酶作用充分,使得血红蛋白得到充分有效的水解;在6~8 g/100 mL范围内,由于底物质量浓度偏高,酶的扩散速率降低,导致部分血红蛋白未得到有效水解,使得血红素的提取率开始下降,而由于酶量发生局部过大效应,产生了部分无效水解,即将部分已断裂的多肽进一步水解成了更小的肽链,因此水解度继续出现了一定幅度的增加;在大于8 g/100 mL的范围内,由于底物质量浓度过高,酶的自由扩散受到严重限制,使局部产物质量浓度过高,抑制酶解反应进行,导致水解度和血红素提取率均明显下降。从实际生产考虑又希望底物质量浓度较大,因此,在底物质量浓度为6 g/100 mL左右水解效果最好。
2.3 酶添加量对水解反应的影响
酶的用量直接影响着酶解过程的效率,酶量越大,与底物作用的酶分子就越多,酶解效率提高;但当酶分子将底物饱和之后,再增加酶量对反应起不到明显的促进作用,甚至会引起酶自溶增强[21-23];同时由于酶的用量直接影响着酶解的经济成本,因此酶的用量存在一个适度值,即所谓“经济浓度”。从图3可以看出,水解度总体随酶添加量的升高而增大,当升高到8 000 U/g时,水解度变化趋势放缓,此时底物趋于被饱和,血红素提取率达到峰值。表明8 000 U/g是一个重要拐点,当酶添加量大于此值,对反应促进作用不明显,甚至产生负效应,因此8 000 U/g为较经济适用的酶添加量。
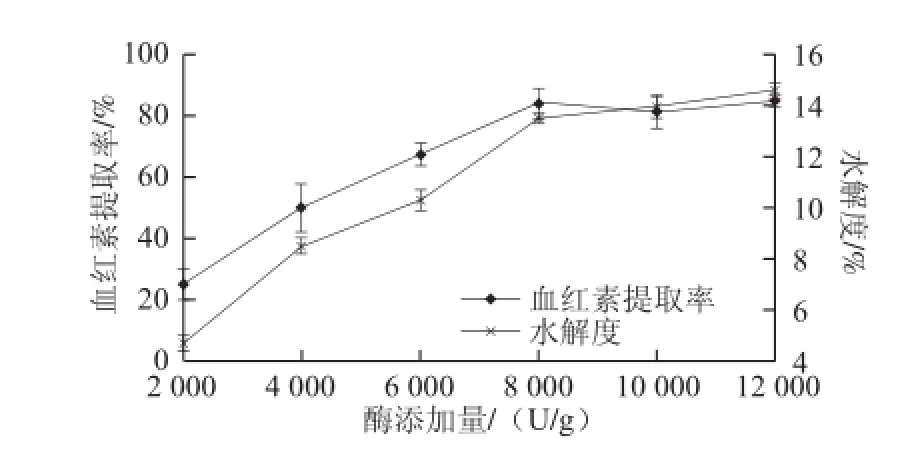
图3 酶添加量对水解反应的影响Fig.3 Influence of protamex concentration on hydrolysis efficiency
2.4 酶解时间对水解反应的影响
酶解时间和DH相关,一般地,延长酶解时间能提高产物的水解度。由于酶解产物的性质与水解度密切相关,所以可通过控制酶解时间来获得各种目标产物,因此常根据目标物的性质等来确定酶解时间。
通过对复合蛋白酶12 h内的酶解情况进行监测,得出如图4所示的结果,由图可知,水解度随时间的延长在不断地增大,但增加的幅度在逐渐减小,尤其在8 h以后,水解度增加幅度较小,此时,底物中的有效作用部位得到较充分的断裂,底物质量浓度降低,产物不断积累,部分酶失活,导致水解度增长缓慢,此时继续延长酶解时间对水解度的提高没有太大意义;血红素提取率变化不显著,说明复合蛋白酶在2 h左右就可以基本完成对血红蛋白的有效水解。
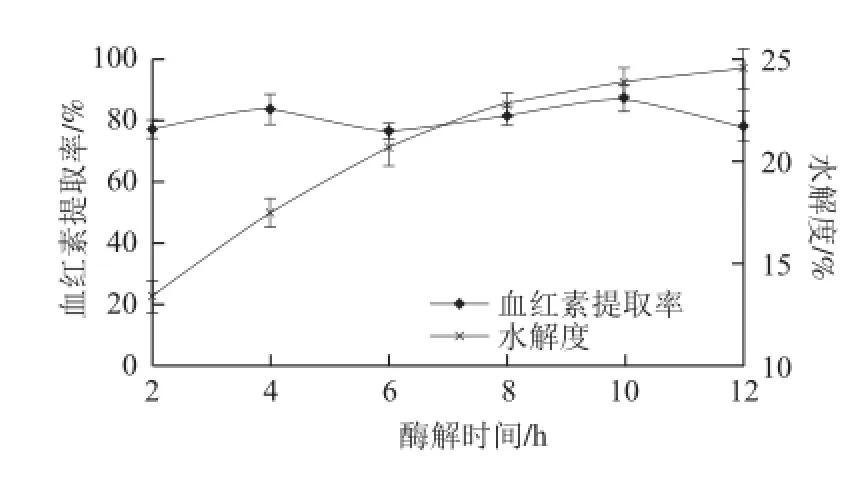
图4 酶解时间对水解反应的影响Fig.4 Influence of hydrolysis time on hydrolysis efficiency
2.5 正交试验
通过复合蛋白酶水解效果的单因素试验分析,采用L9(34)正交试验表设计试验,选取底物质量浓度(A)、酶添加量(B)、酶解时间(C)为试验因素,DH和血红素提取率为考察指标。在pH 8.0、40 ℃条件下恒温水解,试验设计及结果见表2。
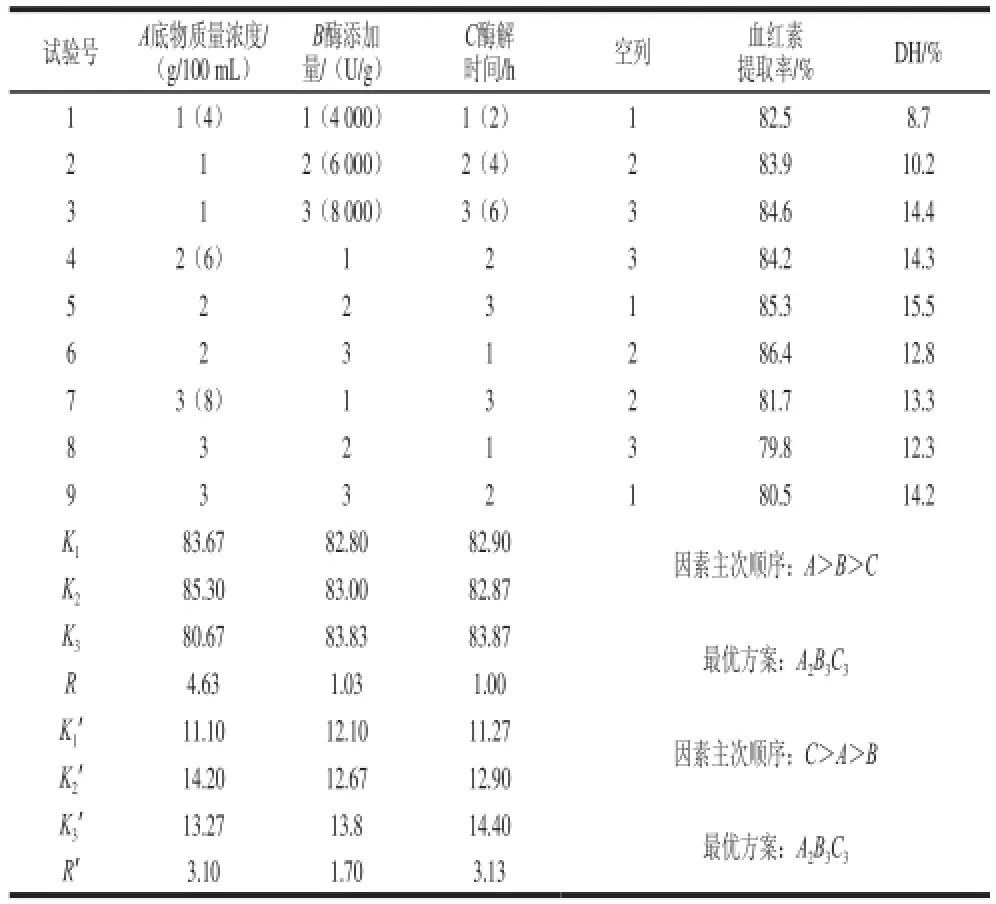
表2 正交试验设计及结果Table 2 Orthogonal array experimental design and results
根据极差分析可知,影响血红素提取率的因素主次顺序为A>B>C,底物质量浓度是最重要的影响因素,酶添加量次之,酶解时间影响最小,最佳工艺条件为A2B3C3,即底物质量浓度6 g/100mL、酶添加量8 000 U/g、酶解时间6 h;影响水解度的因素主次顺序为C>A>B,酶解时间是最主要的影响因素,底物质量浓度次之,酶添加量影响最小,最佳工艺条件也为A2B3C3,即底物质量浓度6 g/100 mL、酶添加量8 000 U/g、酶解时间6 h。但由于酶解时间对血红素提取率的影响不显著,因此,考虑到生产周期及生产成本等因素,实验提出的酶解工艺条件为底物质量浓度6 g/100 mL、酶添加量8 000 U/g、酶解时间2 h。
从复合酶酶解工艺条件研究结果来看,底物质量浓度对血红素提取效果起着关键作用,6 g/100 mL最佳,与吴保承等[24]研究报道的在中性蛋白酶作用下,从猪血中提取血红素的最佳底物质量浓度5 g/100 mL相吻合。酶添加量在4 000~8 000 U/g范围内均有效,但以8 000 U/g最有效,这与邓佳等[25]报道的最适酶添加量一致。血红素的产出和水解度对于酶解时间的依赖程度有着明显区别,原因是酶解过程中,酶能够迅速作用于底物的有效部位而得到血红素,继续水解则是对已经解断的肽链作进一步的水解,对血红素的得率没有显著性影响,可以称之为无效水解。
3 结 论
本实验研究采用酶解法从罗非鱼血液中提取血红素的工艺条件,通过单因素试验和正交试验,确定最佳的水解条件为:经复合酶水解的血红素质量浓度最高,为65.9 mg/100 mL,水解效果最佳,最适工艺条件为反应温度40 ℃、最适pH8.0、底物质量浓度6 g/100 mL、酶添加量8 000 U/g、酶解时间2 h。再经过热处理、酸沉淀及真空冷冻干燥后得终产品。在此条件下,血红素提取率达到80.9%,产品纯度为28.2%。
采用酶法水解技术不仅可以避免强酸、碱等腐蚀设备、污染环境等缺陷,而且提高了产品的安全性,增强了产品的功能特性,可以扩大产品的应用范围,是未来食品资源开发的方向,符合国家产业化发展趋势。 相关工艺条件简单可行,生产成本低,生产流程易于放大,具有较好的工业生产前景。本实验可以为酶解法制取血红素提供相关理论依据和技术参考,为有效利用罗非鱼血液资源,减少环境污染提供一条新途径。
[1] 刘在军, 岑剑伟, 李来好, 等. 罗非鱼血液综合利用的研究思路及展望[J]. 南方水产科学, 2012, 8(2): 76-80.
[2] 邓莉, 刘章武, 杜金平. 动物血提取物活性的研究与开发现状[J]. 食品科学, 2010, 31(21): 455-458.
[3] 张婷, 庄红, 薛培宇, 等. 血红素铁功能及其二价铁保护探索[J]. 肉类研究, 2008, 22(3): 18-20.
[4] 马青, 张逢秋, 张丽华, 等. 三种铁营养素添加剂的生物利用率研究[J].食品研究与开发, 2003, 24(5): 75-77.
[5] 游开绍, 吴斌, 赵子庆, 等. 氯高铁血红素与富马酸亚铁治疗小儿缺铁性贫血的疗效比较[J]. 中国新药与临床杂志, 1995, 14(4): 211-213.
[6] SAKTHITHARAN S, CHRISTINE E, ROSS W B. Advances in modern synthetic porphyrin chemistry[J]. Tetrahedron, 2000, 56(8): 1025-1046.
[7] 刘钧, 张淑伟. 活性酶血红素面包防治青少年缺铁性贫血研究[J].河南工业大学学报: 自然科学版, 2005, 26(4): 59-61.
[8] 李英娥. 酶化血红素制品防治青少年缺铁性贫血的研究[J]. 中国校医, 2005, 19(2): 172-173.
[9] 张立娟, 夏继华, 沈峰, 等. 猪血血红蛋白肽的研究进展[J]. 肉类研究, 2011, 25(6): 54-57.
[10] 卫生部. GB 5009.5—2010 食品安全国家标准食品中蛋白质的测定[S].北京: 中国标准出版社, 2010.
[11] MARIA E L, LIDIA S A, ALCIRA B, et al. A spectrophotometric method for estimating hemin in biological systems[J]. Analytical Biochemistry, 2005, 341: 199-203.
[12] MAN J I, HEE J C. Process development for heme-enriched peptide by enzymatic hydrolysis of hemoglobin[J]. Bioscience Technology, 2002, 84(1): 63-68.
[13] BELHOCINE D, MOKRANE H, GRIB H, et al. Optimization of enzymatic hydrolysis of haemoglobin in a continuous membrance bioreactor[J]. Chemical Engineering Journal, 2000, 76(3): 189-196.
[14] KILARA A. Enzyme-modified protein food ingredients[J]. Process Biochemistry, 1985, 20: 149-158.
[15] IMM J Y, LEE C M. Production of seafood flavor from red hake (Urophycis chuss) by enzymatic hydrolysis[J]. Journal of Agricultural and Food Chemistry, 1999, 47(6): 2360-2366.
[16] 瞿桂香, 董明盛, 黄耀江. 不同蛋白酶水解猪血红蛋白制备血红素的对比研究[J]. 江西农业学报, 2007, 19(7): 92-93.
[17] 程杰顺, 肖湘. 酶对猪血蛋白水解度影响的研究[J]. 农产品加工, 2011(2): 59-63.
[18] 李华, 刘通讯, 赵谋明, 等. 富血红素多肽生产初探[J]. 食品工业科技, 2007, 28(2): 154-156.
[19] MULLALLY M M, O’CALLAGHAN D M, FITZGERALD R J, et al. Proteolytic and peptidolytic activities in commercial pancreatin protease perparations and their relationship to some whey protein hydrolysate characteristics[J]. Journal of Agricultural and Food Chemistry, 1994, 42(2): 2973-2981.
[20] GAUTHIER S F, PAQUIN P, POULIOT Y, et al. Surface activity and related functional properties of peptides obtained from whey proteins[J]. Journal of Dairy Science, 1993, 76(1): 321-328.
[21] MORENO M M C, CUADRADO F V. Enzymic hydrolysis of vegetable proteins: mechanism and kinetics[J]. Process Biochemistry, 1993, 28(7): 481-490.
[22] GONZÁLEZ-TELLO P, CAMACHO F, JURACDO E, et al. Enzymatic hydrolysis of whey proteins:Ⅰ. kinetic models[J]. Biotechnology and Bioengineering, 1994, 44(4): 523-528.
[23] SHAHIDI F, HAN X Q, SYNOWIECKI J. Production and characteristics of protein hydrolysates from capelin[J]. Food Chemistry, 1995, 53(3): 285-293.
[24] 吴保承, 沈国强, 杨春霞, 等. 酶法提取猪血中血红素的工艺研究[J].化学与生物工程, 2009, 26(8): 61-63.
[25] 邓佳, 刘学文, 邓冕. 猪血血红蛋白酶解的优化研究[J]. 食品科技, 2007, 32(11): 209-212.
Optimization of Extraction Conditions of Heme from Tilapias Blood by Enzymatic Hydrolysis
CEN Jian-wei1, LI Lai-hao1, YANG Xian-qing1, LIU Zai-jun1,2, HAO Shu-xian1, ZHOU Wan-jun1, WEI Ya1
(1. National R & D Center for Aquatic Product Processing, Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
To achieve scientific and effective utilization of tilapias blood as an abundant resource in China, the extraction conditions of heme from tilapias blood by enzymatic hydrolysis were studied in this paper. Protamex was found as the best enzyme catalyst for the extraction of heme from tilapias blood. By using single-factor and orthogonal array designs, the optimum enzymatic hydrolysis conditions were determined as follows: temperature, 40 ℃; pH, 8.0; substrate concentration, 6 g/100 mL; enzyme/substrate, 8 000 U/g; and hydrolysis time, 2 h. Under these conditions, followed by heat treatment, acid precipitation and vacuum freeze drying, heme was obtained with a yield of 80.9% and a purity of 28.2%. This extraction procedure is simple, practical, cost saving and suitable for industrial production of value-added products with reduced environmental pollution.
tilapias blood; heme; enzymatic hydrolysis; extraction
TS254. 9
A
1002-6630(2014)16-0029-05
10.7506/spkx1002-6630-201416006
2013-10-23
国家现代农业产业技术体系建设专项(CARS-49); “十二五”国家科技支撑计划项目(2012BAD28B06);
国家农业科技成果转化资金项目(2010GB23260577;2010GB2E000335);广东省科技计划项目(2009A020700004);
广西科学研究与技术开发计划项目(11107005-2)
岑剑伟(1976—),男,副研究员,硕士,研究方向为水产品加工和质量安全。E-mail:genvex@163.com

