中性水介质中H62铜的腐蚀行为
(1.中海油田服务股份有限公司,天津 300450; 2.华中科技大学,湖北 武汉 430074)
中性水介质中H62铜的腐蚀行为
孙永涛1马增华1付朝阳2
(1.中海油田服务股份有限公司,天津 300450; 2.华中科技大学,湖北 武汉 430074)
针对金属铜在中性水介质中的腐蚀问题,采用旋转挂片腐蚀试验和电化学方法对模拟水样中铜的腐蚀行为进行的研究。实验表明:流速和温度均对铜的腐蚀有影响。随着流速和温度的升高,溶液中溶解氧的扩散速度加快,电荷传递电阻减小,导致铜的腐蚀速率加快,但是在高温区,氧的溶解度成为影响铜腐蚀的主导因素,而温度的升高使得溶液中去极化剂溶解度减小,因而在高温区出现了铜的腐蚀速率减小的现象。
铜 中性水介质 腐蚀
0 前言
铜具有优异的机械加工性能、强度、导电性、导热性、可焊接性及耐腐蚀性等特点,广泛应用于工业生产中的热循环系统[1]。由于铜具有比氢更高定的正电位,具有较高的热力学稳定性,不会发生氢的去极化作用,而且其表面可以形成一层疏松多孔的氧化膜,因此使得铜及其合金的耐蚀性能较好[2,3]。但是在含氧的水、氧化性酸、高浓度Cl-及含有CN-、NH4+的溶液中会产生较严重的腐蚀[4]。因此,研究铜在相关环境介质中的腐蚀性行为并采取相应的防护措施是十分必要的。本文通过旋转挂片失重法和电化学方法研究了H62铜在中性水介质中不同温度和流速条件下的腐蚀行为。
1 实验方法
1.1实验材料与介质
选用尺寸为50mm×10mm×2mm的铜试样,其化学成分见表1。实验水样为水箱中储存的自来水,测得其中离子含量见表2,pH值为7.46。试片经过乙醇和丙酮清洗处理干燥保存。

表1 H62铜片化学成分(质量分数,%)
1.2失重法
实验中采用旋转挂片腐蚀评定方法,流速为0.12m/s、0.34m/s、0.60m/s和0.80m/s。所有实验采用旋转挂片腐蚀试验仪进行,由江苏省高邮市新邮仪器厂生产。实验温度分别为15℃、45℃、60℃、70℃,挂片时间为168h。实验结束后试片用酸液、碱液和乙醇清洗试片,冷风干燥。实验前后试片用分析天平称重(精度0.1mg)。
平均腐蚀速率按式(1)进行计算:
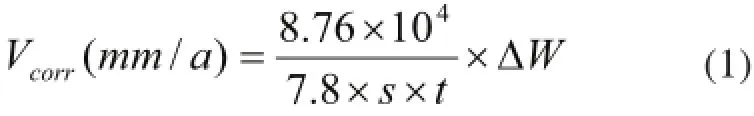
各参数单位为,ΔW(平均失重):g,S(试片面积):cm2,t(试验周期):小时。
1.3电化学测试
电化学测试采用经典三电极体系,工作电极为0.785cm2的铜试样,参比电极为饱和甘汞电极(SCE),辅助电极采用Pt电极。测试仪器为CS300电化学工作站。
极化曲线测试的扫描范围为相对自腐蚀电位±100mV,扫描速度为0.5mv/s。 电化学阻抗谱的测量在开路电位下进行,测量频率范围为10kHz-10mHz,施加幅值为5mV的正弦扰动。
2 结果与讨论
2.1流速对铜腐蚀的影响
根据铜的旋转挂片失重实验数据,做出45℃下流速与腐蚀速率关系曲线。结果如图1所示。
由图1可知,45℃时,铜的腐蚀速率随着转速的增加而增大。在水溶液中,铜的腐蚀主要是耗氧腐蚀,随着流速的增加,溶液携带到金属表面溶解氧的流量随之增大,因此铜的腐蚀速率也随之增大。
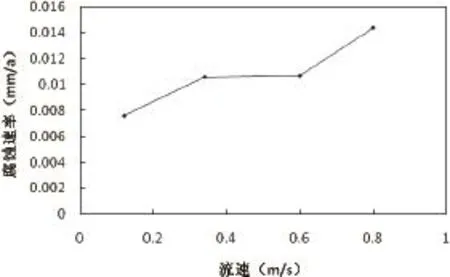
图1 不同流速下铜的腐蚀速率
2.2温度对铜腐蚀的影响
根据铜的腐蚀失重实验数据,做出流速为0.34m/s时温度与腐蚀速率关系曲线。结果如图2所示。
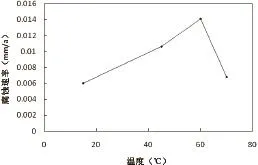
图2 不同温度下铜的腐蚀速率

表2 实验水样离子含量(mg/L)
由图2可见, 随着温度的升高,铜的腐蚀速率逐渐增大,但温度升高到60℃以后铜的腐蚀速率有所减小。对出现这种现象的原因分析如下:在低温条件下,温度升高,水中物质的扩散系数增大,而电极反应的过电位和溶液的黏度减小。扩散系数增大,能使更多的溶解氧扩散到金属表面的阴极区,而且温度升高,反应活化分子数增加,反应动力提高,使氧和铜的电极反应加剧,这些都使金属的腐蚀速率增加。但温度升高到一定程度后,溶液中溶解的去极化剂(如氧和二氧化碳)的溶解度减小,这时腐蚀气体溶解度取代扩散速率,成为电极反应的主导因素,因此出现铜的腐蚀速率下降的现象[5,6]。实验测得15℃、45℃、60℃、70℃下,溶液中氧含量分别为7.66mg/L、4.57mg/L、4.12mg/L、3.52mg/L。
2.3电化学测试
图3是不同温度下铜在自来水样中的动电位扫描极化曲线,所得相关电化学参数见表3。
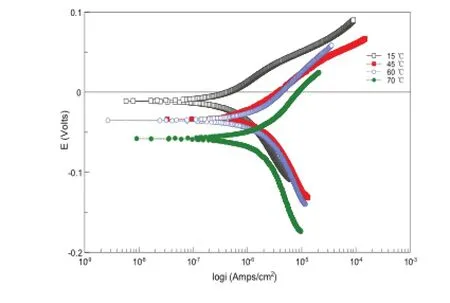
图3 铜在不同温度下的极化曲线
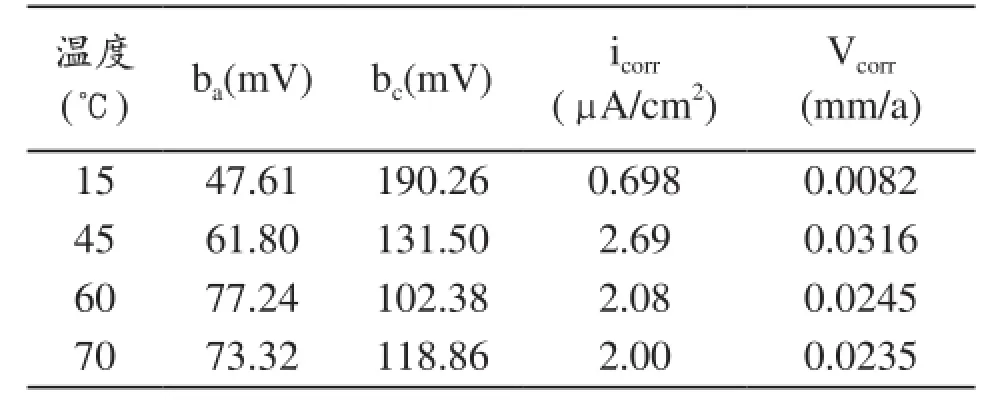
表3 铜在不同温度下的极化曲线拟合参数
由图3和表3可以看出,随着温度的升高,铜在自来水中的腐蚀电位逐渐降低,腐蚀电流逐渐增大,但在温度为70℃时减小。因为在温度较低时,虽然氧在水中的溶解度随温度的升高而降低,但这时氧的扩散速度增加起主导作用,而氧的扩散速度随着温度的升高而增大,因而到达金属表面的氧流量增加,导致金属的腐蚀速率加快。但是在高温区氧的溶解度成为电极反应的主导作用,因而此时腐蚀电流减小。
实验水样中,铜在不同温度下的电化学阻抗谱见图4。图5为其等效电路图,其中Rs为溶液电阻,Rcoat为膜电阻,Rt为电荷传递电阻,Cdl为双电层电容,Ccoat膜电容。相关电化学解析数据见表4。
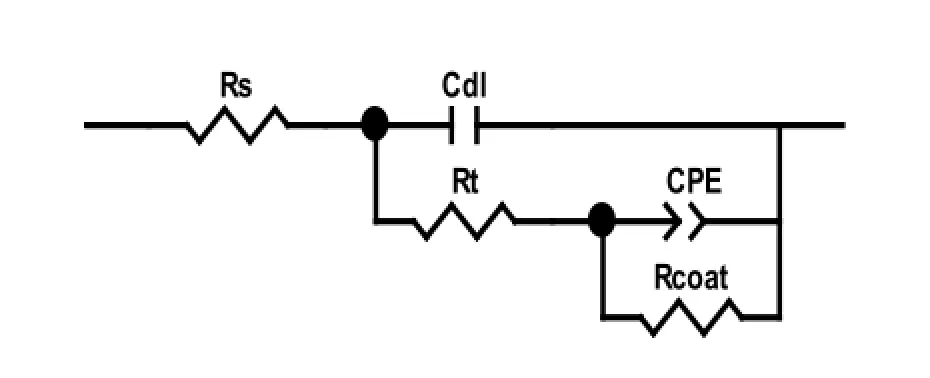
图5 电化学等效电路图
电化学阻抗谱图中出现两个容抗弧,其中高频容抗弧是由双电层电容引起的,而低频容抗弧则是由膜层阻抗和膜电容引起的。由表4可见,随着温度的升高,电荷传递电阻逐渐减小,说明电极反应的阻力减小,铜的腐蚀速率加快[7-9]。与失重法实验和极化曲线反映的腐蚀趋势吻合。
3 结论

图4 不同温度下铜的电化学阻抗谱图
流速是铜腐蚀的一个重要影响因素,流速增大,导致溶液传质速率加快,去极化剂扩散速率增加,参与电极反应的溶氧量加大,因而加速铜的腐蚀。
失重法和电化学数据表明铜的腐蚀速率随着温度的升高先增大后减小。随着温度的升高,溶液中物质的扩散系数增大,在扩散作用为主导的情况下更多的溶解氧扩散到铜表面,同时溶液电荷传递电阻减小,铜的腐蚀速率加快。但是在高温区,氧的溶解度成为电极反应的主导因素,而温度的升高使得去极化剂的溶解度减小,因而导致铜的腐蚀速率减小。

表4 电化学等效电路解析数据
[1] 何俊, 于萍, 罗运柏. 铜缓蚀剂的研究现状与进展[J]. 材料保护, 2006,39(4): 42-47.
[2] 余向飞. 铜及其合金缓蚀剂的研究进展[J]. 材料开发与应用, 2002,25(3): 106-109.
[3] 伍廉奎, 高勇.环保型铜及其合金缓蚀剂的研究进展[J].电镀与环保, 2008,28(5): 5-7.
[4] Ravichandran R, Rajendran N.Influence of benzotriazole derivatives 0n the dezincification of 65-35 brass in sodium chloride[J].Appl Surf Sci, 2005, 239: 182.
[5] 张天胜, 缓蚀剂[M]. 北京: 化学工业出版社, 2008.
[6] 周志辉. 纯水中铜的腐蚀规律的研究及其缓蚀剂的应用[J].华北电力技术, 2004,4: 22-25.
[7] Bentiss F, Traisnel M, Vezin H, et al.2, 5-Bis(4-dimethylaminophenyl)-1,3,4-oxadiazole and 2,5-bis(4-dimethylaminophenyl)-1,3,4-thiadiazole as corrosion inhibitors for mild steel in acidic media [J]. Corros Sci, 2004, 46: 2781-2792.
[8] Hossain S A, Almarshad A I.Inhibiting effect of thiosemicarbazide on cold rolled steel [J].Corrosion Engineering Science and Technology, 2006,41: 77-81.
[9] 曹楚南. 腐蚀电化学原理[M].北京: 化学工业出版社, 2008.
Study of Corrosion Behavior of Copper in Neutral Aqueous Solution
SUN Yong-tao1, MA Zeng-hua1, FU Chao-yang3
(1. China Oilfield Services Limited, Tianjin 300450, China; 2. Huazhong University of Science and Technology, Wuhan 430074, China)
According to the corrosion and scaling problems of copper in neutral aqueous solution, study corrosion behavior of copper in simulated water by using rotating hang piece of corrosion test and electrochemical method. Experiments show that flow velocity and temperature have an effect on the corrosion of cupper. Along with the increase of temperature and velocity, the diffusion of dissolved oxygen in solution speed up, the charge transfer resistance reduction, leading to the corrosion rate of copper faster. But in the high-temperature region, solubility of oxygen becomes the dominant factors of copper corrosion, and the rise of temperature reduces the solubility. Thus in the high-temperature region appeared copper corrosion rate of decrease phenomenon.
copper; neutral aqueous solution; corrosion
TG172.5
A
10.13726/j.cnki.11-2706/tq.2014.08.067.04
孙永涛 (1973-) ,男,硕士,高级工程师。

