NaCl胁迫下甜菜三种内源激素含量的动态变化
於丽华,韩晓日,耿 贵,赵慧杰,孙学伟,崔 平,陈 丽,马亚怀,李彦丽
(1.沈阳农业大学土地与环境学院,沈阳 110161;2.黑龙江省普通高等学校甜菜遗传育种重点实验室/黑龙江大学,哈尔滨 150080;3.黑龙江大学生命科学学院,哈尔滨 150080)
NaCl胁迫下甜菜三种内源激素含量的动态变化
於丽华1,2,韩晓日1*,耿 贵2,赵慧杰3,孙学伟3,崔 平2,陈 丽2,马亚怀2,李彦丽2
(1.沈阳农业大学土地与环境学院,沈阳 110161;2.黑龙江省普通高等学校甜菜遗传育种重点实验室/黑龙江大学,哈尔滨 150080;3.黑龙江大学生命科学学院,哈尔滨 150080)
文章以甜菜ST13092为供试品种,采用室内营养液水培培养方式,研究不同NaCl浓度对甜菜内源激素(IAA、GA3、ABA)的影响,以及在盐胁迫条件下三种内源激素含量随时间的动态变化情况。结果表明,IAA和GA3含量均随浓度升高显著降低,其中,280 mmol·L-1降低量最大,210 mmol·L-1降低幅度大,70 mmol·L-1几乎未受影响;IAA含量仅有280 mmol·L-1处理随时间延长而降低,其他各个处理均呈升高趋势。ABA含量随着NaCl浓度的升高而明显升高;除3 mmol·L-1对照外,其他各处理均随时间延长先升高后降低。IAA/ABA和GA3/ABA均随NaCl浓度升高而降低;随着时间延长呈现先下降后升高趋势。
NaCl胁迫;甜菜;激素
甜菜是我国主要糖料作物[1],属于嗜盐作物[2],可在一定盐分含量土壤环境中可较好生长[3]。目前,我国甜菜主要分布在西北、华北以及东北地区,由于这些地区盐碱土广布[4],研究和探讨通过甜菜自身耐盐性提高“三北”地区土壤资源利用率,是我国农业资源合理利用的重要途径。
植物激素与耐盐性关系密切[5-6]。IAA和GA是生长促进物质,调节多种生理活动[7]。魏爱丽等对植物耐盐性与内源激素的关系进行研究,一定浓度IAA可促进盐胁迫下大豆幼苗生长,增强幼苗对盐渍环境的抵抗能力[8],外源GA有助于谷子种子萌发,减缓盐分胁迫[9]。但在盐胁迫条件下植物体内源激素IAA、GA、ABA等都发生不同程度变化,IAA和GA等合成会受到抑制[10],ABA含量显著升高[11-12]。ABA作为胁迫信号,在调节植物水分平衡以及诱导胁迫耐性方面起重要作用[13]。因此激素研究是植物耐盐性研究不可缺少的内容之一。目前对小麦[14]、水稻[15]、大豆[8]等作物激素和耐盐性关系的报道很多,但甜菜内源激素与耐盐性关系却鲜有报道。甜菜是耐盐性较强的作物,在盐渍化土壤上也能获得较高产量,因此研究盐胁迫条件下甜菜内源激素变化,探究甜菜内源激素与耐盐性关系,完善甜菜耐盐机理,可为盐碱地利用改良提供理论基础。
1 材料与方法
1.1 生物培养
将甜菜(Beta vulgaris)品种ST13092(单胚包衣种子)播种于基质(蛭石)中,于每日连续光照14 h,平均光照强度2.3×104lx,昼夜温度分别为25和20℃,相对湿度保持在60%~70%培养室内培养,待一对子叶完全展开,选取大小均匀一致甜菜幼苗移入含20 L营养液的玻璃槽中,NaCl浓度分别是3、70、140、210和280 mmol·L-1,每个处理3个重复,每个重复36株。3 mmol·L-1NaCl浓度为对照组。盐后处理第1、2、3、4、6、8和10天,分别取不同盐浓度甜菜叶,液氮迅速冷冻后于-80℃超低温冰箱中保存,待取样结束后测定三种激素含量。
1.2 测定方法
IAA、GA和ABA含量测定利用植物激素酶联免疫吸附测定法(ELISA)测定,试剂盒由中国农业大学提供。每个样品重复测定3次。方法参照覃喜军等研究方法[16]。
1.3 数据处理
运用SPSS 20.0和Excel 2003软件对数据进行绘图及统计分析,所有数据为3次测定的平均值±标准误,在P<0.05水平上进行单因素方差分析,差异显著用Duncan检测进行多重分析。
2 结果与分析
2.1 NaCl胁迫下叶片中IAA含量的动态变化
对甜菜叶片中IAA含量测定结果见表1,从不同NaCl浓度对叶片中IAA含量影响来看,IAA含量随着NaCl浓度的提高不断降低。当NaCl浓度从3 mmol·L-1提高到70、140、210和280 mmol·L-1,胁迫4 d,IAA含量分别降低5.51%、19.88%、45.24%和51.91%;胁迫6 d,IAA含量分别降低4.22%、20.21%、41.79%和56.33%;胁迫8 d,IAA含量分别降低5.52%、18.83%、34.74%和57.15%;胁迫10 d,IAA含量分别降低0.68%、13.87%、38.37%和60.29%。胁迫4~10 d,从每增加70 mmol·L-1NaCl引起的IAA含量降低幅度看,NaCl浓度从3 mmol·L-1提高到70、140、210和280 mmol·L-1,IAA含量7 d平均降低3.99%、14.21%、21.84%和16.38%。由此可见,210 mmol·L-1NaCl处理IAA含量降低的幅度最大,即受到NaCl胁迫影响程度最大,70 mmol·L-1NaCl处理仅降低3.99%,受到影响较小。
从NaCl胁迫下各处理叶片IAA含量随时间的变化看,随着NaCl胁迫时间延长,3、70、140和210 mmol·L-1四个处理IAA含量均有不断升高趋势;而280 mmol·L-1处理,IAA含量随着时间的延长而降低。由表1可知,3、70 mmol·L-1处理IAA日最大提高幅度出现在第3天,分别为5.82%和11.11%;140 mmol·L-1处理日最大提高率出现在第4天,为10.58%,210 mmol·L-1处理则出现在第8天,为6.97%,其余各时间段提高率均在5%以下,可见各处理IAA含量随时间的延长略有增加但增加幅度不明显。而280 mmol·L-1处理IAA含量却一直处于降低趋势,该处理设定的NaCl浓度已严重影响IAA合成。
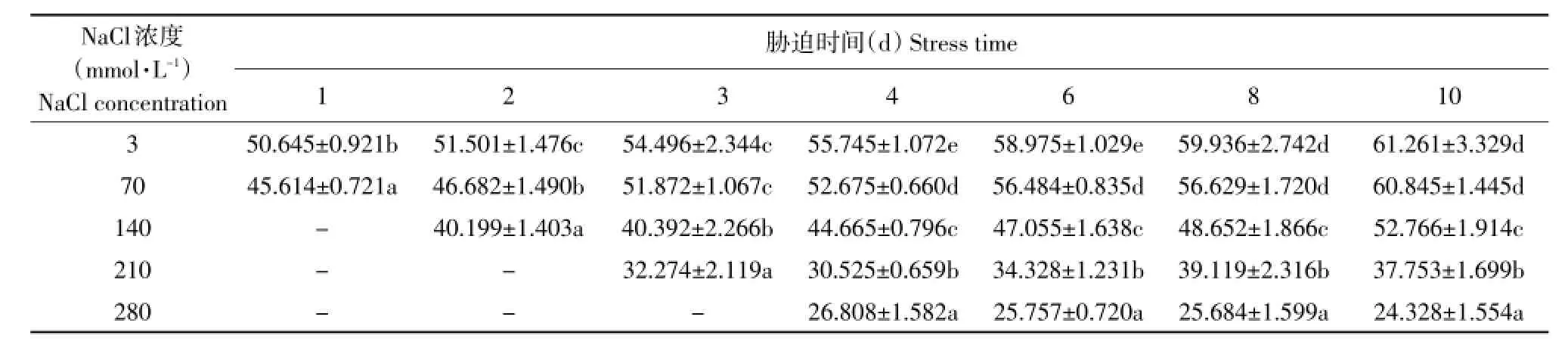
表1 盐胁迫下甜菜叶片IAA含量Table 1 IAA content in sugar beet leaves with time prolongation under salt stress (ng·g-1FW)
2.2 NaCl胁迫下叶片中GA3含量的动态变化
从不同NaCl浓度对叶片中GA3含量影响来看(见表2),GA3含量随着NaCl浓度的升高而降低,NaCl浓度从3 mmol·L-1提高到70、140、210和280 mmol·L-1,胁迫4 d,GA3含量分别降低2.41%、14.14%、37.93%和45.38%;胁迫10 d,GA3含量分别降低1.13%、13.31%、27.92%和39.5%。可见,盐浓度越高,GA3含量降低越多,其中280 mmol·L-1处理在监测时间内与对照相比最高降低45.38%。胁迫4~10 d,每增加70 mmol·L-1NaCl引起的GA3含量降低幅度看,NaCl浓度从3 mmol·L-1提高到70、140、210和280 mmol·L-1,GA3含量7 d平均降低1.64%、12.18%、17.75%和10.65%。由此可见,210 mmol·L-1NaCl处理GA3含量降低幅度最大,70 mmol·L-1NaCl处理仅降低1.64%,基本未受到影响。

表2 盐胁迫下甜菜叶片IAA含量Table 2 GA3content in sugar beet leaves with time prolongation under salt stress (ng·g-1FW)
从NaCl胁迫下各处理叶片GA3含量随时间的变化看(见表2),在研究时间内,随着NaCl胁迫时间延长,每个处理GA3含量在处理后呈现先升高,后回落趋势。各处理在达到试验设计浓度后第1天GA3含量最低,除3 mmol·L-1NaCl正常处理第10天GA3含量低于第1天含量外,其余4个处理在第10 天GA3含量均略有升高。各处理虽然随着时间的延长有所变化,但总体来说GA3含量每日变化率总体均在5%以下,所以各处理GA3含量随时间变化不大。
2.3 NaCl胁迫下叶片中ABA含量的动态变化
从不同NaCl浓度对叶片中ABA含量影响看(见表3),甜菜叶片ABA含量随着NaCl浓度的提高大幅度升高。NaCl浓度从3 mmol·L-1提高到70、140、210和280 mmol·L-1,胁迫4 d,ABA含量分别升高91.30%、246.08%、399.24%和525.96%;胁迫6 d,ABA含量分别升高131.22%、2 686.13%、473.35%和631.10%;胁迫8 d,ABA含量分别升高151.47%、240.41%、343.09%和483.50%;胁迫10 d,ABA含量分别升高50.20%、84.85%、141.21%和256.96%,其中升高最高一天比对照升高了5倍多,达到525.96%,是280 mmol·L-1处理,升高最低的一天比对照升高50%,70 mmol·L-1处理。胁迫4~10 d,每增加70 mmol·L-1NaCl引起的ABA含量的升高幅度看,NaCl浓度从3 mmol·L-1提高到70、140、210和280 mmol·L-1,ABA含量6 d平均升高106.05%、108.32%、124.85%和135.16%,由此可见,280 mmol·L-1NaCl处理ABA含量升高的幅度最大,210 mmol·L-1NaCl处理次之,70和140 mmol·L-1NaCl处理每提高70 mmol·L-1NaCl所引起的ABA含量的升高幅度相近,分别为106.05%和108.32%。
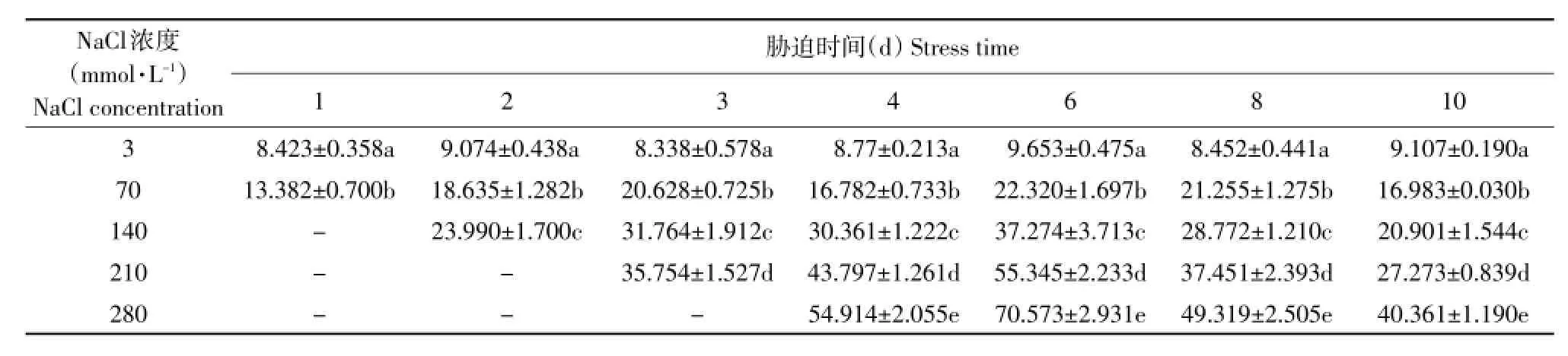
表3 盐胁迫下甜菜叶片ABA含量Table 3 ABA content in sugar beet leaves with time prolongation under salt stress (ng·g-1FW)
由表3可见,随着NaCl胁迫时间的延长,各盐胁迫处理ABA含量呈现先上升后下降趋势。3 mmol·L-1对照处理随时间变化不大,其余各处理均在研究时间内出现一个最高值,然后随时间延长开始下降,10 d后下降到低于第一次测定含量,说明甜菜在盐胁迫后通过调节体内ABA含量抵御外界盐分胁迫。
2.4 NaCl胁迫下叶片中IAA/ABA的动态变化
在植物生长发育中,激素起到非常重要的作用,但这不是某一种单一激素单独作用的结果,而是多种激素共同调节的结果。从不同NaCl浓度对叶片中IAA/ABA影响看(见图1),随着NaCl浓度升高,各处理IAA/ABA明显降低,70、140、210和280 mmol·L-1分别较对照处理(3 mmol·L-1)平均降低54.57%、73.69%、85.88%和92.51%,降低程度非常大。
胁迫4~10 d,每增加70 mmol·L-1NaCl引起的IAA/ABA降低幅度看,IAA/ABA平均降低54.57%、19.12%、12.19%和6.63%,由此可见,70 mmol·L-1NaCl处理IAA/ABA降低幅度最大,280 mmol·L-1NaCl处理降低3.99%。从NaCl胁迫下各处理叶片IAA/ABA随时间的变化来看(见图1),随着胁迫时间延长,IAA/ABA比值均呈现先下降后升高趋势。

图1 盐胁迫下甜菜叶片IAA/ABA随时间的变化Fig.1 Changes of IAA/ABA in sugar beet leaves with time prolongation under salt stress
2.5 NaCl胁迫下叶片中GA3/ABA的动态变化
从不同NaCl浓度对叶片中GA3/ABA影响来看(见图2),随着NaCl浓度的升高,各处理GA/ABA明显降低,70、140、210和280 mmol·L-1分别较对照处理(3 mmol·L-1)平均降低53.48%、72.39%、83.89%和89.95%,降低程度非常大。胁迫4~10 d,每增加70 mmol·L-1NaCl引起的GA/ABA的降低幅度看,GA3/ABA平均降低53.48%、18.91%、11.50%和6.07%,由此可见,70 mmol·L-1NaCl处理GA3/ABA降低的幅度最大,280 mmol·L-1NaCl处理降低的最小,从以上的分析中可以看出不同NaCl浓度对叶片中GA3/ABA和IAA/ABA影响十分相似。从NaCl胁迫下各处理叶片GA3/ABA随时间的变化来看(见图2),随胁迫时间延长70 mmol·L-1处理与对照处理(3 mmol·L-1)的变化趋势相似,先下降然后上升再下降的波动趋势,规律不明显;140、210和280 mmol·L-1处理变化趋势相似,先下降后升高。

图2 盐胁迫下甜菜叶片GA3/ABA随时间的变化Fig.2 Changes of GA3/ABA in sugar beet leaves with time prolongation under salt stress
3 讨论
植物耐盐性与其体内激素含量有一定关系。吲哚乙酸(IAA)和赤霉素(GA3)都是促进植物生长发育物质[17],IAA和GA3能增加植物幼苗干物质产量,提高光合,促进植物幼苗生长[18-19]。但在盐胁迫条件下,植物内源IAA及GA3合成受抑制,含量降低,会影响植物正常生长[20-23]。本试验结果表明,随着盐胁迫程度的增强使对甜菜生长有促进作用的IAA和GA3含量显著降低,在70 mmol·L-1处理降低量较小,与对照处理无明显差异,即在盐度小于70 mmol·L-1时,甜菜体内这两种激素合成无影响,甜菜正常生长;但浓度升至210 mmol·L-1后IAA和GA3含量下降速度最快,即在本试验条件下,胁迫浓度达到210 mmol·L-1以上后,严重影响体内这两种激素合成,使甜菜生长受严重限制。
同一胁迫条件下,IAA和GA3含量随胁迫时间延长发生变化:在70 mmol·L-1低盐胁迫处理中,胁迫初期IAA含量有所降低,但随着胁迫时间延长,含量增加,第8天后已恢复至对照组水平,这是甜菜自身调节结果,突然在环境中加入对生长不利的物质,植物内源激素作为痕量信号分子,含量发生变化,影响体内各种生理生化活动,随时间延长,体内各种耐受机制开始发挥作用,只要在其耐受范围内,可通过各种调节作用,在一段时间内恢复到正常水平,不会对生长产生影响;但在中等浓度(140~210 mmol·L-1)条件下,胁迫时间延长,含量虽有增加,但短时间内不能恢复到正常水平,生长受到一定影响,当高于280 mmol·L-1时,IAA含量随时间呈持续下降趋势,胁迫日益严重,甜菜自身调节作用不能启动。GA3含量在超过140 mmol·L-1胁迫强度后随时间变化不大。本试验说明甜菜在低盐胁迫后期对胁迫环境产生一定抗性,IAA和GA3合成量能逐渐恢复,盐害逐渐降低。高盐环境下甜菜IAA合成机能受损过重,IAA合成无法恢复。
植物体内源脱落酸(ABA)被视为逆境激素[24],在盐胁迫信号传递中起重要作用,可诱导相应的基因表达,提高植物对低温、干旱、盐渍、病虫害等胁迫的抗性[25],以增强植物对盐的适应能力[26]。在干旱、盐渍以及低温条件下,植物表现出不同程度的ABA积累[27]。ABA含量升高会诱导气孔关闭,致使叶片气孔导度、蒸腾速率和净光合速率相应迅速下降[28]。虽然降低气孔导度和蒸腾速率会在一定程度下降低净光合速率,但这也是植物对抗胁迫环境的一种应激反应。ABA含量升高,使气孔关闭,降低蒸腾速率,减少水分流失[29],可诱导某些特异蛋白合成,这些特异蛋白在逆境下能维持细胞正常渗透势或膨压[30]。本试验表明,甜菜ABA含量随盐胁迫程度升高而逐渐升高,在280 mmol·L-1处理组含量达到最高值,随胁迫时间延长各处理组在胁迫后期ABA含量较其处理组初期有降低趋势,可能是甜菜通过自身调节适应盐胁迫后结果。
盐胁迫时,植物体内激素并不是单一激素起作用,而是共同发挥作用,陈文珍研究发现,盐胁迫条件下长叶红砂幼苗(IAA+ZR+GA3)/ABA比值和相对生长率变化趋势相同[34]。本研究显示IAA/ABA 和GA3/ABA均随盐胁迫程度升高而降低,盐胁迫促使ABA含量升高,IAA和GA3含量降低,造成IAA/ABA和GA3/ABA降低。随胁迫时间延长,IAA/ABA和GA3/ABA比值均呈现先降低后升高趋势,盐胁迫之初IAA含量降低,而ABA含量升高,但随着时间的延长,甜菜自身调节发挥作用,使得IAA和GA3缓慢升高,ABA含量缓慢降低,两种激素最终达到平衡。
4 结论
在NaCl胁迫条件下,甜菜内源激素发生不同程度变化。本试验条件下,当NaCl浓度超过140 mmol·L-1时,甜菜内源IAA和GA3合成和运输明显受到抑制,盐浓度越高,抑制越明显,其中两种内源激素含量在210 mmol·L-1NaCl浓度下降低最为迅速,高于此浓度对甜菜的伤害程度较大;内源IAA 和GA3在NaCl浓度低于70 mmol·L-1时,含量未受影响,甜菜具有很强耐盐能力。NaCl促进甜菜内源ABA合成,盐浓度越高,ABA含量越高。
从时间对各内源激素影响来看,IAA含量在高盐条件下(大于280 mmol·L-1),胁迫日益严重,含量越来越低,甜菜自身调节作用不能启动,低于此浓度,IAA可通过自身调节,提高其浓度以缓解盐胁迫对其伤害。盐胁迫条件下GA3含量受时间的影响没有IAA大。ABA含量在盐胁迫后升高,通过自身调节缓慢降低。IAA/ABA和GA3/ABA比值随盐胁迫增强而降低,但随胁迫时间的延长呈现先下降后升高趋势,向有利于生长方向发展。
[1]郭艳超,王文成,刘同才,等.盐胁迫对甜菜叶片生长及生理指标的影响[J].河北农业科学,2011(2)∶11-14.
[2]耿贵,周建朝,孙立英,等.不同盐度对甜菜生长和养分吸收的影响[J].中国甜菜糖业,2000(1)∶12-14.
[3]彭春雪,耿贵,於丽华,等.不同浓度钠对甜菜生长及生理特性的影响[J].植物营养与肥料学报,2014(2)∶459-465.
[4]魏博娴.中国盐碱土的分布与成因分析[J].水土保持应用技术, 2012(6)∶27-28.
[5]毛桂莲,许兴,徐兆斟.植物耐盐性生理生化研究进展[J].中国生态农业学报,2004,12(1)∶43-46.
[6]侯振安,李品芳,龚元石.激素对植物耐盐性影响的研究现状与展望[J].石河子大学学报,2000,4(3)∶239-245.
[7]Razerm F A,Baron K,Hill R D.Turning on gibberellin and abscisic acid signaling[J].Current Opinion in Plant Biology,2006 (9)∶454-459.
[8]魏爱丽,陈云昭.IAA对盐胁迫下大豆幼苗膜伤害及抗盐力的影响[J].西北植物学报,2000(3)∶410-414.
[9]张永芳,卫秋慧,王润梅,等.外源赤霉素对盐胁迫下谷子种子萌发的影响[J].作物杂志,2012(6)∶139-141.
[10]Moud A M,Maghsoudi K.Saltstress effects on respiration and growth of germinated seeds of different wheat(Triticum aestivum L.)cultivars[J].World Journal of Agricultural Sciences,2008,4 (3)∶351-358.
[11]Zörb C,Geilfus C M,Mühling K H,et al.The influence of salt stress on ABA and auxin concentrations in two maize cultivars differing in salt resistance[J].Journal of Plant Physiology,2013, 170(2)∶220-224.
[12]吴耀荣,谢旗.ABA与植物胁迫抗性[J].植物学通报,2006(5)∶511-518.
[13]许树成,丁海东,鲁锐,等.ABA在植物细胞抗氧化防护过程中的作用[J].中国农业大学学报,2008(2)∶11-19.
[14]刘海英,崔长海,赵倩,等.施用有机肥环境下盐胁迫小麦幼苗长势和内源激素的变化[J].生态学报,2011,15∶4215-4224.
[15]年悦,王楠,崔震海,等.北方粳稻灌浆期水分胁迫条件下叶片内源激素变化的研究[J].中国农学通报,2012(21)∶33-37.
[16]覃喜军,黄夕洋,蒋水元,等.罗汉果花芽分化过程中内源激素的变化[J].植物生理学通讯,2010(9)∶939-942.
[17]周红兵,王迎春,石松利,等.NaCl胁迫对盐生植物长叶红砂幼苗内源激素的影响[J].内蒙古大学学报∶自然科学版,2010(5)∶531-535.
[18]赵可夫,王韶唐.作物抗性生理[M].北京∶农业出版社,1990∶304.
[19]魏爱丽,陈云昭.IAA对盐胁迫下大豆幼苗膜伤害及抗盐力的影响[J].西北植物学报,2000,20(3)∶410-414.
[20]陈丹,刘延吉,吴阔.盐胁迫对碱茅幼苗叶片内源激素的影响[J].安徽农业科学,2007,12∶3476-3477.
[21]刘延吉,张蕾,田晓艳,等.盐胁迫对碱茅幼苗叶片内源激素、NAD激酶及Ca2+-ATPase的效应[J].草业科学,2008(4)∶51-54.
[22]闫艳华,姜国斌,侯和胜,等.杨树内源激素对NaCl胁迫的响应[J].西北农业学报,2011(9)∶160-164.
[23]李青云.草莓对盐胁迫的反应及调控研究[D].保定∶河北农业大学,2005.
[24]Walker M A,Dumbroff E B.Effects of salt stress on abscisic acid and cytokinin levels in tomato[J].Zeitschrift für Pflanzenphysiologie,1981,101∶461-470.
[25]Mayaba N,Beckett R P,Csintalan Z,et al.ABA increases the desiccation tolerance of photosynthesis in the afromontane understorey moss Atrichum androgynum[J].Annals of Botany,2001,88∶1093-1100.
[26]Giraudat J,Parcy F,Bertauvh N,et al.Current advances in abscisic acid action and signaling[J].Plant Molecular Biology, 1994,26∶1557-1577.
[27]周翔,吴晓岚,李云,等.盐胁迫下玉米幼苗ABA和GABA的积累及其相互关系[J].应用与环境生物学报,2005,11(4)∶412-415. [28]张云霞,石勇,王瑞刚,等.初始盐胁迫下ABA与CaM对胡杨叶片气体交换的调控[J].林业科学,2008(1)∶57-64.
[29] 钟新榕.外源ABA及GA3对NaCl胁迫下黄瓜幼苗的影响[D].兰州∶甘肃农业大学,2005.
[30]Moons A G,Bauw G,Prinsen E.Molecular and physiological responses to abscisic acid and salt in roots of salt-sensitive and salt-tolerant indica rice varieties[J].Plant Physiology,1995,35∶299-319.
[31]库文珍,彭克勤,张雪芹,等.低钾胁迫对水稻苗期矿质营养吸收和植物激素含量的影响[J].植物营养与肥料学报,2009(1)∶69-75.
Dynamic changes of three kinds of endogenous hormone contents of sugar beet under NaCl stress
YU Lihua1,2,HAN Xiaori1,GENG Gui2,ZHAO Huijie3,SUN
Xuewei3,CUI Ping2,CHEN Li2,MA Yahuai2,LI Yanli2(1.School of Land and Environmental Science, Shenyang Agricultural University,Shenyang 110161,China;2.Key Laboratory of Sugar Beet Genetic Breeding of Heilongjiang Province,Heilongjiang University,Harbin 150080,China; 3.School of Life Science,Heilongjiang University,Harbin 150080,China)
Sugar beet ST13092 was cultivated in the hydroponic experiment to investigate the effects of the different NaCl concentration and the different stress time on endogenous hormone(IAA,GA3,ABA)contents of sugar beet seedlings.The results showed that the different NaCl concentration effect on the variation tendency of the GA3content was similar with IAA,both decreased significantly with the increase of NaCl concentration,in addition,content of the IAA and GA3of the 280 mmol·L-1had the maximum reduces compared with the control group,the decreasing amplitude of 210 mmol·L-1treatment group was the maximum,and the 70 mmol·L-1treatment group was not almost affected.The IAA content of each treatment group(expect 280 mmol·L-1)were increased with the time prolongation ofsalt stress.The ABA content of each treatment group decreased significantly with the increase of NaCl concentration,and each treatment group(except 3 mmol·L-1was almost affected)were increased first and then decreased with the time prolongation of salt stress.IAA/ABA and GA3/ABA decreased significantly with the increase of NaCl concentration,at the same time,they were decreased first and then decreased increased with the time prolongation of salt stress.
NaCl stress;sugar beet;hormone
S566
A
1005-9369(2014)12-0058-07
时间2014-12-29 9∶07∶45 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20141229.0907.015.html
於丽华,韩晓日,耿贵,等.NaCl胁迫下甜菜三种内源激素含量的动态变化[J].东北农业大学学报,2014,45(12):58-64.
Yu Lihua,Han Xiaori,Geng Gui,et al.Dynamic changes of three kinds of endogenous hormone contents of sugar beet under NaCl stress[J].Journal of Northeast Agricultural University,2014,45(12):58-64.(in Chinese with English abstract)
2014-10-27
黑龙江省教育厅科研项目(11541279)
於丽华(1978-),女,助理研究员,博士研究生,研究方向为植物营养及抗性生理。E-mail∶32307812@qq.com
*通讯作者:韩晓日,教授,博士生导师,研究方向为植物营养与施肥。E-mail∶hanxiaori@163.com

