Gli1 和OPN 在结直肠癌组织中的表达及其临床意义
汪长健 杨关根 丁 菁 廖秀军
研究发现Hedgehog 信号通路异常激活可导致人类多种肿瘤的发生,包括基底细胞癌、胰腺癌、胃癌、乳腺癌、前列腺癌、肝癌等[1]。通路的激活可导致脑胶质瘤相关癌基因(Gli1)、胰岛素样生长因子结合蛋白(IGFBP - 6)、细胞周期蛋白D2(cyclin D2)骨桥蛋白(OPN)等下游靶基因的转录,促进细胞向恶性生物学行为转化,并最终发生肿瘤[2]。Hedgehog 信号通路与结直肠癌的关系目前尚无定论,在人类一些大肠癌细胞系如CaCo2、HT29 以及SW480 中,可以检测到SHH、PTCH、SMO、SUFU 及Gli 的表达,而在Colo320 中未检测到Gli 等关键蛋白的表达[3,4]。本实验以结直肠癌标本为研究对象,观察Hedgehog 信号通路中Gli1 及其下游靶基因OPN 在结直肠癌组织中的表达,分析二者之间的相关性,进一步探讨它们的表达与结直肠癌临床病理因素之间的关系。
材料与方法
1.材料:收集2009 年5 月~2010 年12 月杭州市第三人民医院肛肠科行结直肠癌根治手术并具有完整临床资料的病理标本76 例,所有患者术前均未接受化疗或放疗。其中男性为40 例,女性36 例;患者年龄39 ~81 岁,中位年龄54.5 岁。Dukes 分期:A 期11 例;B 期20 例,C 期31 例、D 期14 例,组织学分型:高分化13 例、中21 分化、低分化36 例、未分化6例。结肠癌33,直肠癌43 例。取距癌组织10cm 以上无浸润的正常大肠组织为对照,所有对照标本经HE 染色镜下未见肿瘤细胞。
2.试剂与方法:一抗兔抗人Gli1 抗体和鼠抗人OPN 单克隆抗体试剂盒均购自美国Santa Cruz 公司。二抗购于杭州隆基生物技术有限公司。免疫组化试剂盒购自北京中山生物科技公司。所有标本均以10%甲醛溶液固定,石蜡包埋,每例以5μm 厚度连续切片,用于免疫组化染色。应用免疫组织化学链霉素抗生物素蛋白-过氧化物酶(SP)法,操作步骤按试剂盒提示进行,切片经处理后进行HE 染色和免疫组化染色。Gli1 的工作浓度为1∶150,OPN 的工作浓度为1∶200。用磷酸盐缓冲液(PBS)代替一抗作为阴性对照,用已知的Gli1 和OPN 阳性的乳腺癌切片作阳性对照。
3.结果判定:由两名病理科医师独立阅片,对切片染色结果进行判定。Gli1 蛋白主要定位于细胞质,部分表达于细胞核,为棕黄色颗粒状。OPN 蛋白主要定位于细胞质,部分表达于细胞膜,为黄色或棕黄色颗粒状。每张切片随机选取10 个高倍镜视野(×400),根据阳性细胞百分率及显色深浅进行分类处理。其中染色强度:0.无染色;1.淡黄色;2.棕黄色;3.棕褐色。后按阳性细胞所占百分比记分:<5%为0 分,5% ~25%为1 分,25% ~50%为2 分,50% ~75%为3 分,>75%为4 分;两项分值相加为每张切片组织染色积分,>3 分记为阳性,≤3 分记为阴性。
4.统计学方法:使用SPSS 17.0 统计软件进行统计学处理,计数资料的比较采用χ2检验,Gli1 和OPN 表达的相关性采用Spearman 相关分析方法,P <0.05 为差异有统计学意义。
结 果
1.Gli1 蛋白在结直肠癌组织和正常组织中的表达:Gli1 蛋白在76 例结直肠癌中有33 例呈阳性表达,表达率为43.4%。在23 例正常组织中3 例阳性表达,表达率为13.0%,Gli1 在癌组织中表达高于正常组织,二者之间差异有统计学意义(P <0.05)。
2.OPN 蛋白在结直肠癌组织和正常组织中的表达:OPN 蛋白在76 例结直肠癌中有39 例呈阳性表达,表达率为51.3%。在23 例正常组织中4 例阳性表达,表达率为17.4%,OPN 在癌组织中表达高于正常组织,二者之间差异有统计学意义(P <0.05)。
3.Gli1 和OPN 蛋白表达与结直肠癌的临床病理特征的关系:Gli1 和OPN 的表达均与性别、年龄、肿瘤大小无关(P >0.05),与淋巴结是否转移、Dukes 分期有关(P <0.05),在伴有淋巴结转移和分期较晚的患者,Gli1 和OPN 的表达均显示出有统计学意义的升高。OPN 的表达与肿瘤的分化程度无关,而Gli1则显示出较强的相关性(P <0.01),组织学分化越差,Gli1 表达越高(表1)。
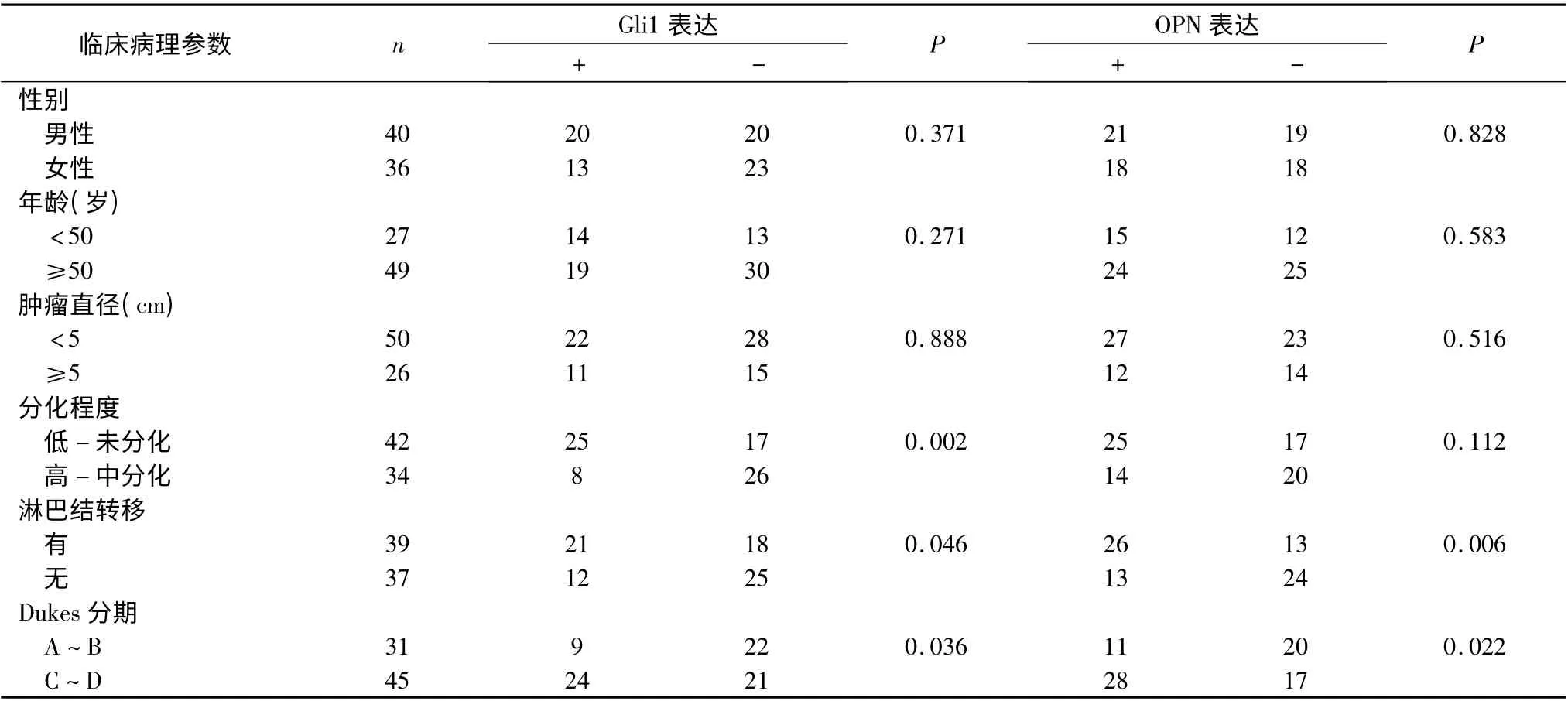
表1 Gli1 和OPN 蛋白的表达与结直肠癌的临床病理之间的关系
4.Gli1 和OPN 之间表达的相关性:采用Spearman等级相关分析:Gli1 与OPN 蛋白在结直肠癌组织中的表达呈正相关(r=0.312,P <0.01,表2)。
讨 论
Hedgehog 信号通路是生物胚胎发育过程中重要的信号转导系统之一,它高度保守,一旦果蝇的该通路基因发生突变,其幼虫形似刺猬(Hedgehog),因此得名。Gli1 是Hedgehog 信号通路中激发下游转录起始的关键分子,当细胞膜外分泌型配体(Shh/Ihh/Dhh)与跨膜受体蛋白Ptch 结合,促使其解除对另一跨膜蛋白Smo 的抑制作用,从而导致Gli1 进入核内启动靶基因的转录[5]。人类的多种先天性疾病如气管食管瘘、肛门闭锁和肠道畸形等都与Hedgehog 信号通路中某些基因的突变有关。研究证明Hedgehog的异常活化与肿瘤的发生发展关系密切,通过抑制该通路的激活有可能成为肿瘤治疗的新途径。关于Gli1 在结直肠癌中的作用存在争议,有研究证实Hedgehog 信号通路中的效应分子Shh、SMO、Gli1 在结直肠癌组织中高表达;而在伴有Wnt 信号通路活化的结肠癌细胞和组织中,Gli1 则处于沉默状态,且通过转染Gli1 基因可抑制肠癌细胞的增殖[6,7]。本研究结果发现,Gli1 在结直肠癌组织中高表达,其阳性率为43.4%,而正常结肠组织中为13.0%,说明Gli1 的高表达参与了结直肠癌的发生。进一步分析提示Gli1 的表达与肿瘤的组织学分型、病理分期及淋巴结是否转移有关,而与患者年龄、性别、肿瘤大小无关,组织学分化差、病理分期晚和有淋巴结转移的患者Gli1 阳性表达率高。据此可认为Hedgehog 信号通路在结直肠癌中是被激活的,效应分子Gli1 促进了正常结直肠组织向肿瘤的演变。
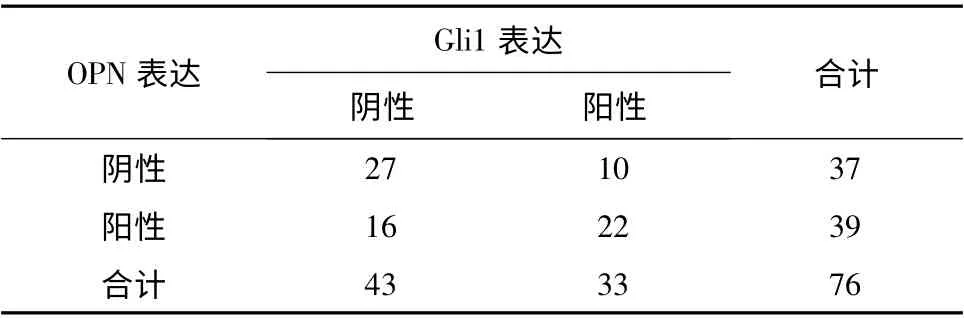
表2 Gli1 和OPN 之间表达的相关性
OPN 是一种分泌型磷酸化糖蛋白,分子质量约(41 ~72)kDa,富含与细胞黏附功能有关的精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列,广泛存在于骨组织、脉管系统、肾脏、炎症细胞和分泌型上皮细胞,同时也在多种肿瘤组织中呈高表达,参与恶性肿瘤的侵袭和转移过程,并与预后密切相关。已有研究证实OPNmRNA 在人类结直肠癌细胞株和组织中表达上调,且OPNmRNA 的表达状态为结直肠癌患者的独立预后因素[8]。通过RNA 干扰可抑制大肠癌细胞的增殖、侵袭、黏附和趋化能力,并起到放疗增敏作用[9]。Das 通过检测基底细胞癌组织中Gli1 和OPN 的表达发现,相对于局限性基底细胞癌,伴有转移灶的患者组织中二者表达明显升高,而且当Hedgehog 信号通路活化时,OPN 的表达也呈现上调状态;当该信号通路被特异性抑制剂Cyclopamine 阻断时,OPN 的表达随即下调。由此推测OPN 为Hedeghog 信号通路下游的效应蛋白,由Gli1 介导的OPN 上调可促进肿瘤细胞的恶性生物学行为[10]。本组结直肠癌OPN 阳性表达率为51.3%,结直肠癌组OPN 表达的阳性率较结正常结直肠组织高。OPN 表达与年龄、性别、肿瘤大小、组织学分化无关,但在淋巴结有转移、病理分期晚者表达明显高于淋巴结无转移、病理分期早者,差异均有统计学意义,提示OPN在结直肠癌发生发展中发挥重要作用。
双变量相关性分析表明,OPN 和Gli1 二者在结直肠癌组织中的表达正相关,证实了Gli1 的上调可促进其下游效应蛋白OPN 的表达,二者共同影响结直肠癌细胞的恶性增殖和浸润能力。至于Gli1 通过何种途径调控OPN 尚待进一步研究予以证实。
本研究证实了Hedgehog 信号通路在大肠癌中是激活的,Gli1 和OPN 都呈高表达,参与了结直肠癌的发生以及浸润和转移过程,二者在结直肠癌中的表达具有协同作用。因此检测Gli1 和OPN 可能有助于判断结直肠癌的生物学行为,为患者预后提供参考,并对结直肠癌的早期发现和靶向治疗带来新的思路。
1 Rubin LL,De Sauvage FJ. Targeting the Hedgehog pathway in cancer[J]. Nat Rev Drug Discov,2006,5(12):1026 -1033
2 Yoon JW,Kita Y,Frank DJ,et al. Gene expression profiling leads to identification of GLI1 -binding elements in target genes and a role for multiple downstream pathways in GLI1 - induced cell transformation[J].J Biol Chem,2002,277(7):5548 -5555
3 Qualtrough D,Buda A,Gaffield W,et al. Hedgehog signalling in colorectal tumour cells:induction of apoptosis with cyclopamine treatment[J].Int J Cancer,2004,110(6):831 -837
4 Chatel G,Ganeff C,Boussif N,et al. Hedgehog signaling pathway is inactive in colorectal cancer cell lines[J]. Int J Cancer,2007,121(12):2622 -2627
5 Ingham PW. Transducing Hedgehog:the story so far.[J]. EMBO J,1998,17(13):3505 -3511
6 Wang H,Li YY,Wu YY,et al. Expression and clinical significance of hedgehog signaling pathway related components in colorectal cancer[J]. Asian Pac J Cancer Prev,2012,13(5):2319 -2324
7 Akiyoshi T,Nakamura M,Koga K,et al. Gli1,downregulated in colorectal cancers,inhibits proliferation of colon cancer cells involving Wnt signalling activation[J].Gut,2006,55(7):991 -999
8 Li KW,Hong W,Shu WZ,et al. The potential of osteopontin as a therapeutic target for human colorectal cancer[J].J Gastrointest Surg,2011,15(4):652 -659
9 Li KW,Hong W,Shu WZ. Clinical significance of the upregulated osteopontin mRNA expression in human colorectal cancer[J]. J Gastrointest Surg,2010,14(1):74 -81
10 Das S,Harris LG,Metge BJ,et al. The hedgehog pathway transcription factor GLI1 promotes malignant behavior of cancer cells by up -regulating osteopontin[J]. J Biol Chem,2009,284(34):22888 -22897
