低氧下动脉粥样硬化大鼠KLF2 和eNOS 基因表达差异的研究
卢东东 周白丽
动脉粥样硬化(atherosclerosis,AS)是一种常见的动脉血管硬化性疾病,其病变主要累及体循环系统的大中型肌弹力型动脉。随着社会经济发展及人们生活方式的改变,动脉粥样硬化的发生率呈现逐年上升的趋势。而近年来的研究发现KLF2 参与血管内皮功能的调节对维持血管内环境的平衡有着重要的作用,且KLF2 可通过上调血管保护性因子及下调血管炎性因子的表达参与血管内皮细胞功能的调节[1~3]。众所周知,eNOS 在血管生成和血管内皮细胞迁移扮演着重要的角色,它可催化血管内皮生成一氧化氮(NO),对维持血管内皮细胞的功能有着重要的作用[4]。近年来对低氧下细胞功能和细胞信号的研究成为低氧生理研究的热点,青藏高原平均海拔在4000 米以上,高原缺氧条件下动脉粥样硬化的病理生理与平原地区有一定的差异。目前有关急性缺氧下动脉粥样硬化的研究较少,本课题使用低压氧舱模拟急性缺氧环境,通过研究不同急性缺氧时间下两组大鼠主动脉中KLF2 和eNOS 的表达的差异,探讨KLF2 在低氧条件下对细胞内皮功能的影响。
材料与方法
1.实验动物、试剂及主要仪器:(1)实验动物:雄性健康Wistar 大鼠47 只,由兰州大学实验动物中心提供(实验动物合格证号:0002511)。(2)主要试剂:牛血白蛋白、尼古丁(北京久峰润达生物技术有限公司)、维生素D3(大连美仑生物技术有限公司)、卵清白蛋白(美国Sigma 公司)、RNA 快速提取试剂盒(北京久峰润达生物技术有限公司)、cDNA 第一链合成试剂盒(北京天恩泽基因科技有限公司)、Taq DNA 聚合酶(北京天恩泽基因科技有限公司)、KLF -2、eNOS、GAPDH 引物(德国QIAGEN 公司QuaintTect®Primer Assay,货号分别为:QT01294272、QT00414085、QT00199633。注:具体引物序列因涉及知识产权保护,QIAGEN 公司未提供具体引物序列);(3)实验仪器:低温超速离心机(德国Eppendorf-5424R)、全自动生化分析仪(德国罗氏Modular DPP)、PCR 仪(德国Eppendorf Master- cycler PCR 仪)、凝胶成像系统(美国Bio - Rad 公司)、OLYMPUS 光学显微镜等。
2.动脉粥样硬化造模及分组:实验大鼠随机分为两组(造模组23 只、对照组24 只。因西宁地处青藏高原东北部,平均海拔2260 米,故未放入低压氧舱大鼠均为慢性缺氧大鼠)。造模组给予:牛血白蛋白32mg/kg 尾静脉注射,3 次/周,共9次;卵清白蛋白2.5mg/kg 腹腔注射,1 次/3 日,共5 次;维生素D325 万U/kg 灌胃,连续3 天。参考王园园等[5]关于大鼠动脉粥样硬化模型建立和评价的方法;尼古丁1mg/kg 腹腔注射,共2 周。参考Lou 等[6]血管内皮损伤模型造模方法;同时给予高脂饲料(上海斯莱克实验动物公司提供:猪油16.2%、蔗糖10.8%、酪蛋白9.6%、胆固醇1.3%、胆盐0.3%、甲基硫氧嘧啶0.1%)喂养,不限饮水。对照组给予同等量生理盐水处理、给予普通饲料喂养,不限饮水。
3.血脂检测:分别于造模开始前、造模6 周、造模12 周经大鼠尾静脉取血约0.5ml,离心后取上清,于-80℃保存,采血结束后同时送至青海省人民医院检验科使用全自动生化仪检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)水平。
4.急性缺氧模型:于造模结束后分别在造模组和对照组中随机选取15 只大鼠,同时放入青海大学医学院高原医学中心低压氧舱,设定时间分别为4、8、12h,分别为急性缺氧4、8、12h 造模组和急性缺氧4、8、12h 对照组,未放入低压氧舱大鼠为急性缺氧0h 组(既慢性缺氧组,分别为慢性缺氧造模组和慢性缺氧对照组),设定舱内海拔为5000 米,模拟高海拔低压低氧环境,到达设定时间后取出大鼠及时处死,留取标本。
5.主动脉形态观察:处死动物后取主动脉,剥离外膜脂肪组织,取胸主动脉约1cm,切成0.3cm 小段,放入10%中性甲醛溶液中固定过夜,常规脱水、石蜡包埋,连续切片,每个标本取3 张切片,经HE 染色后在光学显微镜下观察主动脉形态。
6.半定量RT -PCR 检测KLF2、eNOS、GAPDH 基因的表达:处死动物后,取主动脉,于-80℃保存。使用RNA 快速提取试剂盒提取大鼠主动脉组织中总RNA,溶于DEPC 水中,测定OD260/280 比值为1.85 ~1.96。取1.0μg 总RNA,用cDNA 第1 链合成试剂盒反转录为cDNA 后,取1μl 反转录产物行PCR 反应,反应条件:94℃预变性4min、94℃变性30s、60℃退火45s、72℃延伸1min、72℃最终延伸10min,共35 次循环。PCR 结束后取10μl 反应产物在1.7%琼脂糖凝胶中电泳,电泳结束后在凝胶成像系统下拍照,用Image J 软件分析各条带灰度值。
7.统计学方法:使用SPSS 19.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析。以P <0.05 为差异有统计学意义。
结 果
1.大鼠不同时期血脂水平比较:造模6 周时造模组大鼠血清TC、TG、HDL、LDL 含量明显高于同时期对照组(P <0.05);造模6 周时造模组大鼠血清TC、TG、HDL、LDL 含量明显高于造模前造模组大鼠(P <0.05);造模12 周时造模组大鼠血清TC、TG、LDL 含量明显高于同时期对照组(P <0.05);造模12 周时造模组大鼠血清TC、TG、LDL 含量明显高于造模前及造模6 周大鼠(P <0.05),详见表1。
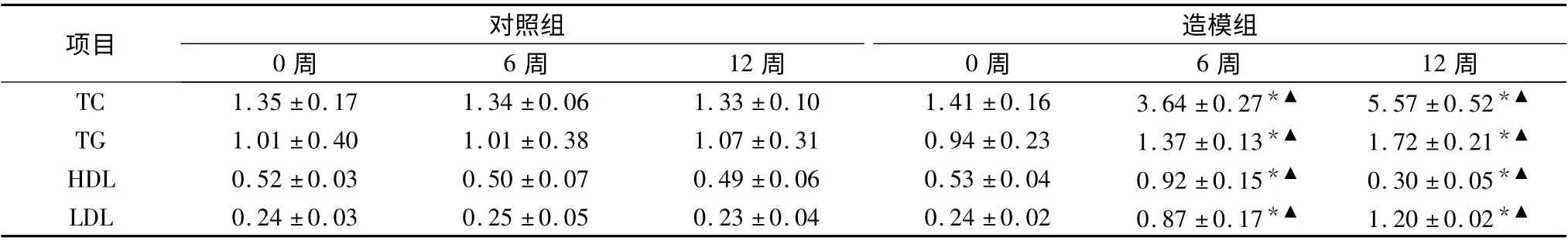
表1 两组大鼠不同时期血脂水平的比较(mmol/L)
2.大鼠主动脉形态观察(图1):光镜下,对照组大鼠主动脉内膜光滑完整,内皮细胞无增生,中膜平滑肌细胞、弹力纤维排列整齐连续、无中断;慢性持续缺氧造模组大鼠动脉内膜呈现不均一增厚,内膜细胞排列紊乱,中膜平滑肌细胞排列紊乱,中层弹力纤维钙化明显,排列紊乱,有不同程度的断裂和破坏,部分严重钙化,凸向血管腔,有少量泡沫细胞聚集;急性缺氧12h 造模组大鼠主动脉内皮细胞增生,内膜增厚明显,细胞排列紊乱,血管腔面不光整,血管中膜纤维组织增生,并有大量细胞碎片及钙化组织沉积,凸向血管腔。
3.半定量RT-PCR 检测大鼠KLF2、eNOS、GAPDH 基因的表达:(1)造模组大鼠给予急性缺氧4、8h处理后,造模组大鼠KLF2 表达水平明显高于相同急性缺氧时间对照组(P <0.05);造模组大鼠急性缺氧12h 组KLF2 表达水平明显低于慢性缺氧造模组和急性缺氧4h 造模组(P <0.05);慢性缺氧造模组大鼠KLF2 表达水平高于慢性缺氧对照组大鼠(P <0.05);急性缺氧12h 造模组组与急性缺氧12h 对照组比较无统计学差异(P >0.05)。(2)造模组大鼠给予急性缺氧4、8h 处理后,造模组大鼠eNOS 表达水平明显高于相同缺氧时间对照组(P <0.05);急性缺氧缺氧12h 对照组eNOS 表达水平明显高于慢性缺氧对照组和急性缺氧4h 对照组(P <0.05);慢性缺氧造模组大鼠eNOS 表达水平明显高于慢性缺氧对照组(P <0.05),详见表2,图2、图3。
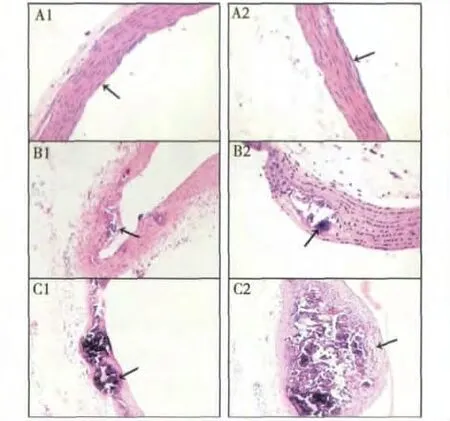
图1 不同缺氧时间动脉粥样硬化大鼠主动脉病理改变(HE 染色,10 ×40)

表2 两组大鼠不同急性缺氧时间KLF2、eNOS、GAPDH 的表达
图2 两组大鼠不同缺氧时间KLF2、eNOS、GAPDH 表达的比较
讨 论
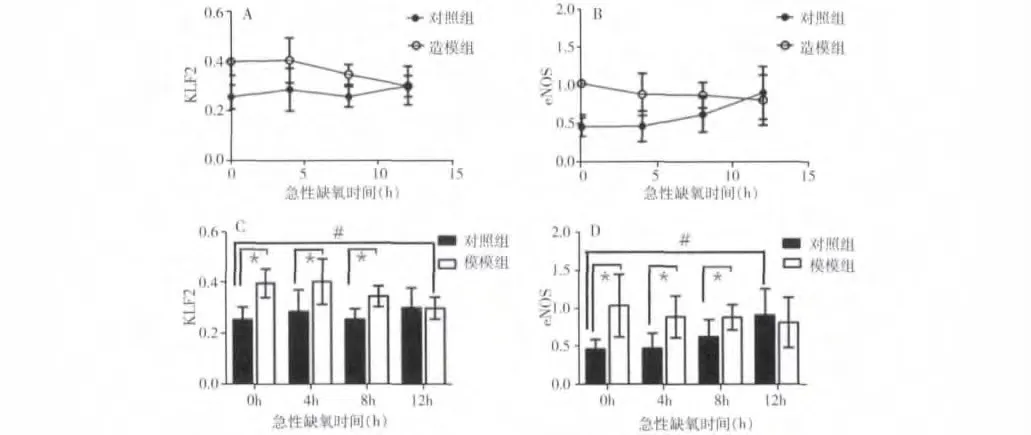
图3 两组大鼠不同缺氧时间KLF2、eNOS 的表达水平比较
KLFs 是锌指样转录因子家族的总称,是已经被证明了在多种细胞类型和器官系统中能广泛调节多种生理学和病理学过程的转录因子之一[7]。值得注意的是,在过去10 年的研究中认为KLFs 在多种细胞如内皮细胞(ECs)、巨噬细胞以及平滑肌细胞(SMCs)中可作为AS 的保护因子[8]。KLF2 是KLFs家族成员之一,它在内皮细胞以及与内皮细胞相关的细胞中高表达并充当“分子开关”的作用,因其在内皮细胞中起着抗炎、抗血栓形成、舒张血管、抗血小板的功能而发挥维持血管内皮功能平衡的作用[9]。eNOS 是一氧化氮合酶(NOS)3 种亚型之一,它可催化血管内皮生成一氧化氮(NO)协调血管内皮功能[4]。有文献报道随着急性缺氧时间的延长,eNOS在对照组大鼠中的表达逐渐增高,提示eNOS 在血管内的活化机制可能还有低氧的刺激有关[10]。
AS 的发病机制包括血管内皮和平滑肌细胞功能异常、白细胞浸润及其促炎作用的激活等方面,有研究发现在AS 小鼠中KLF2 表达是减少的[11]。其中的两个基因eNOS 和血栓调节蛋白已经被证实与KLF2 监管和启动子区域相关[1~3]。低层流条件可诱导KLF2 的表达,从而导致下调炎性基因如血管细胞黏附因子(VCAM)和E-选择素的表达,并上调血管保护性基因如内皮细胞一氧化氮合酶(eNOS)表达[1~3,12,13]。KLF2 通 过 募 集cAMP 途 径 效 应 因 子CBP/300 转录共激活因子调节血管内皮细胞的增殖与活化[2]。本研究中KLF2 高表达的大鼠eNOS 的表达也是升高的,与Lin 等的研究的结果相一致。同时KLF2 可通过感应动脉粥样硬化血管血流动力学剪切应力的变化调节血管内皮细胞炎症效应的活化效应,抑制动脉粥样硬化斑块的形成[14]。
高原缺氧对人体多个系统包括心血管系统、呼吸系统等功能发生改变。在缺氧环境下,动脉粥样硬化斑块的稳定性较常氧条件有所下降。张司兰等[15]的研究指出在低压低氧条件下,多个导致斑块稳定性下降的基因表达量升高,导致低压低氧条件下动脉粥样硬化斑块的稳定性下降。同时吕云辉等[16]的研究提示在低压低氧状态下,AS 斑块的稳定性下降,而心血管系统受到低氧、高二氧化碳等刺激时,自主神经的活性增加,通过调节血管内皮分泌多种血管活性物质来调节血管张力,导致血管内皮功能和血管张力发生变化,从而可引起动脉硬度和血压的变化。由此可知在低氧条件对AS 斑块的稳定性等各方面有一定的影响,本实验中观察到急性缺氧12h 造模组动脉粥样硬化病变较慢性缺氧造模组严重,提示急性缺氧条件可加重AS 病变的严重程度。
KLF2 和eNOS 对维持血管内皮细胞功能的稳定有着重要的作用,是血管内皮细胞的保护因子。Hae-Young 等[17]研究发现FOXO1 是一个负向调节KLF2 表达转录因子,并指出Fox 转录因子- 1(FOXO1)通过抑制对血管内皮细胞保护因子的表达从而引起血管内皮功能的损害。提示KLF2、eNOS 可能通过FOXO1 介导的转录调控参与了血管内皮细胞功能的调节。有研究提示,与常氧条件相比,在低氧条件下骨髓间质细胞内FOXO1 的表达是升高的[18]。但是在急性缺氧条件下动脉粥样硬化大鼠主动脉组织中KLF2 表达量的改变是否与FOXO1 途径相关还需进一步实验验证。
笔者的研究结果表明,急性缺氧条件能刺激对照组大鼠eNOS 的表达,从而发挥血管内皮功能调节的作用,且随着急性缺氧时间的延长,对照组大鼠主动脉中eNOS 的表达逐渐增高。同时我们的研究发现慢性持续缺氧造模组KLF2 表达水平明显高于慢性持续缺氧对照组,而在急性缺氧条件下,造模组KLF2表达水平逐渐下降尤其在急性缺氧12h 组,KLF2 表达水平明显低于慢性持续缺氧条件,说明急性的缺氧刺激能抑制动脉粥样硬化大鼠中KLF2 基因的激活从而导致KLF2 表达水平的降低,提示KLF2 在急性缺氧条件下也参与了动脉粥样硬化血管组织中内皮细胞功能的调节,慢性持续缺氧条件能刺激动脉粥样硬化大鼠中KLF2 的表达,但其具体的机制还需要进一步深入研究探讨。这些可能为在低氧下研究动脉粥样硬化的特殊病理生理提供新的研究思路和提示。
1 Lin Z,Kumar A,SenBanerjee S,et al.Kruppel-like factor 2(KLF2)regulates endothelial thrombotic function[J].Circ Res,2005,96:e48-e57
2 SenBanerjee S,Lin Z,Atkins GB,et al.KLF2 is a novel transcriptional regulator of endothelial proinflammatory activation[J]. Exp Med,2004,99:1305 -1315
3 Lin Z,Hamik A,Jain R,et al.Kruppel-like factor 2 inhibits protease activated receptor-1 expression and thrombin -mediated endothelial activation[J].Arterioscler Thromb Vasc Biol,2006,26:1185 -1189
4 Tejero J,Stuehr D. Tetrahydrobiopterin in nitric oxide synthase[J].IUBMB Life,2013,65:358 -365
5 王园园,龙民慧,邹民吉,等.大鼠动脉粥样硬化动物模型的建立和评价[J].中国实验动物学报,2008,12(6):421 -423
6 Luo HL,Zang WJ,Lu J,et al.The protective effect of captopril on nicotine—indnced endothelial dysfunotion in rat[J].Basic Clin Pharmacol Toxic,2006,99(3):237 -245
7 McConnell BB,Yang VW.Mammalian Kruppel-like factors in health and diseases[J].Physiol Rev,2010,90:1337 -1381
8 Alaiti MA,Orasanu G,Tugal D,et al. Kruppel -like factors and vascular inflammation:implications for atherosclerosis[J]. Curr Atheroscler Rep,2012,14:438 -449
9 Atkins GB,Jain MK.Role of Kruppel-like transcription factors in endothelial biology[J].Circ Res,2007,100:1686 -1695
10 Leucker TM,Bienengraeber M,Muravyeva M,et al.Endothelial -cardiomyocyte crosstalk enhances pharmacological cardioprotection[J].Mol Cell Cardiol,2011,51(5):803
11 Lingrel JB,Pilcher -Roberts R,Basford JE,et al. Myeloid - Specific Krüppel-like factor 2 inactivation increases macrophage and neutrophil adhesion and promotes atherosclerosis[J]. Circulation Research,2012,110:1294 -1302
12 Dekker RJ,van Soest S,Fontijn RD,et al.Prolonged fluid shear stress induces a distinct set of endothelial cell genes,most specifically lung Kruppel-like factor (KLF2)[J].Blood,2002,100:1689 -1698
13 Parmar KM,Larman HB,Dai G,et al.Integration of flow -dependent endothelial phenotypes by Kruppel - like factor 2[J]. Clin Invest,2006,116:49 -58
14 Huddleson JP,Srinivasan S,Ahmad N,et al.Fluid shear stress induces endothelial KLF2 gene expression through a defined promoter region[J].J Biol Chem,2004,385:723 -729
15 张司兰,谭朝阳,陈世伟,等.低压缺氧对兔动脉粥样硬化斑块中HIF-1a、VEGF 及MMP9 表达的影响[J]. 重庆医学,2011,40(6):542 -544
16 吕云辉,何忠明.急性低氧及高二氧化碳对阻塞性低通气综合征患者外周动脉硬度及血压的影响[J]. 中华结核和呼吸杂志,2009,32(1):42 -45
17 Hae-Young L,Seock -Won Y,Hyun -Jai C,et al. FOXO1 impairs whereas statin protects endothelial function in diabetes through reciprocal regulation of Kruppel - like factor 2[J]. Cardiovascular Research,2013,97:143 -152
18 Hsieh - Hsing L,Chia - Chi C,Ming - Jium S,et al. Hypoxia enhances chondrogenesis and prevents terminal differentiation through PI3K/Akt/FoxO dependent anti-apoptotic effect[J].Sci Rep,2013,3:2683

